О протекании реакции свидетельствует появление красно-фиолетовой окраски, характерной для солей титана(III) (см. пп. 3.5).
Тригалогениды представляют собой окрашенные (фиолетовый TiF3 , черно-зеленый ZrCl3) кристаллические вещества, построенные из связанных общими ребрами октаэдров. Низкие величины магнитных моментов указывают на наличие связи металл-металл М – М.
Общим свойством тригалогенидов является их высокая восстановительная активность, возрастающая в ряду Ti-Zr-Hf. Галогениды титана способны существовать в водных растворах, однако на воздухе легко окисляются:
4TiCl3 + O2 + 2H2O = 4TiOCl2 + 4HCl.
Из них наиболее устойчив трифторид TiF3, который при комнатной температуре можно хранить на воздухе. Тригалогениды циркония и гафния, напротив, не только легко окисляются кислородом, но и восстанавливают воду с выделением водорода:
2ZrBr3 + (4 + 2х)H2O = 2ZrO2×хH2O¯ + 6HBr + H2.
Водные растворы хлорида, бромида и иодида титана(III) устойчивы только в инертной атмосфере. При кристаллизации из растворов они выделяются в виде гексагидратов TiГ3×6Н2О. Для них характерна гидратная изомерия: [Ti(H2O)6]Cl3 имеет фиолетовую, а [TiCl2(H2O)4]Cl×2H2О – зеленую окраску. Одновременным растворением безводного галогенида титана(III) и галогенида щелочного металла в концентрированной соляной кислоте получают комплексные соли, например, красно-фиолетовые кристаллы Cs2TiCl5×4H2O, имеющие строение Cs2[TiCl2(H2O)4]Cl3 (P. J. McCarthy, M. F. Richardson, Inorg. Chem., 1983, 22, 2979).
При нагревании твердые тригалогениды диспропорционируют
2МХ3 = МХ2 + МХ4.
Дигалогениды титана представляют собой черные кристаллические вещества со слоистой структурой (структурный тип CdI2, см. гл. ). Большие расстояния между атомами титана (0,343 нм в TiCl2 и 0,412 нм в TiI2) исключают возможность прямого взаимодействия Ti-Ti, подобно тому, как это осуществляется в кластерах. Эти вещества синтезируют восстановлением три- или тетрагалогенидов
TiX4 + Ti = 2TiX2.
Восстановление тетрахлорида титана натрием в тетрагидрофуране приводит к образованию синих растворов, содержащих сольватированный хлорид титана(II).
Дополнение. Низшие галогениды циркония.
Монохлориды ZrCl и HfCl – термодинамически устойчивые вещества, малолетучие, в вакууме не разлагаются до 900 оС, обладают высокой электропроводностью. Например, хлорид циркония(I) синтезируют восстановлением тетрахлорида цирконием в вакуумированных танталовых трубках
3Zrтв. + ZrCl4,газ 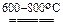 4ZrClтв.
4ZrClтв.
Эти соединения лишь формально можно рассматривать как производные металлов со степенью окисления +1. Они имеют слоистую графитоподобную структуру ( Рис. 3.19а, строение кластера ZrCl), содержащую слои металла и галогена.
При нагревании в токе водорода галогенид циркония(I) превращается в смесь гидрида и галогенида циркония(II):
600 °C
2ZrCl + H2 = ZrH2 + ZrCl2.
При восстановлении высших галогенидов порошком циркония образуются вещества, которым длительное время приписывали формулу ZrX2 (X = Cl, Br, I)
800 °C
ZrX4 + Zr = 2ZrX2.
В работах, проводимых под руководством Ф. Коттона, показано, что эти вещества представляют собой октаэдрические кластеры Zr6X12, в центрах которых расположен атом примеси. Таким образом, формула соединения имеет вид [Zr6X12Z], где Z = H, B, C, N и т.д. Атомы циркония непосредственно соединены друг с другом, образуя октаэдр, а также дополнительно связаны мостиковыми атомами галогена (Рис. 3.19б, строение кластера [Zr6Cl12Z]). Отдельные кластеры соединены друг с другом в более сложные структуры посредством мостиковых атомов галогена.
Если восстановление хлорида циркония(I) водородом проводить в присутствии хлорида калия, то образуется кластерный хлороцирконат K2Zr7Cl18, который постоен из октаэдрических кластеров Zr6Cl12, связанных через мостиковые атомы хлора с атомом циркония:
16 ZrCl + 2KCl + 9H2 = K2Zr7Cl18 + 9ZrH2.
Структура соединения такова, что на один кластер Zr6Cl12 приходится один атом циркония, находящийся в октаэдре из атомов хлора, и два атома калия (Рис. 3.19в, строение K2Zr7Cl18), что и дает общую стехиометрию K2(Zr6Cl12)(ZrCl6) или K2Zr7Cl18
(H. Imoto, J. D. Corbett, A. Cisar, Inorg. Chem., 1981, 20, 145).
КОНЕЦ ДОПОЛНЕНИЯ
Дата добавления: 2016-01-03; просмотров: 946;
