Аналитические реакции ортофосфат - ионов
Фосфат - ион РО43-, гидрофосфат - ион НРО42- дигидрофосфат - ион Н2РО4- - анионы трехосновной ортофосфорной кислоты Н3РО4, которая по первой стадии диссоциации является кислотой средней силы (pKi=2,15), а по второй и третьей - очень слабой кислотой (рК2= 7,21, рК3= 12,30).Обычно к фосфатам относятся соли ортофосфорной кислоты Н3РО4, пирофосфорной кислоты Н4Р2Оу, а также многочисленные конденсированные полифосфаты различного состава и строения (метафосфат калия КРО3, триполифосфаты). В фармацевтическом анализе чаще других встречаются анионы ортофосфорной кислоты - средний ортофосфат - ион РО43-, гидрофосфат - ион НРО42- и дигидрофосфат - ион Н2РО4-. Ортофосфаты аммония и щелочных металлов, а также дигидрофосфаты щелочно -земельных металлов растворимы в воде. Ортофосфаты других металлов, как правило, малорастворимы в воде, но обычно растворяются в минеральных кислотах и в уксусной кислоте (кроме FePO4. А1РО4. СгРО4. РЬ3(РО4)2, которые в уксусной кислоте не растворяются). Фосфат висмута (III) BiPO4 малорастворим в разбавленной азотной кислоте.
1.Реакция с ВаС12. 2 РО43- + 3 Ва2+ -= Ва3(РО4)2 (белый НРО42- + Ва2+ -+ ВаНРО4 (белый)В аммиачной среде реакция гидрофосфат- ионов с катионами бария приводит к образованию осадка среднего ортофосфата бария Ва3(РО4)2:
2 НРО42- + 3 Ва2+ + 2 NH3 -> Ва3(РО4)2 + 2 NH4+Свежеосажденный осадок Ва3(РО4)2 растворяется в FfNO3, HC1, СН3СООН.2.Реакция с нитратом серебра (фармакопейная).Реакцию проводят в нейтральной среде:РО43- + 3 Ag+ -> Ag3PO4 (желтый)НРО42- + 3 Ag+ -> Ag3PO4 + Н+ Осадок растворяется в азотной кислоте, в концентрированном аммиаке.
3.Реакция с магнезиальной смесью (фармакопейная)Гидрофосфат - ион НРО42~ при взаимодействии с магнезиальной смесью (MgCI2 + NH4CI + NH3) образует белый мелкокристаллический осадок магнийаммонийфосфата NH4MgPO4:
НРО42- + Mg2+ + NH3= NH4MgPO4
4. Реакция с молибдатом аммония (фармакопейная). Реакцию проводят в азотнокислой среде при нагревании:
РО43- + 3 NH4++ 12 МоО42- + 24 Н+ -> (NH4)3[PO4(MoO3)12] + 12 Н20
Выпадает желтый осадок фосфоромолибдата аммония.
Чувствительность реакции повышается при добавлении в раствор бензидина или кристаллического нитрата аммония NH4NO3
Проведению реакции мешают арсенат - ионы, которые дают аналогичный эффект, а также анионы - восстановители SO32-, S2O32-, S2- и др., восстанавливающие комплексный гетерополианион до молибденовой сини состава МоО5Мо2О36 Н2О.
Аналитические реакции нитрат - иона NO3-
Нитрат - ион NO3- - анион одноосновной сильной азотной кислоты HNO3. В водных растворах бесцветный нитрат - ион не гидролизуется, обладает окислительными свойствами. Как лиганд NO3- - мало эффективен и образует неустойчивые нитракомплексы металлов. Нитраты металлов хорошо растворяются в воде.
В отличие от нитритов, нитраты не обесцвечивают подкисленные водные растворы перманганата калия (фармакопейный тест).
1.Реакция с дифениламином (фармакопейная).
Эта реакция - общая для NO3- и NO2- и проводится точно так же, как и для нитрит -иона (см. выше); только вместо раствора нитрита натрия используют раствор нитрата натрия или калия. Данной реакцией нельзя открывать нитраты в присутствии нитритов.
2.Реакция с металлической медью (фармакопейная).
Реакцию проводят в среде концентрированной H2SO4 при нагревании.
2 NO3- + 8 Н++ 3 Си = 3 Си2++ 2 NOT + 4 Н2О 2NO + О2 --> 2 NO2j'(жeлтo-бypыe пары)
3.Реакция с сульфатом железа (II) и концентрированной серной кислотой.
Реакцию проводят при нагревании:
3 Fe2+ + Nft- + 4 Н+ ->■ 3 Fe3++ NO + 2 Н2О Fe2++ NO + SO42- -> [Fe NO]SO4 (бурый)
Эту реакцию дает и нитрит - ион, поэтому нельзя открыть этой реакцией нитрат - ион в присутствии нитрит- иона. Проведению реакции мешают Вг-, Г, SO32-, S2O32', CrO42-, MnO42-.
4.Реакция с металлическим алюминием или цинком.
3 NO3- + 8 А1 + 5 ОН- + 18 Н2О -> 3 NH3 + 8 [Al (OH)4]-
Выделяющийся аммиак ощущается по запаху и окрашивает влажную красную лакмусовую бумагу в синий цвет.Проведению реакции мешают катионы аммония NH4+, выделяющие аммиак в щелочной среде, а также другие анионы, способные восстанавливаться до аммиака (NO2-, SCN-, ферро - и феррицианид — ионы).
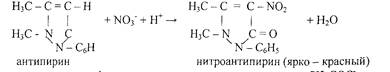
5.Реакция с антипирином. Реакцию проводят в кислой среде.
Дата добавления: 2016-01-16; просмотров: 4631;
