Элементы V A группы. Типичные свойства важнейших соединений мышьяка, сурьмы, висмута, их биологическая роль.
Простые вещества. Мышьяк, сурьма, висмут, как и фосфор, существуют в нескольких аллотропных модификациях. У мышьяка и сурьмы имеются неметаллические модификации – «жёлтый мышьяк» и «жёлтая сурьма», которые по строению подобны белому фосфору и состоят из молекул As4 и Sb4. Эти модификации неустойчивы и самопроизвольно превращаются соответственно в «серый мышьяк» и «серую сурьму», которые обладают металлическим блеском и электропроводностью. Слоистая структура, аналогичная чёрному фосфору, придаёт им значительную хрупкость. Так металлическая сурьма при растирании легко измельчается в порошок. У висмута существуют только металлические модификации. В обычных условиях висмут - хрупкий с красноватым оттенком металл. При температурах выше 1200С висмут приобретает ковкость и пластичность.При комнатной температуре As, Sb и Bi реагируют только с галогенами, образуя тригалогениды, а в случае сурьмы - и пентагалогениды. При нагревании на воздухе они сгорают с образованием оксидов Э2О3, а с расплавленной серой дают сульфиды Э2S3. Все простые вещества с металлами образуют сплавы, а также стехиометрические и нестехиометрические соединения:Ga + As Þ GaAs, 2Co + As Þ Co2As.
При сплавлении мышьяка, сурьмы, висмута с металлами могут получаться сплавы с эвтектиками, имеющими низкие температуры плавления. Например, широко применяемый сплав Вуда, с температурой плавления всего 60,50С, содержит 50% Bi, 25%Pb, 12,5%Sn и 12,5% Cd. Имея стандартные окислительно-восстановительные потенциалы положительнее потенциала водорода, мышьяк, сурьма и висмут не растворяются в кислотах-неокислителях и не реагируют с растворами щелочей. Кислоты-окислители окисляют мышьяк и сурьму до мышьяковой и сурьмяной кислот:
3As + 5HNO3 + 2H2O Þ 3H3AsO4 + 5NO,3Sb + 5HNO3 Þ 5NO + H2O + 3HSbO3 (b-сурьмяная кислота).Висмут в концентрированной азотной кислоте пассивируется, но в разбавленной кислоте растворяется с образованием нитрата висмута(III):
Bi + 4HNO3 Þ Bi(NO3)3 + NO + 2H2O.Металлические сурьма и висмут могут реагировать с концентрированной соляной кислотой в присутствии окислителя, например, пероксида водорода:
2Sb + 12HCl + 3H2O2 Þ 2H3[SbCl6] + 6H2O.
В природе мышьяк, сурьма и висмут находятся в виде сульфидных минералов: As2S3 – аурипигмент, As4S4 – реальгар, Sb2S3 – антимонит (сурьмяный блеск), Bi2S3 – висмутин (висмутовый блеск), FeAsS – арсенопирит и др.. Крайне редко эти элементы встречаются в самородном виде. Природные сульфиды обжигают и образующиеся оксиды восстанавливают коксом:2As2S3 + 9O2 Þ 2As2O3 + 6SO2,2As2O3 + 2C Þ As4+ 3CO.
Соединения мышьяка, сурьмы и висмута в степени окисления -3.
У мышьяка, сурьмы и висмута отрицательная степень окисления проявляется в соединениях с металлами и водородом - ЭН3.
Арсин - AsH3, стибин - SbH3 и висмутин - BiH3 - в обычных условиях это газообразные вещества с резким запахом, практически нерастворимые в воде. Вещества очень токсичны, особенно арсин. Их молекулы имеют такое же строение, как и молекула РН3:
Валентные углы Н-Э-Н близки к 900, что позволяет сделать вывод об отсутствии гибридизации атомных орбиталей у центрального атома. Поэтому у молекул почти отсутствуют донорные свойства, а, следовательно, и основные свойства. AsH3, SbH3 и BiH3 не взаимодействуют с водой и даже с сильными кислотами. Напротив, у стибина проявляются слабые кислотные свойства и, при пропускании через раствор нитрата серебра, он образует чёрный осадок малоустойчивого стибида серебра:SbH3 + 3AgNO3 Þ Ag3Sb¯ + 3HNO3.
Водородные соединения мышьяка, сурьмы и висмута термически неустойчивы (DН0обр.>0) и уже при комнатной температуре AsH3 и SbH3 медленно разлагаются, а BiH3 – очень быстро:
2ЭН3 Þ 2Э + 3Н2, Это обстоятельство не позволяет хорошо изучить свойства BiH3. Арсин и стибин проявляют сильные восстановительные свойства. Они горят на воздухе:2ЭН3 + 3О2 Þ Э2О3 + 3Н2О
и легко окисляются галогенами, серой, перманганатом калия, нитратом серебра(I): 2AsH3 + 12AgNO3 +3H2O Þ 12Ag + As2O3 + 12HNO3.ЭН3 можно получить действием разбавленных кислот на арсениды, стибиды и висмутиды:Mg3Э2 + 6HCl Þ 2ЭH3+ 3MgCl2.Арсин и стибин наиболее просто получаются действием цинка на подкисленные растворы соединений мышьяка и сурьмы:
As2O3 + 6Zn + 6H2SO4 Þ 2AsH3+ 6ZnSO4 + 3H2O.
В небольших количествах висмутин синтезируют термическим разложениием его алкильных производных, например CH3BiH2.При пропускании арсина через электрический разряд образуется диарсин - As2H4 - аналог дифосфина. Это бесцветное газообразное вещество, которое легко разлагается при температурах выше -1000С.
Соединения мышьяка, сурьмы и висмута с металлами - арсениды, стибиды (антимониды) и висмутиды можно разделить на солеподобные и металлоподобные. Солеподобные соединения образуются с s-элементами I и II групп (K3As, Ca3Sb2, Mg3Bi2 и др.). Такие вещества легко разлагаются водой или кислотами (см. получение ЭН3). Металлоподобные соединения часто не имеют стехиометрического состава, большинство из них обладают металлической (электронной) проводимостью, а арсениды и стибиды р-элементов являются полупроводниками, например, арсенид галлия (GaAs), который наряду с кремнием имеет первостепенное значение в современной полупроводниковой технике.
Кислородсодержащие соединения. У мышьяка, сурьмы и висмута существуют оксиды As2O3, As2O5, Sb2O3, Sb2O4, Sb2O5, Bi2O3, Bi2O5. Высшие оксиды имеют кислотный характер, а характер оксидов Э2О3 при движении по группе вниз изменяется от кислотного к основному. Для оксидов, гидроксидов и солей As(III), Sb(III), Bi(III) окислительно-восстановительные свойства не характерны, однако в этом ряду медленно нарастают окислительные свойства. В ряду кислородсодержащих соединений As(V), Sb(V), Bi(V) окислительные свойства возрастают очень сильно – производные Bi(V) относятся к сильнейшим окислителям.
^ Оксид мышьяка(III) - As2O3- твёрдое вещество белого цвета («белый мышьяк»), легко возгоняется (tвозг.=2180С). В газообразном и твёрдом виде состоит из молекул As4O6 (кубическая модификация, tпл.=2740С). Существуют и менее летучие модификации - моноклинная (tпл.=3150С) и стеклообразная (tкип.=4600С), представляющие собой слоистые полимеры, состоящие из пирамид [AsO3]. As2O3 растворяется в воде (2 г на 100 г воды при 200С), ещё лучше - в щелочах и в галогенводородных кислотах:As2O3 + 3H2O Þ 2H3AsO3,As2O3 + 6KOH Þ 2K3AsO3 + 3H2O,As2O3 + 2KOH + 3H2O Þ K[As(OH)4] (в избытке щёлочи),As2O3 + 8HCl Û 2H[AsCl4] + 3H2O.
Однако с кислородсодержащими кислотами As2O3 не реагирует, поэтому этот оксид относят к кислотным оксидам.
Несмотря на то, что оксид мышьяка(III) легко образуется при сгорании мышьяка и его сульфидов в кислороде воздуха:4As + 3O2 Þ 2As2O3,на практике его получают гидролизом AsCl3 в кипящей воде:AsCl3 + 3H2O Û As2O3¯ + HCl.^ Мышьяковистая кислота - H3AsO3- существует лишь в водных растворах. Её молекулы имеют форму пирамиды:,
что свидетельствует об sp3-гибридизации атомных орбиталей атома мышьяка и наличии у него неподелённой электронной пары. Мышьяковистая кислота - очень слабый электролит (Кa1=6×10-10), слабее угольной кислоты. При взаимодействии с растворами щелочей образует соли - ортоарсениты:
H3AsO3 + 3NaOH Þ Na3AsO3 + 3H2O
Растворимы в воде только арсениты щелочных металлов. Мета-форма мышьковистой кислоты HAsO2 не выделена, однако её производные - метаарсениты - известны. Это полимерные вещества, состоящие из цепочек пирамид AsO3, связанных через общие атомы кислорода. Метаарсениты щелочных и щелочноземельных металлов легко получаются при дегидратации гидроксокомплексов:
Na[As(OH)4] Þ NaAsO2 + 2H2O (при нагревании).
Мышьяковистая кислота имеет очень слабые амфотерные свойства (Кb=10-14) и с растворами кислородсодержащих кислот не реагирует. Однако взаимодействием мышьяковистой кислоты с концентрированными галогенводородными кислотами можно получить галогенидные комплексы. Эта реакция протекает через стадию образования не солей, а галогенангидридов AsHal3:
H3AsO3 + 3HCl Û AsCl3 + 3H3O,
AsCl3 + HCl Û H[AsCl4].
H3AsO3 и арсениты проявляют слабые восстановительные свойства и могут быть окислены до соединений мышьяка(V):
H3AsO3 + Br2 + H2O Û H3AsO4 + 2HBr ;
(DЕ0реакц.= Е0(Br2/Br-) - E0(H3AsO4/H3AsO3)=+1,09-0,56=+0,53B).
Получают растворы мышьяковистой кислоты растворением в воде «белого мышьяка» (см. свойства As2O3).
Оксид сурьмы(III) - твёрдое вещество (tпл.=6550С) белого цвета, малорастворимое в воде (0,002 г в 100 мл Н2О при 170С). В газообразном и твёрдом виде оксид состоит из молекул Sb4O6 и подобен кубической модификации As2O3. В отличие от последнего, Sb2O3 проявляет ярко выраженные амфотерные свойства:
Sb2O3 + 3H2SO4 (конц.) Þ Sb2(SO4)3 + 3H2O,*
Sb2O3 + 2NaOH + 3H2O Þ 2Na[Sb(OH)4].
В галогенводородных кислотах оксид сурьмы(III), также как и As2O3 растворяется с образованием комплексов:
Sb2O3 + 12HCl Þ 2H3[SbCl6] + 3H2O.
^ Гидроксид сурьмы(III)образуется в виде белого осадка неопределённого состава Sb2O3×nH2O при действии растворов щелочей на соли сурьмы(III) или трихлорид сурьмы:
2SbCl3 + 6NaOH +(n-3)H2O Þ Sb2O3×nH2O¯ + 6NaCl.
Он проявляет амфотерные свойства, легко растворяясь в кислотах и щелочах (см. Sb2O3).
Соли Sb3+ в водных растворах неустойчивы и гидролизуются с образованием смеси основных солей, содержащих оксо- и гидроксогрупы, например, Sb2O4(OH)2(NO3)2, Sb6O7(SO4)2 и др.. Эти полиядерные соединения состоят из пирамид [SbO3], соединённых мостиковыми атомами кислорода, нитратными и сульфатными группами. Так как стехиометрический состав соединений примерно соответствует соотношению Sb:O=1:1, то для простоты формулы таких солей можно условно записать, как соли стибила SbO+: (SbO)NO3, (SbO)2SO4.
Оксид висмута Bi2O3- бледно-жёлтое кристаллическое вещество, существует в четырёх модификациях. При комнатной температуре устойчива a-модификация (tпл.=8240С, tкип.=18900С, летуч при t>9500C). Bi2O3 не растворяется в воде, но растворим в сильных кислотах:
Bi2O3 + 6HNO3 Þ 2Bi(NO3)3 + 3H2O.
Оксид висмута(III) относят к основным оксидам.
Однако расплавленный Bi2O3 реагирует с основными оксидами образуя висмутиты:
Bi2O3 + 3Li2O Þ 2Li3BiO3.
Висмутиты щелочных металлов полностью разлагаются водой до гидроксида висмута(III):
Li3BiO3 + 3H2O Þ Bi(OH)3¯ + 3LiOH.
В очень концентрированных растворах щелочей Bi2O3 растворяется, образуя гидроксокомплексы:
Bi2O3 + 6NaOH + 3H2O Þ 2Na3[Bi(OH)6].
Гидроксокомплексы висмута(III) являются димерами – Na6[Bi2O2(OH)6](OH)2.
Получают Bi2O3 термическим разложением нитрата висмута(III):
2Bi(NO3)3 Þ 2Bi2O3 + 2NO2 + O2.
^ Гидроксид висмута(III) имеет переменный состав, но ему обычно приписывают формулу Bi(OH)3.Это белое малорастворимое в воде вещество, при нагревании отщепляет воду, превращаясь в оксид. Гидроксид висмута(III) является основанием с очень слабо выраженными амфотерными свойствами.
В растворах соли Bi3+ устойчивы только в присутствии избытка соответствующих кислот. При рН 2 - 4 они гидролизуются, образуя основные соли, содержащие многоядерные катионы:
6Bi3+ + 8H2O Û [Bi6O4(OH)4]6+ + 12H+.
Соли оксо-гидроксокомплекса висмута(III), могут быть выделены в твёрдом виде, например, нитрат - [Bi6O4(OH)4](NO3)6×H2O, которому ранее приписывали формулу (BiO)NO3×0,5H2O.
В присутствии галогенид-ионов соли Bi3+ гидролизуются с образованием малорастворимых осадков оксогалогенидов висмута(III):
Bi3+ + Cl- + H2O Û BiOCl¯+ 2H+.
Гидроксид висмута(III), в отличие от гидроксида сурьмы(III), проявляет слабые окислительные свойства и может быть восстановлен соединениями олова(II):
2Bi(OH)3 + 3Na2[Sn(OH)4] Þ 2Bi¯+ 3Na2[Sn(OH)6].
Эта реакция используется в аналитической химии для обнаружения ионов висмута(III). Кроме того, ионы Bi3+можно определить по образованию растворимого комплекса жёлтого цвета с тиомочевиной:
Bi3+ + 3SC(NH2) Þ [Bi(SC(NH2))3]3+.
Гидроксид висмута(III) получают приливанием раствора нитрата висмута(III) к раствору щёлочи:
3NaOH + Bi(NO3)3 Þ Bi(OH)3¯+ 3NaNO3.
При обратном порядке сливания растворов осаждается малорастворимая основная соль:
Bi(NO3)3 + 2NaOH Þ (BiO)NO3¯ + 2NaNO3 + H2O.
^ Оксид мышьяка(V) - As2O5- гигроскопичное белое стекловидное вещество, похожее на оксид фосфора(V). При нагревании выше 3150С разлагается:
As2O5 Þ As2O3 + O2.
Это кислотный оксид и при растворении в воде образует ортомышьяковую кислоту:
As2O5 + 3H2O Þ 2H3AsO4.
Получают мышьяковый ангидрид из H3AsO4 осторожным нагреванием при температуре 280-3000С:
2H3AsO4 Þ As2O5 + 3H2O.
^ Ортомышьяковая кислота - H3AsO4 -кристаллическое вещество белого цвета (tпл.=35,50С), очень гигроскопичное и хорошо растворимое в воде. По строению и кислотным свойствам напоминает ортофосфорную кислоту: Кa1=6,3×10-3, Кa2=1,2×10-7, Кa3=3,2×10-12. H3AsO4 образует три ряда солей - ортоарсенатов - изоморфных соответствующим ортофосфатам, например Na3AsO4, Na2HAsO4, NaH2AsO4. По поведению в водных растворах (гидролиз, реакции осаждения) средние и кислые соли мышьяковой кислоты аналогичны фосфатам. Так соли магния в присутствии NH4OH и NH4Cl образуют растворимый в кислотах белый кристаллический осадок MgNH4AsO4×6H2O, подобный MgNH4PO4×6H2O. С «молибденовой жидкостью» и ортоарсенаты и ортофосфаты образуют жёлтые кристаллические осадки солей гетерополикислот: (NH4)3H4[As(Mo2O7)6], (NH4)3H4[P(Mo2O7)6]. Отличить арсенаты от фосфатов можно реакцией с нитратом серебра(I): выделяющийся осадок Ag3AsO4 имеет шоколадно-бурый цвет, а Ag3PO4 – жёлтый.
При нагревании, по мере повышения температуры, H3AsO4 превращается в димышьяковую кислоту, затем в полимерную метамышьяковую кислоту, с образованием в конечном итоге As2O5:
Ортомышьяковая кислота, в отличие от H3PO4, проявляет слабые окислительные свойства (Е0(H3AsO4/H3AsO3)=+0,56 В):
H3AsO4 + 2KI + H2SO4 Û H3AsO3 + I2 + K2SO4 + H2O.
Это одна из немногих обратимых окислительно-восстановительных реакций - в щелочной среде она протекает справа налево.
Получают H3AsO4 взаимодействием элементарного мышьяка или As2O3 с концентрированной азотной кислотой:
As2O3 + 2HNO3 + 2H2O Þ NO2 + NO + 2H3AsO4.
Оксид сурьмы(V) – Sb2O5 –бледно-жёлтый порошок, малорастворимый в воде (0,2 г в 100 мл H2O при 200С). Это кислотный оксид – его водный раствор имеет кислую реакцию. При нагревании (t>3500C) оксид сурьмы(V) разлагается с образованием смешанного оксида сурьмы(III,V) – Sb2O4:
2Sb2O5 Þ 2Sb2O4 + O2.
При растворении Sb2O5 в растворах щелочей образуются гидроксокомплексы:
Sb2O5 + 2NaOH + 5H2O Þ 2Na[Sb(OH)6].
Соединения сурьмы(V) проявляют окислительные свойства, поэтому при взаимодействии Sb2O5 c концентрированной соляной кислотой протекает обратимая окислительно-восстановительная реакция:
Sb2O5 + 16HCl Û 2H3[SbCl6] + 2Cl2 + 5H2O.
Сплавлением Sb2O5 с оксидами металлов получаются соли стибаты (антимонаты) как мета-, так и орто-форм, например, NaSbO3, AlSbO4.
Получают Sb2O5 обезвоживанием сурьмяной кислоты:
2H3SbO4 Þ Sb2O5 + 3H2O.
^ Сурьмяная кислота – Sb2O5×nH2O (условная формула: H3SbO4) –плохо растворимый в воде белый порошок, который получают окислением металлической сурьмы концентрированной азотной кислотой:
2Sb + 2nHNO3 Þ Sb2O5×nH2O¯ + 2nNO2,
либо гилролизом SbCl5 при нагревании:
2SbCl5 + (5+n)H2O Þ Sb2O5×nH2O¯ + 10HCl.
При нагревании (t<4000C) кислота переходит в оксид сурьмы(V). Растворением сурьмяной кислоты в концентрированных растворах щёлочи получают стибаты (антимонаты), которые существуют в форме гексагидроксостибат-ионов [Sb(OH)6]–:
Sb2O5×nH2O + 2NaOH +(5–n)H2O Û 2Na[Sb(OH)6].
В слабощелочной среде в результате реакций поликонденсации образуются
многоядерные оксогидроксокомплексы сложного состава.
^ Оксид висмута(V) – Bi2O5 –красно-коричневое твёрдое вещество, можно получить взаимодействием Bi2O3 с озоном. Bi2O5 очень плохо растворяется в воде, при нагревании разлагается с постепенным отщеплением кислорода:
2Bi2O5 Þ 2Bi2O4 + O2, 2Bi2O4 Þ 2Bi2O3 + O2.
Достоверные данные о существовании гидроксида висмута(V) отсутствуют. Однако окислением соединений висмута(III) в щелочной среде сильными окислителями можно получить соединения висмута(V) неопределённого состава – висмутаты, которым для простоты приписывают условную формулу MIBiO3:
Bi2O3 + 2Na2O2 Þ 2NaBiO3 + Na2O,
Bi2O3 + 6NaOH + 2Br2 Þ 2NaBiO3¯+ 4NaBr + 3H2O.
Оксид висмута(V) и висмутаты – сильные окислители. Стандартный окислительно-восстановительный потенциал в кислой среде NaBiO3®Bi3+ составляет +1,8 В. Висмутаты в лабораторной практике широко используются в качестве эффективных окислителей. Например, для качественного обнаружения ионов Mn2+ в растворе применяют реакцию:
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 Þ 2HMnO4 + 5Bi(NO3)3 + 5NaNO3 + 7H2O.
Соединения с галогенами занимают важное место в химии висмута, сурьмы и в особенности мышьяка. Мышьяк, сурьма и висмут(III) образуют фториды, хлориды, бромиды и иодиды, а из соединений висмута(V) получены только фториды. Галогениды ЭHal3 и ЭHal5 по своей природе являются галогенангидридами, но отличаются некоторыми особенностями в реакциях с водой. Физические свойства соединений приведены в таблице 2. В газовой фазе молекулы тригалогенидов имеют строение тригональной пирамиды (sp3-гибридизация орбиталей центрального атома):
Пентагалогениды в газовой фазе (a) состоят из молекул ЭF5, имеющих форму тетрагональной пирамиды (sp3d2-гибридизация), а в жидком и твёрдом состоянии (b) – из полимерных молекул – цепочек октаэдров с общими вершинами:
Наличие вакантных d-орбиталей у центральных атомов делает эти вещества сильнейшими кислотами Льюиса, поэтому ЭHal3 и ЭHal5 способны присоединять молекулы воды и галогенид-ионы с образованием комплексных соединений:
SbCl5 + H2O Û [SbCl5(H2O)] Û H+ + [SbCl5(OH)]–,
SbCl5 + HCl Û H[SbCl6] Û H+ + [SbCl6]–,
SbCl5 + NaCl Û Na[SbCl6] Û Na+ + [SbCl6]–,
AsCl3 + NaCl Þ Na[AsCl4],
BiI3 + KI Û K[BiI4].
Следует отметить, что растворением в плавиковой кислоте SbF5 можно существенно увеличить её кислотность:
HF + SbF5 Û H+ + [SbF6]–.
Смесь, состоящая из SbF5 и фторсульфоновой кислоты HSO3F, называется «сверхкислотой» и по кислотности превосходит серную в 1012 раз. Сверхкислота способна протонировать галогены, серу и даже алканы:
SbF5 + HSO3^ F Û H[SbF5(SO3F)],
C(CH3)4 + H[SbF5(SO3F)] Û [C(CH3)3]+[SbF5(SO3F)]– + CH4.
Гидролиз тригалогенидов имеет особенности, связанные с природой элемента. Так, при взаимодействии с водой галогенидов мышьяка(III), образуются кислоты, но, в отличие от PHal3, гидролиз AsHal3 обратим:
AsCl3 + 3H2O Û H3AsO3 + 3HCl,
и из крепких солянокислых растворов при кипячении отгоняется AsCl3.
Тригалогениды сурьмы и висмута в небольшом количестве воды растворяются, при этом образуются прозрачные растворы. Чрезвычайно высокая растворимость SbCl3 (см. табл.2) позволяет предположить, что в концентрированных растворах трихлорида сурьмы находятся аквохлоридные комплексы типа [SbCl3(H2O)] и [SbCl3(H2O)3]. При разбавлении растворов SbCl3 и BiCl3 выделяются белые малорастворимые вещества - оксохлориды SbOCl* и BiOCl. По-видимому, их образованию предшествует целый ряд процессов - реакции замещения хлорид-ионов на воду (акватация):
[Sb(H2O)3Cl3] + H2O Û [Sb(H2O)4Cl2]+ + Cl-,
[Sb(H2O)4Cl2]+ + H2O Û [Sb(H2O)5Cl]2+ + Cl-,
и кислотно-основные взаимодействия - отщепление протона от координированных молекул воды с образованием гидроксокомплексов:
[Sb(H2O)5Cl]2+ + H2O Û [Sb(H2O)4(OH)Cl]+ + H3O+,
[Sb(H2O)4(OH)Cl]+ + H2O Û [Sb(H2O)3(OH)2Cl]0 + H3O+.
Процесс завершается оксоляцией координированных гидроксо-ионов:
[Sb(H2O)3(OH)2Cl]0 Û SbOCl¯ + 4H2O.
Гидролиз трихлоридов сурьмы и висмута можно записать суммарными уравнениями:
SbCl3 + H2O Û SbOCl¯+ 2HCl, BiCl3 + H2O Û BiOCl¯+ 2HCl.
Равновесия могут быть смещены влево добавлением концентрированной соляной кислоты.
В растворах концентрированных галогенводородных кислот и их солей тригалогениды превращаются в комплексы [ЭHal6]3– и [ЭHal4]–:
SbCl3 + 3HCl Û H3[SbCl6], SbCl3 + 3NaCl Û Na3[SbCl6],
AsCl3 + HCl Û H[AsCl4], BiI3 + KI Û K[BiI4].
Высшие галогениды проявляют окислительные свойства. При нагревании они диссоциируют, претерпевая внутримолекулярное окисление-восстановление:
ЭHal5 Û ЭHal3 + Hal2.
Поэтому некоторые бромиды и, особенно, иодиды неустойчивы, например BiI5 не существует, а AsI5 и SbI5 в водных растворах восстанавливаются иодид-ионами:
SbI5 + H2O Þ SbOI + I2 + 2HI.
Хлориды более устойчивы, например, H[SbCl6] при нагревании в концентрированной соляной кислоте восстанавливается, но реакция протекает обратимо:
H[SbCl6] + 2HCl Û H3[SbCl6] + Cl2.
Пентафторид висмута – очень сильный окислитель и окисляет воду с образованием озона:
3BiF5 + 3H2O Þ 3BiF3 + 6HF + O3.
^ Получение галогенидов. Тригалогениды получают взаимодействием простых веществ с умеренным количеством галогена:
2Sb + 3Cl2 Þ 2SbCl3 ,
или кипячением оксидов в концентрированных галогенводородных кислотах:
As2O3 + 6HCl Û 2AsCl3 + 3H2O.
Пентагалогениды синтезируют действием избытком галогена на тригалогениды:
BiF3 + F2 Þ BiF5,
а также – галогенводородов на оксиды:
Sb2O5 + 10HCl Þ 2SbCl5 + 5H2O.
Для мышьяка, сурьмы и висмута известны галогениды, в которых элементы проявляют нетипичные для них чётные степени окисления, например, AsF4, As2I4, SbCl4, BiCl4, BiI. Некоторые из этих веществ построены из многоядерных молекул, содержащих элементы в разных степенях окисления. Кроме того, получены смешанные галогениды. Так, при взаимодействии AsF3 c SbF3, образуется соединение [AsF2][SbF4], а при действии Cl2 на AsF3 получается димер [AsCl4]+[AsF6]–.
Пентафториды применяют как фторирующее реагенты. AsCl3 и SbCl3 являются исходными веществами для синтеза многих неорганических и органических производных мышьяка и сурьмы. BiI3 применяют в качестве реактива на алкалоиды (хинин, кофеин, никотин, морфин и др.).
Соединения с серой Э2S3, Э2S5 – малорастворимые в воде соединения с характерной окраской:
As2S3 - жёлтый, As2S5 - лимонно-жёлтый, Sb2S3 - оранжево-красный, Sb2S5 - тёмно-оранжевый, Bi2S3 - чёрный.
По кислотно-основным свойствам сульфиды мышьяка, сурьмы и висмута повторяют свойства соответствующих оксидов. Так сульфиды As2S5, As2S3, Sb2S5 – типичные кислотные сульфиды, и реагируют с растворами основных сульфидов, образуя растворимые и устойчивые в воде тиосоли (или сульфидные комплексы):
As2S5 + 3Na2S Þ 2Na3AsS4,
Sb2S5 + 3Na2S Þ 2Na3SbS4.
As2S3 + Na2S Þ 2NaAsS2
B отличие от сульфидов мышьяка Sb2S3, имеет амфотерный характер и растворим в сульфидах щелочных металлов и концентрированной соляной кислоте:
Sb2S3 + 3Na2S Þ 2Na3SbS3
Sb2S3 + 12HCl Û 2H3[SbCl6] + 3H2S.
Сульфид сурьмы(V) также растворяется в концентрированной соляной кислоте, однако эта сложная реакция сочетается с окислительно-восстановительной:
Sb2S5 + 12HCl Þ 2H3[SbCl6] + 3H2S + 2S¯ (при нагревании).
Сульфид Bi2S3 - основной, поэтому его можно растворить только в кислотах: концентрированных HCl и HNO3 -
Bi2S3 + 12HCl Û 2H3[BiCl6] + 3H2S,
3Bi2S3 + 8HNO3 Þ 2Bi(NO3)3 + 2NO + 9S + 4H2O.
Рассмотренные выше сульфиды получают действием сероводорода на кислые (рН=0,6) растворы соединений мышьяка, сурьмы или висмута, например:
2H3AsO4 + 5H2S Þ As2S5 + 8H2O,
либо разложением тиосолей 6-ти молярным раствором соляной кислоты:
2Na3AsS4 + 6HCl Þ As2S5 + 6NaCl + 3H2S.
Из простых веществ получить сульфиды Э2S3 и Э2S5 сложно, так как в этом случае могут образовываться смешанные сульфиды, полисульфиды и другие соединения со сложной структурой. Так, при сплавлении мышьяка с серой, в зависимости от условий получаются тёмно-красного цвета сульфид As4S4 (встречается в природе в виде минерала реальгар), а также сульфид As4S6. Оба сульфида следует рассматривать как производные тетраэдрического мышьяка As4. Их молекулы имеют клеточное строение, подобное As4O6 (или Р4О6), с тем отличием, что в As4S4 частично сохранены связи As-As.
Кислотные сульфиды растворяются не только в растворах основных сульфидов, но и в щелочах:
Sb2S3 + 6NaOH Þ Na3SbS3 + Na3[Sb(OH)6].
Следует отметить, что кислотные свойства сульфидов мышьяка выражены настолько сильно, что As2S3 и A2S5способны растворяться в растворе (NH4)2CO3, имеющего слабощелочную среду (рН=9).
As2S5 + 3(NH4)2CO3 Þ (NH4)3AsS4 + (NH4)3AsO4 + 3CO2.
Практически важным свойством сульфидов мышьяка(III) и сурьмы(III) является то, что они довольно легко окисляются, например, полисульфидом аммония:
Sb2S3 + 2(NH4)2S2 + (NH4)2S Þ 2(NH4)3SbS4.
Применение мышьяка, сурьмы и висмута весьма разнообразно. Так неорганические и органические производные мышьяка применяют в сельском хозяйстве для борьбы с вредными насекомыми и грызунами, а в медицине в качестве лекарственных препаратов. Арсениды галлия и р-элементов используются в электронике как полупроводниковые материалы. Сурьму и висмут применяют в составе разнообразных сплавов для придания им специфических физических и химических свойств. Так олово, содержащее небольшие количества сурьмы, устойчиво к «оловянной чуме», а присадки сурьмы в свинце повышают его коррозионную стойкость. Сурьма и висмут входят в состав многих легкоплавких сплавов (припоев). Оксиды элементов находят применение в производстве керамики и стекла. Галогениды мышьяка и сурьмы применяют как катализаторы при получении многих органических веществ.
Соединения сурьмы, висмута и, особенно мышьяка, чрезвычайно токсичны.
Элементы VI А группы. Важнейшие соединения кислорода, их типичные свойства, биологическая роль. Пероксид водорода. Биологическая роль соединений серы. Аналитические реакции на ионы SO42–.
Элементы VI А группы (кроме полония) называются халькогенидами. На внешнем электронном уровня этих элементов находятся шесть валентных электронов (ns2np4),поэтому они в нормальном состоянии проявляют валентность 2, а в возбужденном -4 или 6 (кроме кислорода). Атом кислорода отличается от атомов других элементов подгруппы отсутствием d-подуровня во внешнем электронном слое, что обуславливает большие энергетические затраты на «распаривание» его электронов, некомпенсируемые энергией образования новых ковалентных связей. Поэтому ковалентность кислорода равна двум. Однако в некоторых случаях атом кислорода, обладающий неподеленными электронными парами, может выступать в качестве донора электронов и образовывать дополнительные ковалентные связи по донорно-акцепторному механизму.
Электроотрицательность этих элементов постепенно уменьшается в порядке О-S-Se-Те-Ро. Cтепень окисления от -2,+2,+4,+6 . Увеличивается радиус атома, что ослабляет неметаллические свойства элементов.
Элементы этой подгруппы образуют с водородом соединения вида H2R(H2О,H2S,H2Se,H2Те,H2Ро).Эти соединения растворяясь в воде, образуют кислоты. Кислотные свойства увеличиваются в направлении H2О→H2S→H2Se→H2Те→H2Ро. S,Se и Те образуют с кислородом соединения типа RO2 и RO3. Из этих оксидов образуются кислоты типа H2RO3 и H2RO4. С увеличением порядкового номера,силы кислот уменьшаются. Все они имеют окислительные свойства. Кислоты типа H2RO3 проявляют и восстановительные свойства.
Кислород
Природные соединения и получения: Кислород - самый распространенный элемент земной коры. В свободном состоянии он находится в атмосферном воздухе (21%); в связанном виде входит в состав воды (88,9%), минералов, горных пород и всех веществ, из которых построены организмы растений и животных. Атмосферный воздух представляет собой смесь многих газов, основную часть которой составляют азот и кислород, и небольшое количество благородные газы, углекислый газ и водяные пары. Углекислый газ образуется в природе при горении дерева, угля и других видов топлива, дыхании животных, гниении. В некоторых местах земного шара CO 2 выделяется в воздух вследствие вулканической деятельности, а также из подземных источников.
Природный кислород состоит из трех стабильных изотопов: 816О(99,75%),817О(0,04),818О(0,20). Искусственным путем были также получены изотопы 814О, 815О, 819О.
Кислород был получен впервые в чистом виде К.В.Шееле в 1772 г., а затем в 1774 г. Д.Ю.Пристли, который выделил его из HgO. Однако Пристли не знал, что полученный им газ входит в состав воздуха. Только спустя несколько лет Лавуазье,подробно изучивший свойства этого газа , установил, что он является основной частью воздуха.
В лаборатории кислород получается следующими методами:
Электролизом воды. Чтобы увеличить электропроводность воды в нее добавляют раствор щелочи (обычно 30%-ый KOH) или сульфаты щелочных металлов:
В общем виде: 2H2О →2H2+О2
На катоде: 4H2О+4e¯→ 2H2+4OH¯
На аноде: 4OH−4е→2H2О+О2
- Разложением кислородосодержащих соединений:
Термическое разложение Бертолетовой соли под действием катализатора MnO2.
KClO3→2KCl+3О2
Термическое разложение перманганата калия
KMnO4→K2MnO4+MnO2+О2.
Термическое разложение нитратов щелочных металлов:
2KNO3→2KNO2+О2.
Разложением пероксидов:
2H2О 2→2H2О+О2.
2ВаО2→2ВаО+О2.
Термическим разложением оксида ртути (II):
2HgO→2HgO+О2.
- Взаимодействием пероксидов щелочных металлов с оксидом углерода (IV):
2Na2О2+2CO2→2Na2CO 3+О2.
Термическим разложением хлорной извести в присутствии катализатора - солей кобальта:
2Ca(OCl)Cl →2CaCl 2+О2.
-Окислением пероксида водорода перманганатом калия в кислой среде:
2KMnO4+H2SO4+5H2О 2→K2SO4 +2Mn SO4+8H2О+5О2.
В промышленности: В настоящее время в промышленности кислород получают фракционной перегонкой жидкого воздуха . При слабом нагревании жидкого воздуха из него сначала отделяется азот (tкип(N2)=-196ºC), затем выделяется кислород (tкип(О2)=-183ºС).
Кислород полученный этим способом содержит примеси азота. Поэтому для получения чистого кислорода полученную смесь заново дистиллируют и в конечном итоге получается 99,5% кислород. Кроме того некоторое количество кислорода получают электролизом воды. Электролитом служит 30% раствор KOH.
Кислород обычно хранят в баллонах синего цвета под давлением 15МПа.
Физико-химические свойства: Кислород - газ без цвета , запаха , вкуса , немного тяжелее воздуха, слабо растворяется в воде. Кислород при давлении 0,1 МПа и температуре -183ºС переходит в жидкое состояние, при -219ºС замерзает. В жидком и твердом состоянии притягивается магнитом.
Согласно методу валентных связей строение молекулы кислорода, представленное схемой -:Ö::Ö:, не объясняет большую прочность молекулы, имеющей паромагнитные свойства, то есть неспаренные электроны в нормальном состоянии.
В результате связи электронов двух атомов образуется одна общая электронная пара, после этого неспаренный электрон в каждом атоме образует взаимную связь с неразделенной парой другого атома и между ними образуется трех электронная связь. В возбужденном состоянии молекула кислорода проявляет диамагнитные свойства, которым соответствует строение по схеме :Ö=Ö:,
Для заполнения электронного уровня в атоме кислорода не хватает двух электронов. Поэтому кислород в химических реакциях может легко присоединять два электрона и проявлять степень окисления -2. Кислород только в соединениях с более электроотрицательным элементом фтором проявляет степень окисления +1 и +2: О2F 2,ОF
Пероксид водорода
Пероксид водорода H2O2 - соединение водорода cкислородом, содержащее рекордное количество кислорода – 94% по массе. В молекулах Н2О2 содержатся пероксидные группы –О–О–которые во многом определяют свойства этого соединения.
Из-за несимметричного распределения связей Н-О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, приводящая к их ассоциации. Поэтому в обычных условиях пероксид водорода- сиропообразная жидкость бледно-голубого цвета (плотность 1,44) с довольно высокой температурой кипения (150ºС). При хранении Н2О2разлагается. 2H2O2 ® 2H2O + O2.
Получение Н2О2.Молекулы Н2О2 всегда получаются в небольших количествах при горении и окислении различных соединений. При горении Н2О2 образуется либо при отрыве атомов водорода от исходных соединений промежуточными гидропероксидными радикалами, например:HO2. + CH4 ® H2O2 + CH3 либо в результате рекомбинации активных свободных радикалов: 2ОН. ® Н2О2,Н. + НО2. ® Н2О2.
Например, если кислородно-водородное пламя направить на кусок льда, то растаявшая вода будет содержать в заметных количествах Н2О2, образовавшийся в результате рекомбинации свободных радикалов (в пламени молекулы Н2О2 немедленно распадаются). Аналогичный результат получается и при горении других газов. Образование Н2О2 может происходить и при невысокой температуре в результате различных окислительно-восстановительных процессов.В промышленности пероксид водорода уже давно не получают способом Тенара – из пероксида бария: BaO2+2HCl®BaCl2+H2O2,
а используют более современные методы. Один из них – электролиз растворов серной кислоты при высокой плотности тока, низкой температуре, на платиновом аноде. При этом на аноде сульфат-ионы окисляются до надсульфат-ионов: 2SO42– – 2e ® S2O82–. Надсерная кислота затем гидролизуется:
H2S2O8 + 2H2O ® H2O2 + 2H2SO4.
На катоде, как обычно, идет выделение водорода, так что суммарная реакция описывается уравнением :
2H2O ® H2O2 + H2.
Но основной современный способ (свыше 80% мирового производства) – окисление некоторых органических соединений, например, этилантрагидрохинона кислородом воздуха в органическом растворителе, при этом из антрагидрохинона образуются Н2О2 и соответствующий антрахинон, который потом снова восстанавливают водородом на катализаторе в антрагидрохинон. Пероксид водорода извлекают из смеси водой и концентрируют перегонкой. Аналогичная реакция протекает и при использовании изопропилового спирта (она идет с промежуточным образованием гидропероксида):
(СН3)2СНОН + О2 ® (СН3)2С(ООН)ОН ® (СН3)2СО + Н2О2
При необходимости образовавшийся ацетон также можно восстановить до изопропилового спирта.
Физические и химические свойства.Чистый пероксид водорода очень сильно отличается от знакомого всем 3%-ного раствора Н2О2, который стоит в домашней аптечке. Прежде всего, он почти в полтора раза тяжелее воды (плотность при 20° С равна 1,45 г/см3). Замерзает Н2О2 при температурой немного меньшей, чем температура замерзания воды – при минус 0,41°С, но если быстро охладить чистую жидкость, она обычно не замерзает, а переохлаждается, превращаясь в прозрачную стеклообразную массу. Растворы Н2О2 замерзают при значительно более низкой температуре: 30%-ный раствор – при минус 30°С, а 60%-ный – при минус 53°С. Кипит Н2О2 при температуре более высокой, чем обычная вода, – при 150,2ºС. Смачивает стекло хуже, чем вода, и это приводит к интересному явлению при медленной перегонке водных растворов: пока из раствора отгоняется вода, она, как обычно, поступает из холодильника в приемник в виде капель; когда же начинает перегоняться Н2О2, жидкость выходит из холодильника в виде непрерывной тоненькой струйки. На коже чистый пероксид водорода и его концентрированные растворы оставляют белые пятна и вызывают ощущение жгучей боли из-за сильного химического ожога.
Чистый пероксид водорода – вещество очень опасное, так как при некоторых условиях возможно его взрывное разложение:
Н2О2 ® Н2О + 1/2 О2
с выделением 98 кДж на моль Н2О2 (34г).Опасны и концентрированные водные растворы Н2О2, в их присутствии легко самовоспламеняются многие органические соединения, а при ударе такие смеси могут взрываться. Для хранения концентрированных растворов используют сосуды из особо чистого алюминия или парафинированные стеклянные сосуды.
Чаще приходится встречаться с менее концентрированным 30%-ным раствором Н2О2, который называется пергидролем, но и такой раствор опасен: вызывает ожоги на коже (при его действии кожа сразу же белеет из-за обесцвечивания красящих веществ),
Пероксид водорода – кислота, но очень слабая. Константа диссоциации H2O2  H+ + HO2– при 25° С равна 2,4·10–12, что на 5 порядков меньше, чем для H2S. Средние соли Н2О2 щелочных и щелочноземельных металлов обычно называют пероксидами. При растворении в воде они почти полностью гидролизуются:
H+ + HO2– при 25° С равна 2,4·10–12, что на 5 порядков меньше, чем для H2S. Средние соли Н2О2 щелочных и щелочноземельных металлов обычно называют пероксидами. При растворении в воде они почти полностью гидролизуются:
Na2O2 + 2H2O ® 2NaOH + H2O2.
Гидролизу способствует подкисление растворов. Как кислота Н2О2 образует и кислые соли, например, Ва(НО2)2, NaHO2 и др. Кислые соли менее подвержены гидролизу, но легко разлагаются при нагревании с выделением кислорода:
2NaHO2 ® 2NaOH + O2.
Выделяющаяся щелочь, как и в случае Н2О2, способствует разложению.
Растворы Н2О2, особенно концентрированные, обладают сильным окислительным действием. Так, при действии 65%-ного раствора Н2О2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие органические соединения, например, индиго. Необычно идет окисление формальдегида: Н2О2восстанавливается не до воды (как обычно), а до свободного водорода:. Окислительное действие разбавленных растворов Н2О2 больше всего проявляется в кислой среде, например :
H2O2 + H2C2O4 ® 2H2O + 2CO2,
но возможно окисление и в щелочной среде:
Na[Sn(OH)3] + H2O2 + NaOH ® Na2[Sn(OH)6];
2K3[Cr(OH)6] + 3H2O2 ® 2K2CrO4 + 2KOH + 8H2O.
Окисление черного сульфида свинца до белого сульфата можно использовать для восстановления потемневших свинцовых белил на старых картинах:
PbS + 4H2O2 ® PbSO4 + 4H2O
Под действием света идет окисление и соляной кислоты:
H2O2 + 2HCl ® 2H2O + Cl2.
Добавление Н2О2 к кислотам сильно увеличивает их действие на металлы. Так, в смеси H2O2 и разбавленной H2SO4 растворяются медь, серебро и ртуть; иод в кислой среде окисляется до иодной кислоты HIO3, сернистый газ – до серной кислоты и т.д.
Совершенно иначе реагирует пероксид водорода в присутствии сильных окислителей, а также веществ, легко отдающих кислород. В таких случаях Н2О2 может выступать как восстановитель с одновременным выделением кислорода
Пероксид водорода находит широкое применение, а его мировое производство исчисляется сотнями тысяч тонн в год. Его используют для получения неорганических пероксидов, как окислитель ракетных топлив, в органических синтезах, для отбеливания масел, жиров, тканей, бумаги, для очистки полупроводниковых материалов, для извлечения из руд ценных металлов (например, урана путем перевода его нерастворимой формы в растворимую), для обезвреживания сточных вод. В медицине растворы Н2О2 применяют для полоскания и смазывания при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина), для лечения гнойных ран. В пеналах для хранения контактных линз в крышку иногда помещают очень небольшое количество платинового катализатора. Линзы для их дезинфекции заливают в пенале 3%-ным раствором Н2О2, но так как этот раствор вреден для глаз, пенал через некоторое время переворачивают. При этом катализатор в крышке быстро разлагает Н2О2 на чистую воду и кислород.
8.2 Сера.
Нахождение в природе и получение: Сера была известна людям со II века до нашей эры. Название элемента было взято со слова <<сира>> обозначающее светло-желтый.Сера распространена в природе как в виде соединений так и в свободном виде. В свободном виде сера встречается обычно в виде залежей. Такие рудники встречаются в северной части Украины, в Италии, в Америке, в Туркменистане. Кроме этого сера встречается в организмах животных и растений. В виде соединений сера распространена в виде сульфидов и сульфатов:
FeS2-пирит или медный колчедан. H2S-сероводород
ZnS- сфалерит или цинковая обманка Na2SO4∙10H2O-сульфат натрия - глауберова
PbS- или свинцовый блеск. Соль
Cu2S- или медный блеск (халькозин) CaSO4∙2H2O- гипс
CuFeS2-медный колчедан или халькопирит. MgSO4∙7H2O- горькая соль
HgS- киноварь. BaSO4- тяжелый шпат
Аналитические реакции сульфат-иона SO42-
Сульфаты аммония и многих металлов хорошо растворяются в Н2О. Сульфаты кальция, стронция, бария, свинца (II) малорастворимы в воде, что широко используется в химическом анализе.
1.Реакция с катионами бария (фармакопейная).
Ва2+ + SO42- —> BaSO4 (белый мелкокристаллический)
Выпадает белый осадок сульфата бария. Если в растворе присутствует перманганат калия КМО4, то осадок BaSO4 окрашивается в фиолетово - красный цвет за счет адсорбции МпО4' - ионов на осадке.
BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной H2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
BaSO4 + H2SO4->Ba(HSO4)2
2.Реакция с катионами свинца.
РЬ2т + SO42- -> PbSO4J. (белый кристаллический)
Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия CH3COONa или аммония CH3COONH4 с образованием комплексных соединений:
PbSO4 + 4 NaOH -- Na2[Pb(OH)4] + Na2SO4
3. Реакция с родизонатом бария.
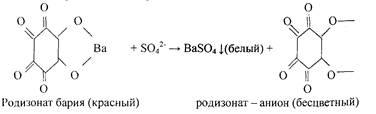
Методика. На листок фильтровальной бумаги наносят каплю раствора ВаС12 и 1 каплю раствора родизоната натрия Na2C6Oe или родизоновый кислоты Н2Сб06. На бумаге возникает красное пятно родизоната бария. На это пятно наносят 1-2 капли раствора, содержащего сульфат - ионы (Na2SO4, K2~SO4 или H2SO4 разбавленной). Пятно обесцвечивается.
Типичные свойства важнейших соединений серы, их биологическая роль. Сульфгидрильные группы белка и их свойства, как производных сероводорода. Аналитические реакции на ионы SO32– и S2O32–.
Сера имеет 4 стабильных изотопа: 33S, 34S, 35S,36S. Сера - кристаллическое вещество желтого цвета. Она не проводит тепла и электричества, не растворяется в воде, но растворяется в дисульфиде углерода ( CS 2 ) , толуоле (C6H5-CH3). Сера плавится при температуре 112,8 ºС,и кипит при температуре 444,6 ºС. Сера имеет три аллотропных модификации: ромбическая, моноклинная, и пластическая. Первые 2 относятся к кристаллическим разновидностям, а третья – аморфная. Кристаллическая сера, состоящая из восьми атомов S8 при температуре > 160ºС распадается и переходит в различные виды пластической серы: S8 450ºС → S6650ºС → S4 900ºС →S21500ºС→S
Сера типичный неметалл. В химических реакциях сера проявляет себя как окислитель, так и восстановитель. Окислительные свойства серы выражены слабее чем у кислорода, поэтому в реакциях с элементами с большей электроотрицательностью (F, Cl, O, N) она проявляет себя как восстановитель, а с элементами с низшей электроотрицательностью чем у нее, она проявляет себя как окислитель. Сера вступает в реакции с металлами при нагревании, а с ртутью и щелочами взаимодействует при обычных условиях:
2Na+S→Na2S 2Al+3S →Al2S3
2Hg+S→HgS C+2S→CS2
Fe+S→FeS Si+S→SiS
Сера взаимодействует со всеми неметаллами кроме инертных газов и йода.
S+3F2→SF6 Si+2S→SiS2 H2+S→H2S
2P+5S→P2S5 S+O2 →SO2 2S+Cl2→S2Cl2 C+2S→CS2
Сера взаимодействует со сложными веществами:
Na2S+S→Na2S2
С горячими растворами концентрированной серной, с концентрированной и разбавленной азотной кислот:
2H2SO4(конц)+S→3SO2+2H2O
6HNO3(конц)+S→2H2SO4+6NO2+2H2O
2HNO3(разб) +S → H2SO4 +2NO
При нагревании сера вступает в реакцию со щелочами и пероксидами:
Na2O2+2S→Na2S+SO2
6KOH+3S→K2SO3+2K2S+3H2O
Сера используется в сельском хозяйстве как защита от насекомых, в производстве спичек, при получении серной кислоты, при вулканизации каучука, широко используется в производстве пороха.
Для приготовления черного пороха используется смесь из 75% KNO3 , 15% C и 10% S; при нагревании происходит реакция:
2KNO3 + S + 3C → K2S + 3CO2 + N2 ,
в результате которой происходят резкое увеличение объема смеси ( в 2000 раз) – взрыв.
Сероводород
Н2S- бесцветный газ с резким запахом тухлых яиц; молекула Н2 S имеет угловую форму, длина связи S —H 0,1336 нм, угол HSH 92,06°.
При обычной температуре сероводород устойчив, в вакууме начинает диссоциировать выше 500 °С, при ~ 1690°С полностью разлагается. В воде Н2S хорошо растворим ( 3 объема на 1 объем воды при 20°С. Водный раствор сероводорода-сероводородная кислота-слабая кислота (K1 = 9,5·10-8, K2 = 1·10-14), образующая соли-сульфиды и гидросульфиды. Известен клатрат Н2S · 6Н2О. Лучше, чем в воде,сероводород растворяется в органических растворителях; например, в одном объеме этанола растворяется 7,42 (20 °С) объемов H2S. В промышленности сероводородполучают как побочный продукт при очистке нефти, природных и промышленных газов. Основные методы очистки этих газов с получением сероводорода-моноэтаноламиновый, вакуум-карбонатный, содовый. Принципиальная схема выделения сероводорода из природных. и промышленных газов заключается в следующем: газ вводится в нижнюю часть абсорбера, который сверху орошается раствором абсорбента, затем насыщенный H2S раствор поступает в отгонную колонну, где при нагревании горячим паром происходит десорбция сероводорода из раствора.
В лаборатории сероводород получают действием Н2 SO4 на FeS; а также из Н2 и паров S при 500-600 °С в присутствии катализатора (пемза); удобный метод получения H2S-нагревание серы с парафином:
FeS+2HCl→FeCl2+H2S↑
Cероводород-сильный восстановитель:
KMnO4+5H2S+3H2SO4→2MnSO4+5S+K2SO4+8H2O
H2S+4Br2+4H2O→H2SO4+8HBr
3FeCl3 + H2S → 2FeCl2 + 2HCl + S
При нагревании на воздухе постепенно окисляется, при ~ 250 °С воспламеняется. Горит, при избытке О2 образует SO2 и воду, при недостатке-S и воду. Сероводород легко окисляется в водном растворе кислородом, галогенами. На восстановление I2 до HI в растворе основано определение H2S методом иодометрии. Сильные окислители (HNO3, Cl2) окисляют сероводороддо Н2SO4.
2H2S + SO2 → 2H2O + 3S
3H2S + 8HNO3 → 3H2SO4 + 8NO + 4H2O
Сероводород взаимодействует с большинством металлов и их оксидами при нагревании в присутствии влаги и воздуха с образованием сульфидов металлов.
Ca + H2S → CaS + H2
CuO + H2S → CuS↓ + H2O
2NaOH + H2S → Na2S + 2H2O
CuCl + H2S → CuS↓ + 2HCl
С олефинами и гидроксидами, солями, спиртами, хлорароматическими соединениями, эпоксидами дает тиолы, с нитрилами –тиоамиды и другими соединениями S с водородом - сульфоны H2Sx.
На реакции H2S с солями тяжёлых металлов с образованием осадков основано определение сульфид-иона в растворе и атмосфере :
Pb(NO)3 + H2S → PbS↓(черный) + 2HNO3
В природе H2S встречается главным образом в месторождениях нефти и природного газа, а также в вулканических газах и водах минеральных источников; он растворен в глубоких (ниже 150-200 м) слоях воды Черного моря (концентрация сероводород у дна достигает 11-14 мл/л). сероводородпостоянно образуется в природе при разложении белковых веществ.
Сероводород применяют в основном для производства S и H2SO4. Его используют также для получения различных сульфидов (в частности, сульфидов и гидросульфидов Na, NH4), сераорганических соединений (тиофены, тиолы и т. п.), тяжелой воды, для приготовления лечебных сероводородных ванн, в аналитической химии для осаждения сульфидов металлов. Взрывоопасен, ПДК (предельно допустимая концентрация) в воздухе 4,5-45,5% по объемуОксиды серы
Оксид серы (IV) SО2 - сернистый ангидрид ,бесцветный газ с резким запахом, угнетающе действующий на растения. Молекула SО2 изоэлектронна молекуле озона, имеет угловую форму: валентный угол O- S- O равен 119о. Кратность связи S- O составляет 1.5 .
Диоксид серы получают непосредственным сжиганием серы на воздухе или длительным отжигом сульфидов:
4FeS2 + 11O2→2Fe2O3 + 8SО2
SО2 хорошо растворяется в воде (39.3 объема в 1 объеме Н2О при 20оС, то есть около 10% по массе) с образованием гидратов SО2 . nH2O. Раствор имеет кислую реакцию, но в индивидуальном виде H2SO3 не выделена из-за ее термодинамической неустойчивости.
Восстановительные свойства SО2 обусловлены присутствием в его молекуле неподеленной электронной пары. SО2 взаимодействует с окислителями различной силы (свободные галогены, хлорная, бромная и иодная вода; растворы KMnO4,HNO3, H2SeO3 и др.), образуя различные производные S(VI):
I2 + SO2 + 2H2O = 2HI +H2SO4 ,
5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4
H2SeO3 + 2SO2 + H2O 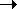 Se
Se 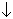 + 2H2SO4 .
+ 2H2SO4 .
SO2 + 2HNO3 → H2SO4 + 2NO2
Важнейший процесс для химической промышленности и экологии - окисление SO2кислородом до SO3 :
SO2+1/2O2 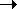 SO3
SO3
Дата добавления: 2016-01-16; просмотров: 9963;
