Аналитические реакции бромид - иона Вг
Бромид - ион Вг- - анион сильной кислоты НВг. В водных растворах бромид - ион бесцветен, не гидролизуется, обладает восстановительными свойствами, образует устойчивые бромидные комплексы с катионами многих металлов: Мало растворимы в воде бромиды меди (I) CuBr, серебра (I) AgBr, золота (I) AuBr и золота (III) AuBr3, таллия (I) TIBr, ртути (I) Hg2Br2, свинца (II) РЬВг2, а остальные бромиды, в том числе NUiBr хорошо растворимы в воде.
1.Реакция с AgNO3 (фармакопейная).
Br- + Ag+ —► AgBr (желтоватый)
Осадок AgBr практически нерастворим в воде, в азотной кислоте, в расгворе карбоната аммония. Частично растворяется в концентрированном растворе аммиака. Растворяется в растворе тиосульфата натрия с образованием тиосульфатного комплекса серебра (I) [Ag(S2O3)2]3-:
AgBr + 2 S2O32- -> [Ag(S2O3)2]3- + Br-
2.Реакция с сильными окислителями (фармакопейная).
Сильные окислители (КМпО4, МпО2, КВгО3, гипохлорит натрия NaCIO, хлорная вода, хлорамин и др.) в кислой среде окисляют бромид - ионы до брома:
10 Вг- + 2 МпО4- + 16 Н+= 5 Вг2 + 2 Мп2++ 8 Н2О
2 Вг- + С12 -> Вг2 + 2 СГ 5 Вг-+ ВгО3-+ 6 Н+ -> 3 Вг2 + 3 Н2О
Вг2, придающий водному раствору желто-бурую окраску, можно экстрагировать из водной фазы органическими растворителями (хлороформ, СС14, бензол), в которых он растворяется больше, чем в воде. Органический слой окрашивается в желто-бурый или желто-оранжевый цвет. Вг2 также обнаруживается реакцией с фуксинсернистой кислотой на фильтровальной бумаге (сине - фиолетовая окраска), а также реакцией с флюоресценном (красное окрашивание).
Проведению реакции мешают другие восстановители (S2-,SO3--. S2O32-, арсенит - ионы и др.).
Аналитические реакции иодид — иона l-
Иодид-ион - анион сильной одноосновной кислоты HI. В водных растворах бесцветен, не гидролизуется, обладает выраженными восстановительными свойствами, каклиганд образует устойчивые иодидные комплексы с катионами многих металлов. NM4I и иодиды большинства металлов хорошо растворяются в воде. Мало растворимы в воде Cul, Agl, Aul и Aul3, T1I, РЫ2 (растворяется при нагревании). Bil3.
1.Реакция с нитратом серебра (фармакопейная).
I-+Ag+=AgI
Выпадает светло-желтый осадок иодида серебра. Agl практически нерастворим в воде, в азотной кислоте и в аммиаке. Растворяется в растворах Na2S2O3 и при большом избытке в растворе иодид - ионов.
2.Реакция с окислителями (фармакопейная - с NaNO2 и FeCb, в качестве окислителей).
21- + С12 —> 12 + 2 С1- (с хлорной водой)
21- + 2 Fе3+ -> 12 + 2 Fe2+ (с FeCl3)
21- + 2 NO2- + 4 Н+ -> I, + 2 NO + 2 Н2О (с NaNO2)
Выделяющийся йод окрашивает раствор в желто-коричневый цвет.
Молекулярный йод можно экстрагировать из водной фазы хлороформом, бензолом и другими органическими растворителями, не смещивающимися с водой, в которых молекулярный иод растворяется лучше чем в воде.
При избытке хлорной воды образующийся йод окисляется до бесцветной йодноватой кислоты Н1О3и раствор обесцвечивается:
12 + 5 CI2 + 6 H20 -► 2 HIO3 + 10 HC1
3.Йодкрахмальная реакция.
Молекулярный йод, возникающий при окислении иодид - ионов окислителями, часто открывают реакцией с крахмалом (синее окрашивание).
4.Реакция с солями свинца.
21- + Pb2+= Рb12
Рb12 + 2 I -> [Рb14]2-
Выпадает желтый осадок Рb12 растворимый в избытке KI.
Осадок растворяется в воде (подкисленной уксусной кислотой) при нагревании. При охлаждении раствора иодид свинца выделяется в виде красивых золотистых чешуйчатых кристаллов (-реакция золотого дождя-).
5.Реакция окисления бромид - и иодид - ионов.
Используют для открытия Вг- и 1- при их совместном присутствии.
98.Элементы II A группы. Типичные свойства важнейших соединений, биологическая роль. Аналитические реакции на ионы Mg 2+.
Общая характеристика элементов II А группы. Физические и химические свойства щелочноземельных металлов Ca, Sr, Ba ), их бинарных соединений, гидроксидов и солей
Be, Mg, Ca, Sr, Ba, Ra – элементы II А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами.
Из всех этих элементов только бериллий – является моноизотопным, все остальные полиизотопны. Радий – единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа. Все 14 изотопов радиоактивны и среди них наиболее устойчив 226Ra.
Атомы элементов на внешнем электронном уровне имеют по 2 электрона с противоположными спинами. В возбужденном состоянии один из двух внешних электронов занимает р-орбиталь  ), за счет чего атомы могут быть двухвалентными. Радиусы атомов их меньше, чем у атомов щелочных металлов, поэтому потенциал ионизации больше. От Be(Mg) к Ra увеличивается радиус атома и иона, в соответствии с этим усиливаются металлические свойства. Причем они менее выражены, чем у щелочных металлов.
), за счет чего атомы могут быть двухвалентными. Радиусы атомов их меньше, чем у атомов щелочных металлов, поэтому потенциал ионизации больше. От Be(Mg) к Ra увеличивается радиус атома и иона, в соответствии с этим усиливаются металлические свойства. Причем они менее выражены, чем у щелочных металлов.
У щелочноземельных металлов – тип металлических структур:Be, Mg – ГПУ (гексагональная плотная упаковка)
Ca, Sr – ГКУ (гранецентрированная кубическая упаковка)
Ba - ОЦКУ (объемно-центрированная кубическая упаковка) Температура плавления и кипения бериллия, а также твердость значительно превосходит остальные элементы подгруппы, это связано с тем, что бериллий образует наиболее прочную кристаллическую решетку. Стандартный электродный потенциал уменьшается сверху вниз, соответственно. Восстановительная активность увеличивается от Ве к Ra, но они менее активные восстановители, чем щелочные металлы.
Незакономерное изменение физических свойств: плотности, температуры плавления, температуры кипения обусловлены существенными различиями в строении пространственных кристаллических решеток.
В свободном состоянии это легкие металлы, тверже щелочных, самый мягкий барий, имеют серебристо-белый цвет.
Для элементов II-A группы характерна степень окисления +2, соединения со степенью окисления +1 – неустойчивы.
Все окисляются на воздухе и бериллий, и магний покрываются плотной пленкой оксидов, защищающей их от воздействий. Но остальные металлы взаимодействуют с кислородом воздуха более энергично, поэтому хранят также как и щелочные.
При нагревании все металлы сгорают на воздухе с образованием оксидов. Взаимодействуют с водой, вытесняя водород, все кроме бериллия, магний реагирует медленно и только при высоких температурах, а остальные бурно, т.к. в ряду стандартных электродных потенциалов находятся левее водорода. Важнейшие соединения элементов II-А группы
BeO, MgO – для производства огнеупорных материалов, МgO – жженая магнезия, применяется для нейтрализации при отравлении кислотами, входит в состав зубных порошков.
^ СаО – негашеная известь.
BaO2 – для производства Н2О2 и как отбеливающее средство.
Са(ОН)2 – гашенная известь (известковое молоко) дешевое растворимое основание.
СаСО3 – карбонат кальция – главная составная часть известняка, мела, мрамора. Служит для производства (негашеной, гашеной и хлорной извести).
СаSO4 – используют для штукатурных работ, в медицине для изготовления отливочных форм и слепков, наложения повязок при переломах.
2CaSO4×H2O – алебастр (в строительстве)
СаSO4×2H2O – гипс (в строительстве)
CaCl2 – широко применяется в медицине для внутренних инъекций.
^ M
применяются в медицине (слабительное)
gSO4×7H2O
M  gCl2×6H2O
gCl2×6H2O
Раствор Ва(ОН)2 – баритовая вода – лабораторный реактив для открытия СО2.
Ba(NO3)2 – в пиротехнике.
Аналитические реакции катионов магния Mg 2+
1. Реакция с щелочами и аммиаком: Mg2+ + 2 ОН- —> Mg(OH)2 (белый аморфный)
Mg2+ + 2 NHrH2O = Mg(OH)2 + 2 NH4+
Осадок не растворяется в щелочах, растворяется в НС1, H2SO4, CH3COOH: Mg(OH)2 + 2 Н+ -► Mg2+ + 2 Н2О
2. Реакция с гидрофосфатом натрия Na2HPO4 (фармакопейная).
Реакцию проводят в аммиачном буфере:
Mg2+ + НРО42- + NH3 -- NH4MgPO4 | (белый кристаллический) При проведении реакции в отсутствии катионов аммония и аммиака выпадает белый аморфный осадок MgHPO4. Избыток NH4 мешает выпадению NH4MgPO4. Осадок NH4MgPO4 растворяется в минеральных кислотах и в уксусной кислоте:
NH4MgPO4 + 3 НС1 - Н3РО4 + MgCl2 + NH4C1
NH4MgPO4+ 2 CHjCOOH = NH4H2PO4 + (CH3COO)2Mg
Проведению реакции мешают катионы Li+, Ca2+, Sr2, Ba2+ и др.
3. Реакция с магнезоном I - п - нитробензолазорезорцином.
В щелочной среде магнезон I, имеющий красную окраску, образует с катионами М^2+,комплекс синего цвета, сорбирующийся на осадке Mg(OH)2:
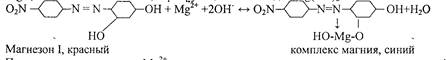
При малых концентрациях Mg2+ осадок не выделяется, а раствор окрашивается в синий цвет. Проведению реакции мешают Cd2+, Sn2+, Cr3+, Fe2+, Co2+, Ni2+.
4.Реакция с 8- оксихинолином.
Реакцию проводят в аммиачной среде при рН = 8—13 (при нагревании).
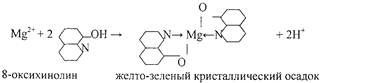
Осадок растворим в минеральных кислотах и в уксусной кислоте. Проведению реакции мешают катионы, также образующие комплексы с 8 -оксихинолином (Cu2+, Zn2+. Cd2+, Fe3+ и др.).
5. Реакция с хинализарином.
Реакцию проводят в щелочной среде. Образуется синий осадок комплексного соединения – хинализарината магния состава MgL(OH), где НL – условное обозначение молекулы хинализарина:
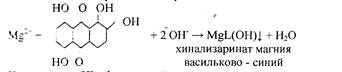
При небольшом содержании катионов Mg2+в растворе осадок не выпадает, а раствор окрашивается в цвет. Проведению реакций мешают катионы алюминия.
6. Реакция с растворимыми карбонатами (Nа2С03).
2 Mg2++ 2 Nа2С03 + Н2О = (МgОН)2С0з (белый аморфный) +4 Nа + СО2. Осадок (МgОН)2С0з,растворим в кислотах и в солях аммония.
7. Реакция с оксалатом аммония (NH4)С2О4.
Mg2++ (NH4)С2О4 = Mg С2О4 (белый) + 2 NH4
8. Катионы Mg2+ с дифенилкарбазидом (С6Н5 NHNH)2С0 образуют комплекс красно— фиолетового цвета.
99.Общая характеристика S-элементов. Элементы I A группы. Типичные свойства важнейших соединений, их биологическая роль. Аналитические реакции на ионы К+, Na+.
Дата добавления: 2016-01-16; просмотров: 3960;
