Ионы d-элементов IIB группы
Реакции обнаружения ионов цинка Zn
Действие группового реагента (NH4)2S. Сульфид аммония образует с солями цинка белый осадок сульфида цинка ZnS:
ZnCl2 + (NH4)2S = ZnS + 2NH4Cl,
Zn2+ + S2- = ZnS.
Действие гидроксидов щелочных металлов. Растворы гидроксидов щелочных металлов (NaOH, КОН) осаждают из водных растворов солей Zn2+ осадок гидроксида цинка Zn(OH)2 белого цвета, проявляющий амфотерные свойства. В избытке щелочи осадок растворяется с образованием бесцветного раствора комплексной соли тетрагидроксоцинката натрия Na2[Zn(OH)4]:
ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl,
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4].
91.Общая характеристика р-элементов. Элементы III A группы. Типичные свойства важнейших соединений, их биологическая роль. Аналитические реакции на ионы Al3+.
Главную подгруппу III группы составляют элементы бор, алюминий, галлий, индий и таллий, элементы относятся к р-элементам. На внешнем энергетическом уровне они имеют по три (s2p1) электрона, чем объясняется сходство свойств.Степень окисления +3. Внутри группы с увеличением заряда ядра металлические свойства увеличиваются. Бор — элемент-неметалл, а у алюминия уже металлические свойства. Все элементы образуют оксиды и гидроксиды.В реакциях с водой они образуют растворимые в воде основания (щелочи).
На внешнем электронном уровне элементов главной подгруппы имеется по 3 электрона (s2р1). Они легко отдают эти электроны или образуют 3 неспаренных электрона за счет перехода 1 электрона на р-уровень. Для бора и алюминия характерны соединения только со степенью окисления +3 У элементов подгруппы галлия (галлий, индий, таллий) на внешнем электронном уровне также находится по 3 электрона, образуя конфигурацию s2р1, но они расположены после 18-электронного слоя. Поэтому в отличие от алюминия галлий обладает явно неметаллическими свойствами. Эти свойства в ряду Ga, In, Тl ослабевают, а металлические свойства усиливаются. У элементов подгруппы скандия на внешнем электронном уровне также находится по 3 электрона. Однако эти элементы относятся к переходным d-элементам, электронная конфигурация их валентного слоя d1s2. Эти электроны все 3 элемента довольно легко отдают.Элементы подгруппы лантаноидов имеют отличительную конфигурацию внешнего электронного уровня: у них застраивается 4f -уровень и исчезает d-уровень. Начиная с церия, все элементы, кроме гадолиния и лютеция, имеют электронную конфигурацию внешнего электронного уровня 4fn6s2 (гадолиний и лютеций имеют 5d1-электроны). Число n изменяется от 2 до 14. Поэтому в образовании валентных связей принимают участие s- и f-электроны. Чаще всего степень окисления лантаноидов +3, реже +4.Электронное строение валентного слоя актиноидов во многом напоминает электронное строение валентного слоя лантаноидов. Все лантаноиды и актиноиды - типичные металлы.Все элементы III группы обладают очень сильным сродством к кислороду и образование их оксидов сопровождается выделением большого количества теплоты.Бор относится к примесным микроэлементам, его мас–совая доля в организме человека составляет 10-5 %. Бор концентрируется главным образом в легких (0,34 мг), щитовидной железе (0,30 мг), селезенке (0,26 мг), пече–ни, мозге (0,22 мг), почках, сердечной мышце (0,21 мг). Биологическое действие бора еще недостаточно изуче–но. Известно, что бор входит в состав зубов и костей, очевидно, в виде труднорастворимых солей борной кис–лоты с катионами металлов.Избыток бора вреден для организма человека. Имеют–ся данные, что избыток бора угнетает амилазы, проте-иназы, уменьшает активность адреналина.По содержанию в организме человека (10-5 %) алю–миний относится к примесным микроэлементам. Алю–миний концентрируется главным образом в сыворотке крови, легких, печени, костях, почках, ногтях, волосах, входит в структуру нервных оболочек мозга человека.Суточное потребление алюминия человеком состав–ляет 47 мг. Алюминий влияет на развитие эпителиаль–ной и соединительной тканей, на регенерацию костных тканей, влияет на обмен фосфора.Алюминий оказывает воздействие на ферментатив–ные процессы.Избыток алюминия в организме тормозит синтез ге–моглобина, так как благодаря довольно высокой комп-лексообразующей способности алюминий блокирует активные центры ферментов, участвующих в кроветво–рении. Имеются данные, что алюминий может катали–зировать реакцию трансаминирования.Галлий – примесный микроэлемент (содержание в ор–ганизме человека 10−6—10−5%). Биологическая роль гал–лия в живых организмах почти не выяснена.Таллий относится к весьма токсичным элемен–там. Ион Т1 склонен подобно Ag+ образовывать прочные соединения с серосодержащими лигандами.Вследствие этого он очень токсичен, так как подав–ляет активность ферментов, содержащих тиогруппы – SH. Даже весьма незначительные количества соедине–ний Т1 + при попадании в организм вызывают выпадение волос.Вследствие близости радиусов К+ и Т1+ они обла–дают сходными свойствами и способны замещать друг друга в ферментах. Ионы Т1 и К являются синергистами. Этим объясняется тот факт, что ферменты пиру-ваткиназа и диолдегидратаза активируются не только ионами К, но и ионами Т1 (ион Т1 замещает ион К в ка–талитическом центре ферментов). Синергизм тал–лия и калия проявляется и в том, что подобно ионам К ионы Т1 накапливаются в эритроцитах.В качестве противоядия при отравлении ионами Т1 используют серосодержащий лиганд – аминокислоту цистин.В заключение необходимо отметить, что биологи–ческая роль р-элементов IIIA-группы изучена недоста–точно. В настоящее время известно, что бор и галлий взаимодействуют в растениях с ингибиторами их раз–вития полифенолами, уменьшая токсичность послед–них. Установлена также несомненная роль алюминия в построении эпителиальной и соединительной тканей и, кроме того, его участие в ферментативных процес–сах как в качестве активатора, так и в качестве ингиби–тора. Свойством ингибировать многие серосодержа–щие ферменты обладает ион Т1.Биологическая активность р-элементов IIIA-группы связана главным образом с их способностью к обра–зованию комплексных соединений с кислородсодер–жащими лигандами и нерастворимых фосфатов.
Качественная реакция на ион алюминия
Характерной реакцией на ион алюминия является реакция образования окрашенного соединения с ализарином. Реакцию проводят обычно капельным методом на фильтровальной бумаге.
На полоску фильтровальной бумаги нанести каплю раствора Al2(SO4)3 и обработать парами аммиака над фарфоровой чашкой. Периферию образовавшегося пятна обработать спиртовым раствором ализарина. Наблюдать образование красного пятна «алюминиевого лака».
Аналитические реакции катиона алюминия Al3+
1. Реакция с щелочами: А13+ + 3 ОН- -► А1(ОН)3 (белый) А1(ОН)3 + 3 ОН- -> [А1(ОН)6]3-После растворения гидроксида алюминия и образования гидроксокомплексов алюминия к раствору прибавляют несколько кристаллов соли аммония (NH4C1). Смесь нагревают. Гидроксокомплексы разрушаются выпадает осадок А1(ОН)3: [А1(ОН)6]3- + 3 NH4+ -> А1(ОН)3 + 3 NH3 + 3 Н2ОНаиболее полное осаждение гидроксида алюминия происходит при рН- 5-6. Осадок А1(ОН)3 растворяется в кислотах, но не растворяется в аммиаке.2. Реакция с аммиаком.А13+ + 3 NHrH2O -> А1(ОН)31 (белый аморфный) + 3 NH4+3. Реакция с нитратом кобальта - образование -тенаровой сини- (фармакопейная).-Тенаровая синь- - смешанный оксид алюминия и кобальта синего цвета.2 A12(SO4)3 + 2 Co(NO3)2 —tT-> 2 Со(А1О2)2 + 4 NO2 + 6 SO3 + O2.4. Реакция с алюминоном Катионы А13+ при взаимодействии с алюминоном – аммонийной солью ауринтрикарбоновой кислоты (для кратности NH4L) образуют в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состав A1(ОН)2 L. Точное строение комплекса неизвестно. Выпадает красный хлопьевидный осадок. Мешают катионы Са2+, Cr3+, Fe3+5. Реакция с ализарином (1,2 - диоксиантрахинон).Катионы А13+ с ализарином и его производными в аммиачной среде образует комплексы ярко красного цвета называемые -алюминиевыми лаками-.Комплекс устойчив в уксусной среде. Реакция высокочувствительна: предел обнаружения 0,5 мкг. Мешают катионы: Zn2+, Sn(II), Cr3+, Mn2+, Fe3+ и др.Другие реакции катиона алюминия А13+.Катионы А13+ образуют также осадки при реакциях в растворах: с Na2HPO4 - белый А13РО4, с CH3COONa- белый СН3СООА1(ОН)2, с оксихинолином (кратко Нох) - желто-зеленый [А1(О)3] и др.
1.4.1. Ализарин (1,2-диоксиантрахинон) С14Н6О2(ОН)2 образует с гидроксидом алюминия малорастворимое внутрикомплексное соединение ярко-красного цвета – «алюминиевый лак»:
Выполнению реакции мешает присутствие гидроксидов Zn(OH)2, Сr(ОН)3, Sn(OH)2, которые с ализарином также дают окрашенные «лаки». В ходе анализа смеси катионов III группы ион цинка (II) образует комплекс Zn(NH3)42+, а ион хрома (III) окисляется до СrО42–, поэтому обнаружению А13+ не мешают. Другие мешающие ионы можно предварительно связать действием K4[Fe(CN)6] в труднорастворимый комплекс (капельный метод). Предел обнаружения реакции 0,5 мкг.
Выполнение реакций:
а. В пробирку поместить 2–3 капли раствора соли алюминия и несколько капель 2 М раствора NH4OH до образования осадка А1(ОН)3. Нагреть и добавить 3–4 капли раствора ализарина. Осадок А1(ОН)3 окрашивается в ярко-красный цвет.
б. Эту реакцию можно выполнять капельным методом. На полоску фильтровальной бумаги нанести каплю раствора соли алюминия. Когда раствор впитается в бумагу, подержать полоску над открытой склянкой с концентрированным раствором аммиака. На влажное пятно нанести каплю ализарина и вновь обработать его парами аммиака. Подсушить пятно до перехода фиолетовой окраски ализарина в желтую, на фоне которой наблюдается ало-красное пятно «алюминиевого лака».
1.4.2. Алюминон (аммонийная соль ауринтрикарбоновой ки-слоты) с гидроксидом алюминия образует красные хлопья «алюминиевого лака». Реакция протекает медленно. Ее проведению мешает присутствие катионов Cr3+, Fe3+, Ca2+, которые дают аналогичный «лак», разрушаемый при действии NH4OH или (NH4)2CO3.
Выполнение реакций. К 2 каплям раствора соли алюминия, подкисленного уксусной кислотой, прибавить 1–2 капли 0,01 % раствора алюминона, нагреть на водяной бане и прибавить раствор NH4OH до появления запаха аммиака и 2–3 капли раствора (NH4)2CO3.
92.Элементы IV А группы. Типичные свойства важнейших соединений в природе и их биологическая роль. Аналитические реакции на ионы Pb2+.
Главную подгруппу IV группы периодической системы элементов составляют углерод, кремний, германий, олово и свинец. Элемент Номер Атомная масса Электронная конфигурация Углерод б 12,011 l.v!2r2/>; Кремний 14 28,085 1 л-22.уг2/>л3л-33/ї- Германий 32 72,59 Іл^г/^ЗpV4.r4p2 Олово 50 118,69 Ь^-2/>ЧгЗ/)лЗМ<Г5л-5/>г Свинец 82 207.2
Электронная конфигурация./^-элементы. Внешний электронный алой содержит по четыре электрона, электронная формула внешнего слоя пЛір1. Углерод и кремний являются неметаллами, германий, олово и свинец — переходными элементами.
Свойства. Элементы этой подгруппы образуют оксиды с общей формулой RO и RO, н водородные соединения с формулой RH4. От углерода к свинцу свойства оксидов изменяются от кислотных (СО,, SiO,) до амфотерных (SnO,, PbO,). PbO и SnO являются основными оксидами. От углерода к свинцу уменьшается прочность водородных соединений. Изменяется и характер гидратов: так, Н,СО,. H,SiO}—слабые кислоты: Pb(OH),, Sn(OH),, Ge(OH),—амфотерные основания. В подгруппе с ростом порядкового номера уменьшается энергия ионизации и увеличивается атомный радиус, т. е. неметаллические свойства ослабевают, а металлические усиливаются.
Частные аналитические реакции ионов Pb2+
1.2.3. Хромат калия К2СrO4 и дихромат калия К2Сr2О7 с ионами Рb2+ образуют желтый осадок РbСrО4 (KS0 = 1,8 •10–14):
Рb2+ + СrО42– → РbСrО4 ↓ , 2Pb2+ + Cr2O72– + H2O → 2PbCrO4 ↓ + 2Н+.
Осадок РbСrО4 мало растворим в HNO3, не растворяется в СН3СООН, но легко растворяется в растворах щелочи:
РbCrO4 + 4ОН– → РbО22– + CrO42– + 2Н2О.
Выполнение реакций.В две пробирки поместить по 2–3 капли раствора Pb(NO3)2 и прибавить в одну пробирку 1–2 капли рас-твора К2СrO4, в другую–1–2 капли раствора К2Сr2O7. Исследовать растворимость полученного осадка в 2 М растворах HNO3, CH3COOH, NaOH, прибавляя к осадку по 3–4 капли реактива. Условия проведения реакции – среда должна быть нейтральной или слабокислой.
1.2.4. Иодид калия KI дает с ионами Рb2+ желтый осадок Рb2:
Рb2+ + 2I– → РbI2 ↓.
Выполнение реакции. К 1–2 каплям раствора Pb(NO3)2 прибавить 1–2 капли раствора KI. К полученному осадку прибавить несколько капель воды, 2 М раствор СН3СООН и нагревать на водяной бане в течение 1–2 мин до растворения осадка. При резком охлаждении раствора под струей холодной воды наблюдать образова-ние блестящих золотистых кристаллов. Условия проведения реакции – слабокислая среда, рН = 3÷5; реактив нельзя брать в избытке во избежание растворения осадка вследствие образования комплексного иона РbI42–. Реакция является специфической на ион Рb2+.
1.2.5. Важное значение в анализе имеют также реакции катионов I аналитическое группы с едкими щелочами, гидрофосфатом натрия.
93.Элементы V A группы. Типичные свойства важнейших соединений азота и фосфора, их биологическая роль. Аналитические реакции ионов NO3–, PO43–
Главная подгруппа V группы периодической системы Д.И. Менделеева включает пять элементов: типичные p-элементы азот N, фосфор P, а также сходные с ними элементы больших периодов мышьяк As, сурьму Sb, и висмутBi. Они имеют общее название пниктогены. Атомы этих элементов имеют на внешнем уровне по 5 электронов (конфигурация ns2 np3).В соединениях элементы проявляют степень окисления от -3 до +5. Наиболее характерны степени +3 и +5. Для висмута более характерна степень окисления +3.
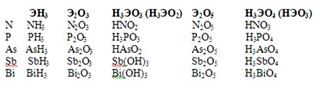 При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi.Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств.У атома азота три неспаренных электрона. Поэтому валентность азота равна трем. Из-за отсутствия у него d-подуровня на внешнем уровне его электроны разъединиться не могут. Однако в результате донорно-акцепторного взаимодействия азот становится четырехвалентным.У атомов фосфора и последующих элементов VА группы имеются свободные орбитали на d-подуровне и переходя в возбужденное состояние будут разъединятся 3s-электроны. В невозбужденном состоянии у всех элементов 5А группы валентность равна 3, а в возбужденном состоянии всех, кроме азота, равна пяти.Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3 , в которых степень их окисления -3. NH3 аммиакPH3 фосфинAsH3 арсинSbH3 стибинBiH3 висмутин AsH3, SbH3 газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты.
При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi.Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств.У атома азота три неспаренных электрона. Поэтому валентность азота равна трем. Из-за отсутствия у него d-подуровня на внешнем уровне его электроны разъединиться не могут. Однако в результате донорно-акцепторного взаимодействия азот становится четырехвалентным.У атомов фосфора и последующих элементов VА группы имеются свободные орбитали на d-подуровне и переходя в возбужденное состояние будут разъединятся 3s-электроны. В невозбужденном состоянии у всех элементов 5А группы валентность равна 3, а в возбужденном состоянии всех, кроме азота, равна пяти.Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3 , в которых степень их окисления -3. NH3 аммиакPH3 фосфинAsH3 арсинSbH3 стибинBiH3 висмутин AsH3, SbH3 газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты.
В кислородных соединениях для элементов VА группы наиболее характерны степени окисления +3 и +5. Для висмута более характерна степень окисления +3.Все элементы VА группы имеют оксиды типа Э2О5 и гидроксиды НЭО3или Н3ЭО4 , которые обладают кислотными свойствами. Кроме того для них характерны оксиды типа Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3 , у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы – амфотерные, а у висмута проявляют основной характер.
Характерно также образование галидов типа ЭГ3 (тригалиды), которые (за исключением NF3) гидролизуются по схеме:ЭГ3 + 3Н2О = Н3ЭО3 + 3НГ;ЭCl3 + H2O = H3ЭО3 + 3НCl но в присутствии галоводородной кислоты галиды сурьмы и висмута гидролизуются с образованием галоксидов, напримерSbCl3 + H2O = SbOCl + 2HCl Группу SbO+ называют антимонилом, а соединение SbOCl – хлоридом антимонила. Для фосфора, мышьяка и сурьмы известны пентафториды ЭF5 , а для фосфора и сурьмы пентахлориды ЭCl5 Мышьяк и сурьма имеют ряд аллотропных форм. Наиболее устойчивые металлические формы серого (As) и серебристо-белого (Sb) цвета. Это хрупкие вещества, легко превращаемые в порошок. Висмут – металл серебристо-белого цвета с едва заметным розовым оттенко Соединения As, Sb, Bi ядовиты. Особо опасны соединения As3+ (AsH3- арсин).
Дата добавления: 2016-01-16; просмотров: 1786;
