Лигазы. Лигазы обеспечивают соединение молекул субстрата, причем энергия, необходимая для этого, доставляется аденозинтрифосфатом (АТФ).
Уже простое перечисление этих функций наводит на мысль, что ферменты действуют в клетках не в одиночку, а совместно, последовательно перекраивая молекулы пищевых веществ: разрывая одни связи, создавая другие, изменяя общий каркас молекулы, перенося на нее или отнимая от нее целые группы атомов и т. д. Ферменты, в отличие от большинства технических катализаторов, функционируют в составе сложных систем; работа их согласована так, что продукт деятельности одного фермента обязательно попадает в сферу влияния вполне определенного другого, и скорости превращений на всех стадиях химического конвейера клетки также строго согласованы и регулируются автоматически.
Клетка и организм располагают и средствами управления своими "химическими заводами", так как клетка не только пользуется ферментами, но и сама создает их. Если при данных условиях работу какой-либо цепочки ферментов необходимо прекратить, так как вырабатываемый ею продукт имеется в избытке, выключается синтез соответствующих ферментов или подавляется деятельность одного из них, и таким образом весь конвейер временно останавливается. Это значит, что ферментная система пространственно организована. Она организована также во времени, потому что ферменты активируются и даже появляются в большей концентрации в те моменты, когда клетка нуждается в их деятельности.
Молекулярная масса ферментов велика и измеряется десятками, сотнями тысяч и даже миллионами. Ниже (табл. 5) приведены молекулярные массы некоторых ферментов.Изучение химического состава ферментов показало, что все они без исключений содержат белок. Белковая природа ферментов объяснила многие детали их синтеза в клетках, причины, по которым они легко фиксируются на мембранах. И вместе с тем появилась важная проблема в теории катализа - вопрос о механизме действия биологических катализаторов, которые, обладая очень сложной геометрической структурой, не являются вполне "жесткими", подобно кристаллическим оксидам или металлам, а могут изменяться уже в процессе каталитической реакции.На белковых молекулах ферментов имеются зоны или области, в которых и развивается каталитическая реакция. Можно, по аналогии с обычными катализаторами, называть эти зоны активными центрами. Активный центр ферментов, катализирующих некоторые окислительно-восстановительные реакции, в частности каталазы (разлагающей пероксид водорода), состоит из комплексного соединения железа с порфирином (замещенным порфином). Направленность действия фермента в значительной мере зависит от природы того белка, который входит в его состав.В состав различных ферментов входят разные металлы. Так, марганец входит в состав аргиназы, разлагающей некоторые составные части белков, цинк - в карбон-ангидразу. Медь содержится в аскорбиноксидазе - ферменте, окисляющем витамин С. Во многих растениях содержится фермент пероксидаза. Он усиливает окисление органических веществ пероксидом водорода. Активная группа этого фермента состоит из комплексного иона железа такого же типа, что и в каталазе. Если добавить к ферменту раствор сероводорода, то железо прочно соединится с серой и фермент потеряет активность.
В других ферментах, например в тех, которые катализируют гидролитическое разложение белков (пепсин в желудочном соке), активный центр не содержит инородных соединений, а представляет собой просто совокупность отдельных частей длинной цепеобразной молекулы белка, сближенных друг с другом в результате изгиба сложной цепи. Следовательно, активный центр фермента может возникнуть как результат определенной деформации белковой частицы; другими словами, геометрические особенности полипептидной цепочки, из которой белки и состоят, имеют большое значение для проявления каталитических свойств.
Модели ферментов. Большой интерес вызывает вопрос о возможности создания катализаторов, менее сложных по составу, чем ферменты, но вместе с тем столь же активных и избирательно действующих. Речь, следовательно, идет о получении моделей ферментов на основе сравнительно простых систем. Еще в начале XX в. Г. Бредиг обнаружил, что мелкораздробленные металлы (например, платина) проявляют способность сильно ускорять некоторые реакции, в частности разложение пероксида водорода. Такие "металлические модели", конечно, мало походили на белковые катализаторы, но все же стало ясно, что высокая каталитическая активность не является свойством, присущим только ферментам.
В 50-х г. Л. А. Николаев исследовал "медные модели" фермента каталазы, состоящие из комплексных соединений меди, и доказал, что ион меди, окруженный молекулами аммиака или аминогруппамипроявляет очень большую каталитическую активность в реакции разложения пероксида водорода. Позже были изучены реакции гидролиза (Р. Густавсон и С. Чибрик), ряд окислительных реакций (А. П. Пурмаль и др.), исследован механизм процессов катализа (А. П. Пурмаль, А. Я. Сычев и др.) и установлено, что многие комплексные соединения металлов вполне могут рассматриваться как модели активных групп металлосодержащих ферментов.
В настоящее время ведутся работы по изучению сочетаний комплекс металла - высокомолекулярный носитель; такая система уже совсем близка к природным ферментам. С другой стороны, фиксируя природный фермент на носителе, например на силикагеле, в приборе, называемом хроматографической колонкой, можно повысить его устойчивость и сделать более удобным использование фермента в производственных условиях. Такие "иммобилизованные" ферменты (т. е. зафиксированные на носителе) находят все большее применение в технологии производства пищевых продуктов.
Медь в организме. М. — необходимый для растений и животныхмикроэлемент. Основная биохимическая функция М. — участие в ферментативных реакциях в качестве активатора или в составе медьсодержащих ферментов. Количество М. в растениях колеблется от 0,0001 до 0,05 % (на сухое вещество) и зависит от вида растения и содержания М. в почве. В растениях М. входит в состав ферментов-оксидаз и белка пластоцианина. В оптимальных концентрациях М. повышает холодостойкость растений, способствует их росту и развитию. Среди животных наиболее богаты М. некоторые беспозвоночные (у моллюсков и ракообразных в гемоцианинесодержится 0,15—0,26 % М.). Поступая с пищей, М. всасывается в кишечнике, связывается с белком сыворотки крови — альбумином, затем поглощается печенью, откуда в составе белка церулоплазмина возвращается в кровь и доставляется к органам и тканям. В медицине сульфат М. применяют как антисептическое и вяжущее средство в виде глазных капель при конъюнктивитах и глазных карандашей для лечения трахомы. Раствор сульфата М. используют также при ожогах кожи фосфором. Иногда сульфат М. применяют как рвотное средство. Нитрат М. употребляют в виде глазной мази при трахоме и конъюнктивитах. Медь входит в состав ряда ферментов (например, тирозиназы, цитохромоксидазы), стимулирует кроветворную функцию костного мозга. Малые дозы Меди влияют на обмен углеводов (снижение содержания сахара в крови), минеральных веществ (уменьшение в крови количества фосфора) и других. Увеличение содержания Меди в крови приводит к превращению минеральных соединений железа в органические, стимулирует использование накопленного в печени железа при синтезе гемоглобина.
Цинк обычной чистоты активно реагирует с растворами кислот:
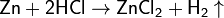
и растворами щелочей:
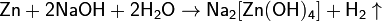 образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe. С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe. С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+.
Окись цинка широко используется в медицине как антисептическое и противовоспалительное средство. Также окись цинка используется для производства краски — цинковых белил.Цинк:
· необходим для продукции спермы и мужских гормонов необходим для метаболизма витамина E.важен для нормальной деятельности простаты.участвует в синтезе разных анаболических гормонов в организме, включая инсулин, тестостерон и гормон роста[12].необходим для расщепления алкоголя в организме, так как входит в состав алкогольдегидрогеназы.[12]Недостаток цинка в организме приводит к ряду расстройств. Среди них раздражительность, утомляемость, потеря памяти, депрессивные состояния, снижение остроты зрения, уменьшение массы тела, накопление в организме некоторых элементов (железа, меди, кадмия, свинца), снижение уровня инсулина, аллергические заболевания, анемия и другие[15].Для оценки содержания цинка в организме определяют его содержание в волосах, сыворотке и цельной крови.При длительном поступлении в организм в больших количествах все соли цинка, особенно сульфаты и хлориды, могут вызывать отравление из-за токсичности ионов Zn2+. 1 грамма сульфата цинка ZnSO4 достаточно, чтобы вызвать тяжелое отравление. В быту хлориды, сульфаты и оксид цинка могут образовываться при хранении пищевых продуктов в цинковой и оцинкованной посуде.Отравление ZnSO4 приводит к малокровию, задержке роста, бесплодию.Отравление оксидом цинка происходит при вдыхании его паров. Оно проявляется в появлении сладковатого вкуса во рту, снижении или полной потере аппетита, сильной жажде. Появляется усталость, чувство разбитости, стеснение и давящая боль в груди, сонливость, сухой кашель.
Дата добавления: 2016-01-16; просмотров: 1241;
