Аминокислота … Количество в молекуле белка
Глютаминовая кислота … 80
Лейцин … 58
Лизин … 58
Аспарагиновая кислота … 46
Валин … 45
Фенилаланин … 33
Пролин … 31
Треонин … 27
Аргинин … 25
Серии … 22
Тирозин … 18
Цистин … 16
Гистидин … 16
Глицин … 15
Изолейцин … 9
Метионин … 6
Цистеин … 4
Триптофан … 1
Алании … 0
Всего … 510
Разумеется, просто знать количество каждой из аминокислот в молекуле белка недостаточно. Надо было еще установить, в каком порядке они располагаются.
Эта задача казалась вообще неразрешимой. Количество возможных перестановок даже в самых маленьких белковых молекулах так велико, что попытки угадать фактическое их расположение сродни поиску иголки не то что в стоге сена, а в целом поле стогов сена.
Однако в конечном итоге человеческому гению эту задачу удалось решить. Это сделал английский биохимик Фредерик Сенгер со своими коллегами. Сенгер работал с инсулином, молекула которого сравнительно мала – этот белок состоит всего из 50 аминокислот, и его молекулярный вес – всего 6000. (Впрочем, даже и в этом случае количество возможных комбинаций аминокислот, присутствующих в известном соотношении, тоже значительно превышает 10100 – то есть единицу со 100 нулями.)
Методика Сенгера в упрощенном виде выглядит так: молекулу белка расщепляют не полностью, а частично, так чтобы на выходе получались не отдельные аминокислоты, а пептидные цепочки из двух, трех или четырех аминокислот. Порядок аминокислот в этих цепочках уже можно установить, а от них – перейти к порядку аминокислот в более крупных фрагментах, и в итоге – получить порядок аминокислот в самой изначальной цепочке.
Конечно, все это сделать не так просто. В реальности работа оказалась кропотливой, долгой и крайне сложной. Тем не менее к 1953 году (не прошло и десяти лет с момента начала работы) строение инсулина уже было точно установлено. В частности, ученым удалось четко выяснить, чем именно свиной инсулин отличается от бычьего – какая именно аминокислота заменяется на другую.
Затем по этой же методике было установлено строение и других, более сложных белковых молекул. К 1959 году была столь же точно выявлена и структура фермента «рибонуклеаза», в состав которого входит уже 121 аминокислота.
После того как порядок аминокислот в белках был установлен, можно было вплотную приступать к решению загадки столь масштабного уменьшения энтропии, какое имеет место в организме при синтезе строго определенной белковой молекулы. Эта задача оказалась совсем непростой. Процесс построения белка выполняется в несколько шагов, на каждом из которых к строящейся цепочке должна добавляться строго определенная аминокислота, и только она одна. Естественно, в качестве первых целей выбирались самые простые белки. Так, первой искусственно синтезированной молекулой стал окситоцин – гормон гипофиза. Автором этого открытия стали американский биохимик Винсент дю Виньо и его коллеги в 1953 году. Молекула окситоцина миниатюрна по белковым меркам – она состоит всего из восьми аминокислот, так что и белком‑то его в принципе можно назвать с натяжкой, однако сам факт был принят научным сообществом с восторгом. Главное – что синтезированный продукт проявил все свойства натурального, и, таким образом, с помощью синтеза на практике было доказано, что молекулярное строение гормона установлено верно.
В 1960 году другой американский биохимик, Клаус Хофман, продвинулся еще дальше, синтезировав цепочку из 23 аминокислот – часть молекулы еще одного продукта гипофиза, адренокортикотрофного гормона.
Вообще, химики с каждым годом добиваются все большего успеха в изучении строения белковых молекул, а если учесть, что реальная работа в этом направлении началась относительно недавно, то в ближайшем будущем можно ожидать в этой области больших достижений.
Но во всем, о чем я до сих пор рассказывал, причина хрупкости белковой молекулы до сих пор не затрагивалась.
Глава 17.
СЛАБОЕ ПРИТЯЖЕНИЕ
Можем ли мы быть уверены, что одного лишь большого размера достаточно, чтобы молекула оказывалась столь непрочной? Очевидно, это не так, если взять для примера хоть молекулу целлюлозы – она очень велика, но при этом очень прочна. Да и полипептидная цепочка не обладает повышенной хрупкостью по сравнению с другими длинными молекулярными цепочками, поскольку нам известны белки, состоящие из цепочек аминокислот, связанных пептидными связями, еще менее хрупкие, чем молекулы целлюлозы.
Лучшим примером такого вещества является белок фиброин, имеющий довольно простую для белка структуру. Пять шестых всех составляющих его аминокислот – это глицин, аланин и серии, имеющие самое простое строение. Другие аминокислоты представлены слабо, а пять – отсутствуют вообще. И все же фиброин – это белок, который состоит из аминокислот, скрепленных вместе пептидными связями. Нам это вещество знакомо в первую очередь по волокнам. Оно является главной составляющей шелка. А поскольку шелковая лента прочнее, чем хлопчатобумажная (состоящая по большей части из целлюлозы), то приходится признать, что полипептидная цепочка сама по себе еще не является залогом хрупкости.
И тем не менее факт остается фактом: большинство белковых молекул, в том числе – все ферменты, хоть и состоят из тех же компонентов, что и фиброин, и скреплены воедино теми же связями, все же претерпевают необратимые изменения под воздействием достаточно слабого нагревания. Парадокс: одни и те же составляющие, скрепленные одним и тем же образом, могут оказаться и прочными, как шелк, и хрупкими, как яичный белок.
Более того, получается, что те перемены, благодаря которым сырой яичный белок превращается в твердое белое вещество яичного белка, сваренного вкрутую, не затрагивают ни аминокислот, ни связей между ними – по крайней мере, тех, которые я описал. Тепла, достаточного для того, чтобы сделать яйцо твердым, а фермент – неактивным, оказывается явно мало для того, чтобы разорвать пептидную связь. В денатурированном белке (то есть таком, который не способен более выполнять свои биологические функции) присутствуют все те же пептидные цепочки, состоящие из тех же аминокислот, что и в исходном белке до нагревания.
Разумеется, мы не можем принять представление о том, что тут имеет место что‑то мистическое, лежащее вне рациональных законов природы. Если свойства денатурированного яичного белка отличаются от свойств исходного яичного белка, то, значит, между этими двумя веществами есть какая‑то разница. Раз молекула белка денатурируется и при этом не разрывается ни одна связь между ее атомами, значит, существуют какие‑то более слабые связи, при этом жизненно важные для сохранения особых свойств молекулы, которые разрушаются под воздействием слабых изменений окружающей среды, приводя тем самым к денатурации.
Такое предположение подтверждается и тем фактом, что иногда в денатурированных белках обнаруживаются сочетания белков, не встречающиеся в исходных белках. Чаще всего в этих сочетаниях встречается так называемая «меркаптановая группа», состоящая из атома серы и атома водорода (‑S‑H) (рис. 25). Она содержится в присутствующей практически во всех белках аминокислоте – цистеине.
Некоторые химические вещества могут вступать в соединение с меркаптановой группой, образуя вещество, выпадающее в виде осадка или растворяющееся, но обладающее при этом характерным цветом. (Химические вещества, используемые для обнаружения определенных атомов или сочетаний атомов с помощью облегчения их визуализации, называются «тестовыми реагентами».) Даже если сам цистеин связан в пептидной цепи, его радикал с меркаптановой группой остается свободным, и те же самые тестовые реагенты, которые вступают в реакцию с чистым цистеином, будут реагировать и с пептидной цепочкой, содержащей цистеин.
Однако многие белки, в состав которых цистеин явно входит (поскольку обнаруживается среди смеси аминокислот, на которые белок распадается под воздействием кислоты), сами по себе в реакцию с тестовыми реагентами не вступают. А вот после денатурации – запросто.
Проще всего предположить, что в природном белке пептидная цепочка имеет такую форму, при которой радикалы части составляющих ее аминокислот направлены не «наружу», а в некую «внутреннюю полость» молекулы. Если эти аминокислоты – цистеин, а следовательно, эти «изолированные» от внешней среды радикалы – меркаптан, то тестовые реагенты просто не могут дотянуться до него, чтобы вступить в реакцию. А после денатурации пептидная цепочка раскрывается, и тестовые реагенты получают доступ к меркаптановой группе.
В процессе денатурации разрушается упорядоченность трехмерной формы пептидной цепочки. Ее звенья принимают произвольное положение в пространстве. Такому увеличению беспорядка соответствует значительное увеличение энтропии. А вот для проведения обратного процесса – формирования искусно сложенного естественного белка из денатурированного – требуется уже уменьшать энтропию, а значит, подобная «ренатурация» практически невозможно (разве что на самой первой стадии процесса). Чтобы можно было представить это положение наглядно – ренатурацией был бы процесс «разваривания» яйца, сваренного вкрутую, обратно в живое яйцо.
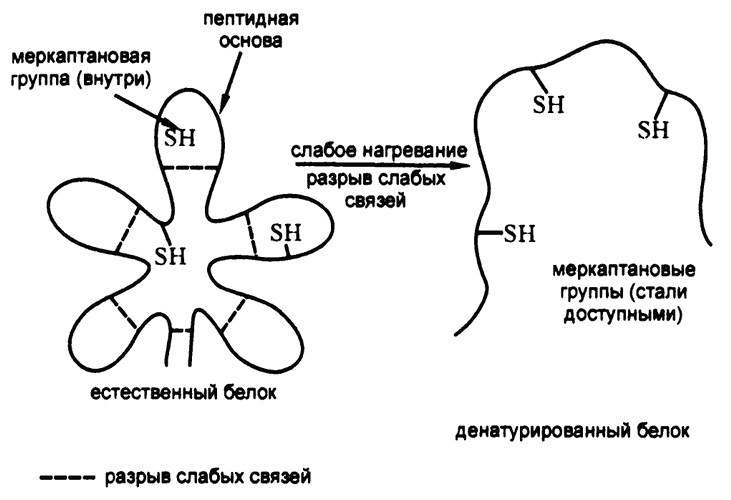
Рис. 25. Денатурация пептидной цепочки
Значит, изначальная пептидная цепочка поддерживается в «нужной» форме с помощью неких химических связей, и эти связи настолько слабы, что даже незначительное изменение условий способно их разрушить и тем самым денатурировать белок.
Перед тем как перейти к обсуждению природы этих слабых связей, на которые мы и возложим ответственность как за хрупкость белков, так и за особые свойства ферментов, мне придется сделать небольшое отступление и поговорить о природе химических связей как таковых. Мне придется повторить часть уже сказанного в главе 10, но сейчас подробностей будет гораздо больше.
С самого момента зарождения теории атомов стало ясно, что должна существовать какая‑то сила, которая удерживает разные атомы в составе одной молекулы. Более того, тот образ, которым эта сила себя проявляет, оказался индивидуальной характеристикой каждого элемента. К примеру, выяснилось, что один атом водорода никогда не может присоединять к себе более одного чужого атома, один атом кислорода – больше двух других атомов, один атом углерода – больше четырех и так далее.
В 1852 году английский химик Эдуард Франкленд предложил назвать эту способность атомов словом «валентность» (от латинского слова, означающего «способность»). То есть валентность водорода – 1, как и фтора, хлора, брома, йода, натрия и калия. Валентность кислорода – 2, и такой же валентностью обладают сера, магний и кальций. Валентность азота – 3, и в эту же группу входят фосфор, мышьяк и алюминий. Валентность углерода и кремния – 4.
Валентность одного и того же элемента не обязательно всегда одна и та же. К примеру, валентность углерода – в принципе 4, но иногда он имеет валентность 2. Валентность азота – вообще 3, но бывает, что и 5. Валентность железа – 2 или 3; золота – 1 или 3; меди и ртути – 1 или 2 и так далее.
В отношении достаточно простых неорганических веществ вопрос о валентностях не влияет на вид уже устоявшихся формул. Так, железо может соединяться с хлором двумя различными способами. Один атом железа может вступать в соединение как с двумя (дихлорид железа, FeCl2) атомами хлора, так и с тремя (трихлорид железа, FeCl3). В обоих случаях из формулы понятно, с каким именно соединением мы имеем дело, и видно, что в первом случае валентность железа – 2, а во втором – 3.
Однако при переходе к значительно более сложным органическим соединениям введение понятия валентности произвело жизненно необходимую революцию в деле написания формул. Уже в начале XIX века стало ясно, что традиционная схема для органической химии не годится, потому что выяснилось, что совершенно различные вещества могут иметь один и тот же атомный состав.
Первым это обнаружил, к собственному изумлению, немецкий химик по имени Юстус фон Либиг, выделивший в 1823 году вещество, названное им «гремучим серебром». Фон Либиг установил, что молекула этого вещества состоит из четырех атомов – по одному атому серебра, углерода, азота и кислорода. И оказался в недоумении – дело в том, что вещество точно с таким же атомным составом было на тот момент хорошо известно, носило название «изоцианат серебра» и имело абсолютно другие свойства.
Об этом рассказали Берцелиусу, но он отказывался верить услышанному до тех пор, пока сам не открыл два вещества с одинаковым атомным составом, но разными свойствами. Берцелиус назвал такие «родственные» вещества «изомерами», но природа изомерии, как явления, так и осталась на тот момент загадкой.
Ключом к решению стало введенное Франклендом понятие валентности. В 1859 году немецкий химик Фридрих Август Кекуле первым использовал графическое выражение записи формул с учетом валентности каждого элемента. Вот так выглядели в новой записи формулы таких хорошо известных веществ, как вода (H2O), метан (СН4), углекислота (CO2), аммиак (NH3) и хлороводород (HCl):
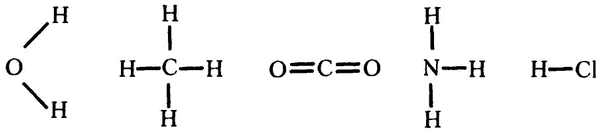
В составе всех этих веществ атомы водорода (Н) и хлора (Cl) всегда имеют только одну связь, атом кислорода (О) – две, азота (N) – три, углерода (С) – четыре. Эта же система доказала свою работоспособность и в применении к более сложным органическим веществам, таким как сахароза или триптофан. Такая запись получила название «структурная формула», а для записей старого типа, вроде СН4, был принят термин «эмпирическая формула».
Практически сразу стало ясно, что одни и те же атомы вполне можно соединить по‑разному, не нарушая законов валентности. Рассмотрим пример первой открытой пары изомеров. Вот как выглядит структурная формула гремучего серебра:
Ag–N=C=O.
(Ag – это обозначение серебра, от латинского «argentum».) А структурная формула изоцианата серебра выглядит так:
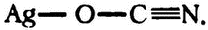
Как видно, в обоих случаях валентность атома серебра остается равной 1, кислорода – 2, азота – 3, а углерода – 4.
В более сложных органических соединениях количество вариантов соединения молекул без нарушения принципа валентностей увеличивается многократно и доходит до фантастических величин. К примеру, подсчитано, что с использованием 40 атомов углерода и 82 атомов водорода можно составить более шестидесяти триллионов разных вариантов молекулы.
Вот уже более ста лет химики руководствуются системой Кекуле при составлении возможных вариантов строения новой молекулы и числа ее возможных изомеров. С тех пор, конечно, система во многом была доработана и стала более гибкой, но в основном она все та же и, похоже, останется такой и в обозримом будущем.
Главным недостатком системы валентностей в глазах химиков середины XIX века была ее условность. С чего бы это у кислорода валентность 2, у углерода – 4, а у водорода – только 1? А вот у водорода, натрия и хлора – валентность одинаковая, а все остальные свойства – совершенно разные?
На поверку система валентностей оказалась не такой уж и условной, и доказал это русский химик Дмитрий Иванович Менделеев. В 1869 году он выписал все известные элементы в порядке возрастания атомного веса и наглядно показал, что изменение их свойств в таком расположении подчиняется определенным законам. Расписав все элементы в двухмерной матрице, где элементы со схожими свойствами оказались сгруппированными в столбцы, он получил то, что всем нам сейчас известно как «таблица Менделеева»[5]. В частности, оказалось, что внутри каждого столбца все элементы имеют одинаковую валентность (рис. 26).
К примеру, одновалентные фтор, йод, хлор и бром оказались в одном столбце таблицы; двухвалентные магний, кальций, стронций и барий тоже оказались собранными в одном столбце. Точно так же в одном столбце очутились демонстрирующие валентность 3 или 5 азот, фосфор, мышьяк и сурьма и так далее.
Если же проследить не столбцы, а строки таблицы, то оказывается, что внутри всех строк валентность изменяется одинаковым образом. Взять, к примеру, вторую строку (первую из полных строк таблицы): в порядке возрастания атомного веса в ней перечислены литий, бериллий, бор, углерод, азот, кислород и фтор. Соответственно, валентности этих элементов – 1, 2, 3, 4, 3 (или 5), 2 и 1.
Изобретение периодической таблицы Менделеева стало одной из величайших побед химической теории, заставив ученый мир признать валентность логически неотъемлемым свойством элементов, хотя механизм химических связей все еще продолжал оставаться загадкой.
Затем, примерно в конце века, было обнаружено, что и атом имеет собственное внутреннее строение. Стало известно, что в нем содержатся электроны. Выяснилось, что в середине атома находится крошечное ядро, имеющее положительный заряд, а все остальное пространство атома заполнено облаком отрицательно заряженных электронов, вращающихся вокруг ядра. Ядро атомов каждого элемента характеризуется свойственной только ему величиной заряда. Ядро атома водорода несет минимально возможный заряд, произвольно принятый за 1. Заряд ядра атома углерода в шесть раз больше, поэтому его значение оценивается как 6. Таким же образом значение заряда ядра атома азота принимается за 7, а ядра атома кислорода – за 8. Для всех возможных значений от 1 до 103[6]можно найти свой элемент.
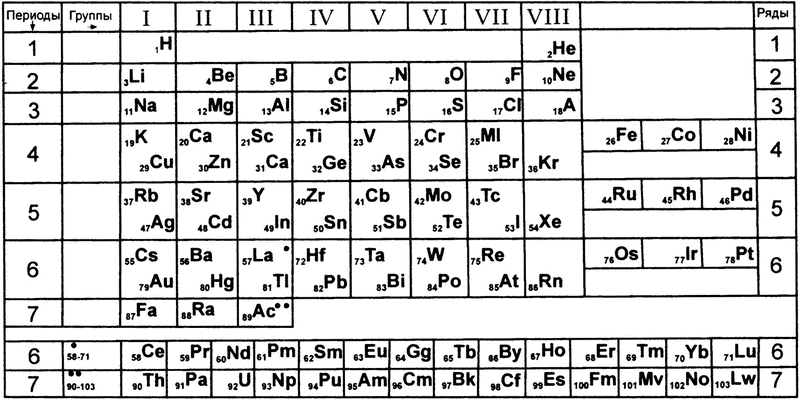
Рис. 26. Таблица Менделеева
В идеале свободный атом имеет ровно столько электронов (заряд каждого из которых равен ‑1), чтобы уравновешивать положительный заряд ядра. Так, в атоме водорода – 1 электрон, в атоме углерода – 6, в атоме азота – 7, в атоме кислорода – 8 и так далее.
Электроны распределяются по оболочкам, в каждой из которых может содержаться не более определенного их количества. Во внутренней, самой близкой к ядру, оболочке может находиться только 2 электрона, в следующей – уже 8, в следующей – 18 и так далее. Так, если атом углерода имеет 6 электронов, то они должны быть распределены по двум оболочкам – 2 во внутренней и оставшиеся 4 – во внешней. А у атома хлора – 17 электронов, значит, они должны быть распределены уже между тремя оболочками – 2 во внутренней, 8 в средней и оставшиеся 7 – во внешней.
Теперь все закономерности таблицы Менделеева становятся понятны. Взять, к примеру, седьмой столбец: первым в нем идет атом фтора – его 9 электронов поделены между двумя оболочками, внешняя из которых содержит 7 электронов; затем – атом хлора, его 17 электронов поделены уже между тремя оболочками, но внешняя опять же состоит из 7 электронов; 35 электронов брома распределяются уже между четырьмя оболочками, но и тут на внешнюю оболочку приходится только 7 из них. И во внешней (пятой) оболочке йода, имеющего в своем составе 53 электрона, тоже находятся 7 электронов. Свойства этих элементов близки потому, что все они имеют по 7 электронов во внешней оболочке.
Чем глубже химики XX века проникали в предмет, тем обыденнее в химических записях становилось обозначение, при котором элемент маркируется не только обычным символом, но и количеством электронов в его внешней оболочке. К примеру, водород, обладающий всего одним электроном, обозначается как H•.
Углерод, всего имеющий шесть электронов, но во внешней оболочке – только четыре, обозначается как

В таблице 7 приведены «электронные» записи некоторых особо важных для живой материи элементов.
Что касается легких элементов, вроде перечисленных в таблице 7, самым стабильным является случай, когда во внешней оболочке находится восемь электронов. Важным исключением является гелий, имеющий всего одну оболочку с максимальным числом возможного вмещения электронов – 2. Конечно, для него самым стабильным вариантом является случай с двумя электронами во внешней оболочке.
Теперь давайте рассмотрим натрий. Его 11 электронов распределены следующим образом: 2 – во внутренней оболочке, 8 – в средней и 1 – во внешней. Если атом натрия потеряет 1 электрон, то его внешней оболочкой станет средняя, в которой как раз 8 электронов, то есть будет достигнуто стабильное положение. Поэтому атом натрия весьма склонен терять «лишний» электрон.
Таблица 7.
Дата добавления: 2016-01-26; просмотров: 3098;
