Вещество … Формула … Теплота на грамм
Водород … Н2… 34,2 ккал.
Метан … СН4… 13,2 ккал.
Уголь … С … 7,8 ккал.
Этиловый спирт … С2Н6О … 7,1 ккал.
Глюкоза … С6Н12О6… 4,1 ккал.
Как я уже объяснял в главе 8, водород при сжигании выделяет гораздо больше тепла на грамм, чем углерод; соответственно углеводород, например метан, будет выделять некое промежуточное количество теплоты. Тот факт, что спирт выделяет еще меньше теплоты на грамм, чем даже углерод, хотя в составе его молекулы присутствует и водород, я объяснял присутствием в ней также и атома кислорода. Молекула спирта является уже «частично сгоревшей», и на выделение тепла при сгорании в ней остается меньше молекул. По такой же логике и глюкоза (которую можно принять за типичный углевод), формула которой С6Н12О6, является изначально еще более «сгоревшей», чем спирт. Атомы кислорода составляют четвертую часть всех атомов молекулы глюкозы, а в спирте их доля – всего лишь 1/9. Выходит, нечему удивляться, что при сгорании грамма глюкозы выделяется меньше тепла, чем при сгорании грамма спирта.
А вот с жирами – другое дело. Молекула жира, где кислород составляет всего 1/28 от общего числа атомов, является в гораздо меньшей степени «сгоревшей», чем молекула углевода или даже спирта. Поэтому логично ожидать, что теплота реакции в расчете на грамм у жира будет больше, чем у спирта, но меньше, чем у метана, в молекуле которого кислорода нет вообще. Экспериментальные данные показывают, что при сжигании жиров выделяется 9,45 килокалории на грамм. Белок, молекула которого содержит меньше кислорода, чем молекула углевода, но больше, чем молекула жира, имеет показатели промежуточные между показателями этих двух веществ, и при сжигании белка в калориметре фиксируется выделение 5,65 килокалории на грамм.
Это все в том случае, если из еды разводить костер. А как насчет того процесса, в котором еда используется не в пример чаще, – имеется в виду поглощение ее живым организмом? Измерить, сколько тепла выделяет организм, гораздо сложнее, чем сколько выделяет костер, но тоже возможно. Для начала нужен достаточно большой калориметр, чтобы в него поместился живой организм. Организм ест и выделяет отходы; вдыхает кислород и выдыхает углекислый газ. Если точно измерить все, что организм имеет на входе и выходе в процессах питания и дыхания, то в идеальном случае можно высчитать, сколько в нем в данный момент находится питательных веществ и кислорода. Дальше можно рассчитать, сколько тепла выделили бы эти вещества в этом объеме, будучи сожженными в калориметре. Если измерить тепло, вырабатываемое организмом на самом деле, то логически возможен один из трех вариантов – либо оно окажется равным теплу, которое было бы из того же топлива выработано при сжигании, либо большим, либо меньшим. Каким именно окажется это отношение – принципиально важно для решения вопроса о том, распространяются ли законы термодинамики на живые организмы.
Впервые такой эксперимент с достоверной точностью провел немецкий физик Макс Рубнер в 80‑х годах XIX века. Исполнение Рубнера было на редкость методичным. Сначала он подверг тщательному анализу экскременты подопытного животного. Несмотря на то что корм состоял сплошь из легкорасщепляемых жиров и углеводов, часть этих питательных веществ все равно прошла весь пищеварительный тракт, так и оставшись непоглощенной, так что для объективности картины этот процент следовало вычеркнуть из общего количества «сжигаемой» пищи. Среди углеводов процент не подвергнувшихся перевариванию оказался ничтожно малым, но среди жиров – более существенным. С учетом неполноты переработки, энергетическое содержание углеводов и жиров в пище пришлось уменьшить до 4 и 9 килокалорий соответственно.
С белками получилось еще сложнее. Если итоговыми продуктами сгорания углеводов и жиров являются углекислота и вода, будь то сгорание в пламени или в организме, то в отношении белков все не так просто. В калориметре атомы углерода и водорода из молекулы белка превращаются все в те же углекислоту и воду, но нельзя ведь забывать и про атомы азота! Они высвобождаются в калориметре в виде окислов азота. На самом деле в белках еще встречаются атомы серы и других элементов, но их процентное содержание настолько мало, что в данном случае ими смело можно пренебречь.
Однако в организме млекопитающих азотистая составляющая расщепляемых белковых молекул переходит не в окислы азота, а в мочевину (CH4ON2) – растворимое твердое вещество, выводимое из организма с мочой. При сжигании молекул мочевины тоже выделяется некоторое количество энергии, так что, если в живом организме она остается несожженной, значит, энергию ее сжигания тоже следует вычесть из общей энергии сжигания пищи. А в этом случае оказывается, что энергия, получаемая тканью млекопитающих из белка, примерно равна энергии, получаемой из углеводов, – 4 килокалории на грамм.
Факт производства организмом мочевины является полезным для исследователя – сейчас объясню почему. Общее количество пищи, используемой и «сжигаемой» живой тканью за заданный промежуток времени, определяется путем замера количества производимого за это время углекислого газа. Однако количество высвобождаемой при этом энергии зависит от того, какая именно пища поглощалась. Некоторое количество углекислого газа, выделенное при сжигании жира, соответствует большему количеству энергии, чем то же самое количество углекислого газа, выделенное при сжигании углеводов.
Поэтому Рубнер счел необходимым измерять не только количество выделяемого углекислого газа, но и количество потребляемого кислорода. Так он получил коэффициент дыхания и смог установить соотношение потребления организмом углеводов и жиров. Чем выше коэффициент дыхания, тем больше в процентном соотношении организм усваивает углеводов и тем меньше энергии производит в расчете на литр вдыхаемого кислорода. Чем ниже коэффициент дыхания, тем больше организм усваивает жиров и тем больше энергии производит на литр потребляемого кислорода.
Но это верно только в том случае, если углеводы и жиры – это единственные вещества, потребляемые организмом, то есть если белок не потребляется вообще. А это не так – белок потребляется всегда. Средний объем потребления белка – около 10 процентов от суммарного объема жиров и углеводов. Но то средний, а для того, чтобы подсчитать какие‑то более‑менее правдоподобные значения для коэффициента дыхания, а значит, и поступающей в распоряжение организма энергии, надо знать точное количество потребляемого белка.
Допустим, что коэффициент дыхания – 0,8. Если потребляемая при этом пища состоит исключительно из жиров и углеводов, то соотношение потребляемых веществ – 2 части жиров на 1 часть углеводов, и выход энергии, на основе расчетов, составленных с помощью бомбового калориметра, будет равняться примерно 7 ккал/г.
Теперь предположим, что на самом деле смесь потребляемых питательных веществ содержит 2 части жиров на 1 часть углеводов и 1 часть протеинов. Коэффициент дыхания при этом по‑прежнему будет равен 0,8 (поскольку именно таков коэффициент дыхания чистого белка, то он не будет изменяться, сколько белка ни подмешивай к смеси жиров и углеводов 2:1). Однако производство энергии на основе этой новой смеси упадет по сравнению с предыдущим случаем примерно до 6 ккал/г, поскольку белок – энергетически бедный материал по сравнению со смесью жиров и углеводов.
Однако мочевина производится только из белка. По данным анализа мочи (еще одно изобретение Рубнера) можно установить и количество потребляемого протеина. Кормление животных строго взвешенными порциями пищи, анализ мочи и кала, измерение количества потребляемого ими кислорода и производимого углекислого газа – все это позволяло Рубнеру совершенно четко знать, сколько и каких питательных веществ употребило то или иное животное за определенный отрезок времени.
А измерение количества вырабатываемого животными тепла привело его (как и исследователей позднейшего времени) к вполне ожидаемому выводу: в живом организме вырабатывается ровно столько же энергии, сколько ее высвободилось бы в бомбовом калориметре, если бы всю эту пищу просто сожгли.
К концу века уже всем стало ясно, что никакого волшебного источника энергии в живых существах нет; никто не может извлечь из системы больше энергии, чем в ней заключено. Короче говоря, первый закон термодинамики оказался так же справедлив для ящерицы, как и для камня.
Конечно, сам по себе закон, согласно которому количество калорий, поглощаемых живым организмом с пищей, уравновешивается количеством расходуемых им калорий, еще не значит, что и то и другое не может в значительной степени колебаться. Были созданы калориметры, куда мог помещаться человек, и замерялись данные при разных его состояниях и занятиях – люди в них сидели, стояли, печатали‑Разрабатывались и методики косвенного изменения расхода энергии во время бега, лазания, катания на велосипеде, езды верхом и так далее.
Неудивительно, что чем более активной деятельности предается человек, тем сильнее увеличивается производство его организмом энергии, а значит, тем больше жиров ему требуется. Если получать их в достаточном количестве с пищей не удается, то организм начинает расходовать внутренние резервы тела, что приводит к потере веса.
На самом деле все вопросы потери или набора веса косвенно завязаны на законе сохранения энергии. Для того чтобы сбросить вес, необходимо сократить потребление калорий до уровня ниже их расхода – либо начать меньше есть (сесть на диету), либо начать больше их тратить (заняться спортом), а еще лучше – и то и другое. А для того чтобы набрать вес, надо повести себя прямо противоположным образом.
Для уровня расхода энергии существует как верхняя, так и нижняя планка. Прыгая через три ступеньки вверх, или активно орудуя топором в лесу, или с азартом играя в теннис, человек может тратить энергию со скоростью 10 килокалорий в минуту. Все мы знаем, что долго это продолжаться не может.
С другой же стороны, полностью подавив любую сознательную деятельность, можно урезать расход энергии в пятнадцать раз, не больше. Не важно, насколько удобно мы уляжемся, расслабившись, все равно определенное количество энергии необходимо тратить на работу сердца, легких, печени, почек и т. п. Так же и двигатель автомобиля должен работать в некоем минимальном темпе, чтобы не заглохнуть. Разница лишь в том, что заглохший мотор можно запустить заново, а если «заглохнет» и остановится жизнедеятельность человеческого организма, то ее запустить уже ничто будет не в силах.
Меньше всего энергии расходуется человеком, разумеется, во сне, но замер расхода энергии спящего человека – вообще говоря, дело неблагодарное. Хотя бы потому, что и во сне активность человека может различаться очень сильно, он может спать крайне беспокойно, а объяснять спящему, что он должен спать крепко, – по понятным причинам бесполезно.
Следующий после сна способ сэкономить энергию – это бодрствовать, но лежать при этом неподвижно. Расход энергии при самом пассивном поведении в состоянии бодрствования процентов на 10 выше, чем при идеальном сне, но для эксперимента выбирать приходится все же бодрствование.
Совокупность химических процессов, происходящих в живом организме и, в частности, приводящих к производству в нем энергии, называют «метаболизмом», или «обменом веществ». Термин «метаболизм» ввел в обиход немецкий натуралист Теодор Шванн, произведя его от греческого слова, означающего буквально «перебросить на другое место», а в более широком значении – «изменить». Минимальному расходу энергии (ровно достаточному, чтобы не прерывать процесс жизнедеятельности) соответствует минимальная, или основная, интенсивность обмена веществ. Соответственно эту интенсивность называют «интенсивностью основного объема».
Условия для определения интенсивности основного объема таковы: прежде всего, обследуемый должен находиться в лежачем положении. Даже сидение требует постоянного расхода дополнительной энергии, поскольку большие мышцы туловища постоянно скоординированно сокращаются, поддерживая равновесие. Обследуемый должен быть голодным, после ближайшего к моменту измерения приема пищи должно пройти не менее двенадцати часов, чтобы гарантировать, что энергия не расходуется на пищеварение. В комнате должна быть комфортная температура, чтобы не повышать уровня энергии, расходуемой на выработку тепла (в случае, если в комнате холодно) или потение (если в комнате жарко). Обследуемый должен быть спокоен внутренне, во избежание энергозатрат на сокращения мышц, которые непроизвольно сопровождают любую сильную озабоченность. Самый лучший способ достичь этого состояния – дать обследуемому спокойно полежать полчасика в тишине.
Интенсивность основного обмена точнее всего определяется по количеству потребляемого кислорода, производимого углекислого газа и содержанию мочевины в моче. В упрощенном варианте мочу можно проигнорировать, пренебрегая, таким образом, белковой составляющей как незначительной. Упрощая еще дальше, можно сосредоточиться вообще на одном лишь потреблении кислорода, приняв коэффициент дыхания за средний – приблизительно 0,82 для голодного человека.
В среднем интенсивность основного объема человека составляет около 43 килокалорий в час, то есть – около 1000 килокалорий в день. Это значение очень сильно зависит от веса обследуемого, поскольку чем больше общая масса тела, тем больше энергии приходится тратить просто на поддержание в нем жизни. Так, если у человека весом в 115 килограммов интенсивность основного объема в среднем 68 килокалорий в час, то у 70‑килограммового – вышеупомянутые 43, а у 30‑килограммового ребенка – всего 20.
Чтобы избежать такого значительного разброса, интенсивность основного обмена следует пересчитывать на килограмм массы тела, и тогда получится, что 115‑килограммовый человек тратит около 0,59 ккал/кг/час, а 70‑килограммовый – около 0,61. У 30‑килограммового ребенка этот показатель окажется несколько выше, около 0,67 ккал/кг/час, но это и неудивительно – ведь ребенок растет, а построение новых тканей организма – это весьма энергоемкий процесс.
Кроме того, в 1883 году Рубнер установил, что интенсивность основного обмена можно представить с еще меньшими вариациями, если сделать поправку не на вес тела, а на площадь его поверхности.
Установление интенсивности основного обмена у других млекопитающих тоже обошлось без сюрпризов. У более крупных, чем человек, животных и интенсивность основного обмена оказалась выше, у более мелких – ниже. В пересчете на массу тела этот показатель уменьшается по мере увеличения массы животного, так же как и у людей.
К примеру, интенсивность основного обмена у человека – 1000 килокалорий в день, у мыши – только 3, а у слона – 50 000 килокалорий в день. Однако один килограмм мышиного организма потребляет в день 158 килокалорий, человеческого – 15, а слоновьего – всего 10.
Памятуя о том, что крупные животные, как правило, живут дольше, чем мелкие, нельзя не задаться вопросом: не связано ли это с интенсивностью обмена веществ? Не в том ли дело, что мелкие зверьки, так сказать, живут быстрее и быстрее изнашиваются?
Недостаток этой теории в том, что животный мир предоставляет нам слишком много исключений, слишком много случаев, когда более мелкие животные живут дольше, чем более крупные. Взять хотя бы самого человека.
Человек живет дольше, чем любая крупная обезьяна, даже горилла, гораздо более крупная, чем человек. Человек живет дольше, чем даже огромный слон. Не существует достоверных сведений о том, чтобы какой‑нибудь слон прожил хотя бы до семидесяти лет, как бы хорошо о нем ни заботились; в то же время мы знаем, что в цивилизованных странах половина населения доживает до этого возраста, а многие – и до столетнего юбилея. Даже киты, чью продолжительность жизни оценить сложно, и то вряд ли живут столько же, сколько и люди, поскольку даже самые крупные киты обретают способность к деторождению в возрасте трех лет – а ведь известно, что продолжительность жизни коррелирует с возрастом биологического взросления. Сравните три года кита с тринадцатью годами человека.
Единственные животные, о которых известно, что они живут дольше людей, – это гигантские черепахи, чей возраст может достигать двухсот лет. Но черепахи известны неторопливостью своей жизни. А среди быстро живущих существ никто и близко не стоит рядом с человеком.
Интенсивность основного обмена не представляла бы никакого особого интереса, если бы не было обнаружено, что при некоторых обстоятельствах она может очень сильно изменяться. Перед тем как перейти к подробностям, я должен сначала остановиться на термине «железа».
Железы еще могут называть гландами, от латинского слова «glans», что означает «желудь» – изначально им называли любые узловатые образования живой ткани в организме, например лимфатические узлы. (Это небольшие вытянутые образования, расположенные на некоторых из сосудов, по которым течет лимфа – жидкость, поступающая из крошечных кровеносных сосудов и омывающая клетки.) «Желудь» – это естественная метафора для чего‑нибудь маленького; на людей всегда производило сильное впечатление сравнение крошечного желудя с огромным дубом.
Впоследствии и другие, более крупные органы похожей формы, например поджелудочную железу, стали называть этим же термином. В 1642 году немецкий анатом Иоганн Георг Вирсунг обнаружил в организме проток, ведущий от поджелудочной железы в верхнюю часть тонкого кишечника. Так выяснилось, что поджелудочная железа выделяет что‑то в тонкий кишечник.
Это открытие произвело на общественность столь сильное впечатление, что железами стали называть любой орган, выделяющий какие‑либо соки, даже крупные, например печень, производящую желчь. А ткани, ничего не выделяющие, железами именовать перестали – в частности, те самые лимфатические узлы, с которых все началось.
Первыми как железы были классифицированы те органы, которые, как печень или поджелудочная железа, имеют крупные, четко различимые протоки, по которым выводятся производимые ими вещества. В этом ряду можно назвать потовые железы, молочные железы и ряд мелких желез, находящихся во внутренней оболочке желудка и кишечника.
Однако в начале XIX века выяснилось, что существуют небольшие органы, которые, производя жидкости, выбрасывают их напрямую в кровь безо всяких протоков. После некоторых споров (о том, распространять ли на эти органы термин «железы», возобладала либеральная точка зрения. Немецкий анатом Иоганн Фридрих Меккель разделил все железы на две категории – имеющие проток и не имеющие его. Это деление сохраняется по сей день; железы, имеющие проток, называются экзокринными, а выводящие производимые ими вещества напрямую в кровоток – эндокринными.
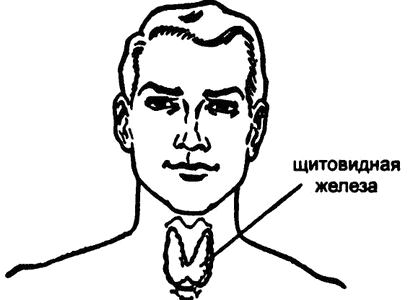
Рис. 21. Щитовидная железа
Одна из эндокринных желез окружает трахею сразу же под гортанью (рис. 21). Сама гортань состоит из хряща и впереди у нее вилкообразная выемка, которую можно прощупать пальцем, похожая по форме на выемки в щитах греческих солдат эпохи Гомера, через которые солдаты могли видеть врага, не высовывая голову из‑за укрытия. Ввиду такого подобия и сам хрящ назвали щитовидным, в 1646 году английский врач Томас Уортон перенес это название с хряща на расположенный рядом маленький мясистый орган, известный нам ныне как «щитовидная железа».
Иногда щитовидная железа распухает, образуя так называемый «зоб». В древности и в Средневековье на это смотрели достаточно благодушно, и в тех частях Европы, где такое встречалось достаточно часто, небольшое распухание шеи считалось даже неким дополнением к женской красоте. Однако к 1800 году врачи подметили, что зачастую наличию зоба сопутствуют симптомы заболевания, из которых самым заметным, если не самым важным, является выпучивание глаз.
Однако уменьшение щитовидной железы оказалось еще опаснее. В некоторых горных местностях Европы часто рождались слабоумные карлики, которых прозвали «кретинами» (это диалектный вариант произношения французского слова, означающего «христианин», – логика происхождения слова сродни логике происхождения русского термина «убогий»). Оказалось, что это явление непосредственно связано с функцией щитовидной железы. Более того, к концу XIX века было обнаружено, что удаление щитовидной железы у животных приводило к проявлению у них симптомов кретинизма, от которых удавалось избавиться только путем инъекции растолченной щитовидной железы.
Что именно в щитовидной железе оказывает такое мощное влияние на организм, оставалось полнейшей загадкой вплоть до 1896 года, когда немецкий химик Эуген Бауманн выяснил, что в щитовидной железе содержится редкий элемент – йод. Йода там обнаружилось очень мало, так что открытию Бауманна особого значения не придали. Ни химики, ни врачи того времени не понимали, что некоторые элементы могут иметь решающее значение для жизнедеятельности организма, присутствуя в нем в минимальных количествах (так называемые «рассеянные элементы», или «следовые элементы»).
Тем не менее уже в 1905 году американский врач Дэвид Марин, после обучения на Востоке поселившийся на Среднем Западе, подметил, что зоб – крайне распространенное явление как у людей, так и у животных в Кливленде, а на Востоке случаев зоба встречалось мало. Марину пришло в голову предположение, что это как‑то связано с низким содержанием в местной почве йода, в результате чего его содержание в воде и в растительной пище, поедаемой как животными, так и людьми, под Кливлендом оказывается гораздо ниже, чем на Восточном побережье, куда ветер доносит богатую йодом водную пыль из океана. Если йод необходим щитовидной железе для нормальной работы, то можно предположить, что ее увеличение – это попытка компенсации организмом нехватки йода.
Марин попробовал посадить животных на диету, обедненную йодом, и действительно у них стал образовываться зоб; после обогащения диеты йодом зоб опять исчезал.
Тогда ученый развернул кампанию по искусственному обогащению йодом питьевой воды в городском водопроводе и после долгой борьбы (вызванной сопротивлением, близким к тому, какое сейчас встречают призывы к аналогичному обогащению питьевой воды фтором) добился‑таки своего. Добавление йода в питьевую воду и соль (сейчас йодированная соль продается в каждом магазине) привело к тому, что проблемы образования зоба в цивилизованных странах сейчас практически сняты. Практически, но не полностью, ибо еще даже полвека спустя после открытия йодотерапии зоба все еще около 200 000 000 человек по всему миру еще страдают этим заболеванием. 30 000 000 из них живут в Латинской Америке, и даже в определенных местностях в Соединенных Штатах таких больных очень много – особенно в штатах Вашингтон и Орегон.
В то же самое время, когда с помощью химии была обнаружена важность йода для функционирования щитовидной железы, клинические исследования привели к открытию не менее важного фактора.
В 1895 году немецкий врач А. Магнус‑Леви провел ряд экспериментов по установлению интенсивности основного обмена у людей, страдающих различными заболеваниями. У большинства обследуемых значения интенсивности основного обмена оказывались такими же, как и у прочих, но вот у больных с нарушениями функционирования щитовидной железы дело обстояло иначе. Интенсивность обмена веществ у больных с повышенной активностью щитовидной железы была выше, а у людей с пониженной – ниже, чем у здоровых.
Соответственно возникло предположение, что именно щитовидная железа и управляет «минимальной скоростью работы» человеческого организма, являясь чем‑то вроде энергетического термостата. (Точный механизм этого контроля так и неизвестен до сих пор.) Теперь интенсивность основного обмена приобрела четкое практическое значение. Из любопытного физиологического курьеза она превратилась в инструмент диагностики расстройств щитовидной железы.
Повышение активности щитовидной железы на 10 процентов выше нормы приводит к тому, что человек становится гиперактивным, дерганым, нервным, то что называется «весь на эмоциях». Ее понижение – к тому, что больной теряет интерес к миру вообще. С помощью экстракта щитовидной железы и ингибиторов, подавляющих ее активность, стало возможным регулировать активность этого органа произвольным образом.
Однако после полувекового использования в качестве повсеместного диагностического инструмента замер интенсивности основного обмена постепенно исчезает из медицинской практики.
Предпосылки к тому появились еще в 1914 году, когда американский биохимик Эдвард Кельвин Кендалл выделил из экстракта щитовидной железы сравнительно небольшую молекулу, которой дал название «тироксин». Оказалось, что это и есть действующее вещество экстракта. Действующие вещества эндокринных желез английский врач Эрнест Генри Старлинг назвал «гормонами», от греческого слова, означающего «возбуждать», так что можно сказать, что тироксин – это гормон щитовидной железы.
Молекула тироксина необычна тем, что в ее состав входят четыре атома йода. В 1952 году английские биохимики Гросс и Питт‑Риверс открыли еще одно вещество, производимое щитовидной железой, «трийодтироксин», отличие которого от тироксина заключается в том, что в состав его молекулы входят не четыре, а три атома йода. Действие его оказывалось схожим с действием тироксина. Похоже, что характерные свойства как тироксину, так и трийодтироксину придает именно йод, больше в организме практически нигде не встречающийся.
Щитовидная железа выбрасывает гормоны прямо в кровь. Там они соединяются с белковыми молекулами, которые в норме находятся в плазме (жидкой составляющей крови). Если выделить соответствующую белковую фракцию, то можно проанализировать ее на содержание йода. Таким образом можно установить, какой объем гормона вырабатывается щитовидной железой (поскольку ее гормон – единственный источник йода в организме), а это, в свою очередь, будет свидетельствовать об активности щитовидной железы, из которой можно высчитать и интенсивность основного обмена. При этом не нужно голодать, неподвижно лежать целый час и дышать в шланг, и нет необходимости в дорогостоящих лабораторных комнатах – достаточно просто сдать небольшое количество крови.
Проблема оказалась только в том, чтобы на самом деле суметь проанализировать содержание йода в крови – ведь речь шла о точном установлении цифр порядка 1/20 000 000 грамма. Это стало возможным только в середине 50‑х годов XX века.
Для точного измерения столь малых величин пришлось прибегнуть к явлению катализа. После того как йод, связанный с белком, отделяют и собирают в растворе, напрямую измерить содержание растворенного вещества крайне маловероятно. Поэтому в раствор добавляются химические вещества, о которых известно, что под каталитическим воздействием йода они вступают в реакцию. Вещества эти добавляются в строго измеренном количестве, а скорость их реакции очень сильно зависит даже от малейших колебаний концентрации йода, так что именно по ней содержание йода и измеряется.
Следить за ходом реакции очень удобно, потому что она сопровождается изменением цвета раствора, которое можно точно измерить с помощью соответствующих приборов. Чем сильнее меняется цвет, тем интенсивнее проходит реакция, тем больше концентрация йода, тем выше уровень активности щитовидной железы, тем больше значение интенсивности основного объема. Очень удобно!
Глава 15.
КАТАЛИЗАТОРЫ ЖИЗНИ
Удобно также рассматривать дыхание и горение как родственные процессы, а человеческий организм – как аналог костра, раздуваемого кислородом и производящего углекислый газ. Но на самом деле между огнем и живым организмом существуют и значительные различия.
Во‑первых, огонь – механизм однонаправленный: он превращает дерево или иное топливо в углекислый газ и воду, оставляя лишь пепел, и синтезировать новое топливо не способен. А живой организм, извлекая энергию из распада углеводов, жиров и белков в ходе реакций, схожих с горением, в то же время умеет и создавать запасы новых жиров и углеводов, а также – строить новые белки взамен старых (этот процесс я опишу позже). В растущем организме все эти сложные молекулы строятся даже быстрее, чем поглощаются, ведь в организме десятилетнего ребенка перечисленных веществ содержится больше, чем в организме семилетнего, хотя вроде бы они активно расходовались с того момента на протяжении трех лет.
При создании сложных молекулярных составляющих ткани уровень свободной энергии увеличивается (как мы вскоре увидим), и энтропия соответственно уменьшается. То есть происходит процесс обратный тому, какой в терминологии термодинамики называется спонтанным.
Еще в конце главы 5 я выдвинул предположение о том, что, возможно, принципиальное различие между живой и неживой материей заключается в возможности первой вызывать локальное уменьшение энтропии. Тогда я упоминал только об энтропии механической энергии («совершение усилий») и приводил в качестве примера способность живых существ двигаться против силы тяжести. Теперь мы видим также, что живая материя может вызывать уменьшение энтропии и относительно энергии химической, обладая способностью сформировывать крупные сложные молекулы из более простых, хотя все спонтанные реакции протекают, наоборот, от большого к малому.
Связь между жизнью и уменьшением энтропии становится еще нагляднее, но до четкого определения нам пока еще далеко. В главе 5 я уже указывал, что солнечное тепло испаряет океанскую воду, а силы, действующие в земной коре, воздвигают горы, и ни в первом, ни во втором случае явно не задействовано никаких структур, которые можно было бы отнести к «живым».
Помимо этих «безжизненных» примеров из области механической энергии можно найти аналогичные и из области энергии химической. Облучение растворов простых молекул ультрафиолетом приведет к образованию более сложных молекул, и множество фактов свидетельствует о том, что в первые миллионы лет существования Земли именно так и происходило в массовом порядке – жизни еще не было в принципе, а Солнце яростно облучало ультрафиолетом Мировой океан. На самом деле именно этим «безжизненным» процессам уменьшения энтропии применительно к химической энергии, скорее всего, и обязана своим возникновением сама жизнь.
Так искомый принцип различения снова ускользает от нас.
Однако не стоит обескураживаться. Ведь между огнем и живым существом есть и еще одно очевидное различие.
Огонь – очень горячий, а человек – нет. Да, человек поддерживает некоторое тепло в своем организме, но эти 37 °С ни в какое сравнение не идут с температурами пламени – 700 °С и выше. А в организмах холоднокровных животных процесс поглощения кислорода и производства углекислоты может проходить и при температурах около 0 °С.
Соответственно тут же вспоминаются условия, при которых реакции подобные горению могут запускаться при низких температурах. Вряд ли горючее, используемое организмом, воспламеняется легче, чем обычное топливо костра. Если взять те же самые пищевые продукты и просто положить их на стол при комнатной температуре, они не загорятся никогда и процесс соединения с кислородом будет происходить в них не быстрее, чем в древесине или угле. А вот в организме реакции соединения почему‑то происходят достаточно легко и при температурах, которые никогда не поднимаются выше просто теплых.
Ученым XIX века оставалось только сделать единственно логичный вывод о существовании в живой ткани неких катализаторов, работающих по схеме, которую я описал в главе 12. На самом деле именно те катализаторы, которые вызывают горение в лабораторных условиях – палладий и платина, – в живой ткани не встречаются, но это может означать лишь то, что существуют и другие. И опять можно было задаться все тем же вопросом: являются ли эти биологические катализаторы таковыми в полном смысле слова и в соответствии с законами термодинамики, действуя так же слепо, как и порошок платины, или все же в данном случае нам удастся обнаружить некую «жизненную силу», стоящую над термодинамикой.
В среде химиков XIX века этот вопрос вызвал ожесточенные споры, и только благодаря ряду реакций, известных человечеству с доисторических времен, опыт перевесил аргументы сторонников существования «жизненной силы».
Во фруктовых соках, как и в замоченном зерне, как правило, со временем происходят некоторые изменения. Не всегда они оказываются желательными, но в некоторых случаях – и это обнаружили еще доисторические люди – человек, выпивший такую «подпортившуюся» жидкость, чувствовал приятное тепло и легкость. Со временем люди выяснили, что можно не просто выставлять сок и надеяться, что получится нужный результат, а добавлять в емкость с соком небольшое количество уже достигшей нужного состояния жидкости из предыдущей порции, и тогда изменения, во‑первых, идут в нужном направлении, а во‑вторых – гораздо быстрее.
Так же и в тесте, из которого пекут хлеб, иногда происходят реакции, приводящие к формированию углекислого газа. Пузырьки газа образуются по всей массе теста, и получающиеся в результате лепешки разительно отличаются от обычных – плотных и тяжелых. И в этом случае тоже перенос кусочка теста с пузырьками в емкость с обычным тестом приводит к распространению реакции по всему объему теста.
Все эти изменения вызываются такой вещью, как дрожжи. Образование пузырьков газа как в вине, так и в тесте очень похоже на «медленное кипение» вещества. В связи с этим в современной терминологии процесс, при котором поднимается тесто, фруктовый сок превращается в вино, а закваска зерновых – в пиво, называется «ферментацией», от латинского слова, означающего «кипеть».
С точки зрения химика XIX века действие дрожжей очень похоже на действие катализаторов. Кроме того, они явно отличаются от обычных лабораторных катализаторов своей органической природой и тем, что катализируют реакции близкие к происходящим в живой ткани. Логично было предположить, что если в живой ткани и предполагается обнаружить какие‑то катализаторы, то они должны быть сродни скорее дрожжам, чем платине.
Но дрожжи оказались не просто катализатором – они сами по себе до странного походили на живое существо. Они не только оставались нерасходуемыми в ходе реакции, как обычные катализаторы, – они ухитрялись при этом еще и увеличиваться в объеме! В Первом послании к коринфянам о том же говорит и апостол Павел: «Малая закваска квасит все тесто».
Так и есть – а когда все тесто заквашено, то достаточно отщипнуть от него маленький кусок, чтобы с его помощью заквасить другое тесто, и так далее.
Но, несмотря на все свидетельства, принять дрожжи действительно за живое существо оказалось очень сложно. Широкое население запросто верило в существование множества невидимых глазу живых существ (ангелов, демонов, эльфов и прочих), но вот представление о том, что вполне обычные, не сказочные существа могут оказаться невидимыми только из‑за своих крайне малых размеров, почему‑то оказалось для общества гораздо менее приемлемым.
Но вот в XVII веке был изобретен микроскоп, и в 1675 году величайший из первых микроскопистов, голландский купец Антони ван Левенгук, сумел разглядеть в него «микроскопических животных». Это были одноклеточные существа, ныне именуемые «простейшими», длиной 0,005 см и менее, но не менее живые, чем мы с вами. Открытие Левенгука взбудоражило все научное сообщество до такой степени, что торговца‑иностранца даже приняли в Лондонское королевское общество – элиту ученых джентльменов.
В 1680 году Левенгук, с неизмеримым терпением и любовью изучавший под микроскопом все вокруг, обратил свой взор и на дрожжи и выяснил, что они состоят из крошечных шариков. Факт существования микроорганизмов в то время просто заставлял искать жизнь где угодно, но дрожжевые шарики уж совсем никак не были похожи на активно плавающих простейших.
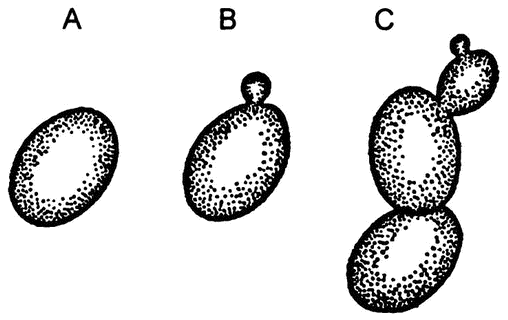
Рис. 22. Этапы размножения дрожжевых клеток почкованием
Однако в 1837 году французский физик Шарль Каньяр де Латур, изучая все те же дрожжи под микроскопом (а это был уже не тот примитивный микроскоп, с которым работал Левенгук), сумел застать эти крошечные шарики в момент отпочковывания (рис. 22). Почкование – это размножение, а где размножение, там и жизнь! Таким образом было получено свидетельство тому, что дрожжи – это одноклеточные существа, более близкие растениям, нежели животным, потому и неподвижные.
В 50‑х и 60‑х годах XIX века французский химик Луи Пастер в ряде своих классических опытов показал, что ферментизация – это результат жизнедеятельности таких микроорганизмов. Порча продуктов – например, образование кислого вина – это результат деятельности одних видов дрожжей, а получение нужных – например, хорошего вина – других. Да и гниение мяса Пастер наконец‑то смог убедительно приписать результату жизнедеятельности микроорганизмов (не то чтобы до него об этом никто не догадывался, но никому не удавалось предоставить убедительных доказательств).
Короче говоря, реакции, которые раньше принято было объяснять работой «органических катализаторов», теперь оказались результатом деятельности живых существ. Сторонники теории «тайны жизни» воспрянули духом.
Конечно, занять старые позиции и вновь утверждать, что «жизненная сила» – это принципиальный критерий различения органической и неорганической материи, было уже невозможно, но вот вторая линия обороны уже казалась вполне надежной. Нельзя было отрицать, что химик в своей лаборатории может искусственно воспроизвести синтез органического вещества, но оставалась вера в то, что он не может сделать это тем же путем, что и природа. Химик прибегает для этого к помощи высоких температур и давлений, сильнодействующих химических веществ или не встречающихся в природе катализаторов. И лишь существа, наделенные жизненной силой, могут формировать те же органические вещества при нормальных условиях с использованием весьма слабых химикатов.
Опасность для таких воззрений появилась с другой стороны. Кроме газообмена кислорода и углекислоты при дыхании к числу наиболее доступных для изучения химических процессов, происходящих в человеческом организме, принадлежат процессы пищеварения.
Причиной тому факт, что организм по форме своей похож на булочку для хот‑дога. И пищеварительный тракт – как отверстие для сосиски – пронизывает его насквозь, от начала до конца. Поскольку поместить что‑то в отверстие для сосиски – это не то же самое, что заковырять это что‑то в булочку, то и процессы пищеварения, проходящие в пищеварительном тракте, можно считать «внешними» для организма.
Практическая ценность этого факта заключается в том, что анализ содержимого пищеварительного тракта можно производить через ротовое отверстие без нанесения обследуемому каких‑либо повреждений.
Еще в 1752 году Реомюр, изобретатель температурной шкалы Реомюра, занимался изучением процессов пищеварения у сокола. Целью его работы было установить, что же именно совершается в желудочно‑кишечном тракте: просто ли механически перетирается пища или происходят какие‑то более тонкие изменения. Ученый заставлял сокола глотать металлические трубочки, внутри которых находились кусочки мяса. Металлическая трубочка была призвана защищать мясо от любого механического воздействия; по торцам трубки были закрыты проволочными сетками, сквозь которые легко мог проходить желудочный сок.
После того как сокол отрыгивал трубки (хищные птицы, как правило, заглатывают пищу целиком, а потом отрыгивают непереваренное), Реомюр видел, что мясо растворилось, а трубки полны чистой жидкостью. При этом запаха гниения не наблюдалось, так что ученый сделал вывод, что здесь имеет место некая другая реакция, не гниение, а что‑то сродни ферментации.
Другие исследователи в течение последующих десятилетий установили, что содержание желудка – кислотная среда, а в 1824 году Уильям Прут выяснил, какая именно кислота в нем представлена – соляная. К тому времени было уже хорошо известно, что кислота – это хороший катализатор таких реакций, как распад крахмала и белков на мелкие молекулы, так что ответ на вопрос о механизмах пищеварения родился сам собой – это кислотный катализ.
Однако дальнейшие исследования показали, что в желудочном соке содержатся и другие вещества, раствор которых оказывает разлагающее действие на мясо и которые не являются при этом кислотами. В 1835 году немецкий натуралист Теодор Шванн выделил из желудочного сока порошок, не являющийся кислотой, но при этом очень активно разлагающий мясо. Ученый назвал его «пепсином», от греческого слова, означающего «переваривание».
Это открытие оказалось новостью. Пепсин представлял собой одновременно и катализатор, и вещество совершенно органической природы. Такой органический катализатор назвали ферментом, поскольку тогда казалось, что ферментизация и пищеварение – явления одной природы.
В это же время двое французских ученых, Ансельм Пайен и Ж.‑Ф. Персо, произвели нечто подобное в отношении экстракта из солода (вымоченного ячменя). В 1833 году они получили фермент, способный расщеплять крахмал на сахар. Сахар этот получил название «мальтоза», от английского «malt» – «солод», а сам фермент – «диастаза». Пайен оказался первопроходцем в деле присвоения имен классам химических веществ. Введенный им термин «целлюлоза» завел моду на окончание «‑оза» для Сахаров, а со введением названия «диастаза» и все остальные ученые стали давать открываемым ферментам названия, заканчивающиеся на «‑аза» (правда, в течение какого‑то периода ферментам, задействованным в пищеварении, все же давали окончания на «‑ин», по аналогии с пепсином).
А выделение различных ферментов – продолжалось. Немецкий химик Юстус фон Либих, вместе с Вёлером, занимался изучением экстрактов горького миндаля – к тому моменту было уже известно, что его действие приводит к распаду вещества растительного происхождения под названием «амигдалин». К 1837 году ученые решили, что в экстракте содержится некий фермент, которому было дано название «эмульсин». Тогда же французский химик Опост Пьер Дюбранфо сумел выделить из дрожжей экстракт, с помощью которого можно было вызывать распад сахарозы на более простые сахара – глюкозу и фруктозу. Он назвал это вещество «инвертазой».
Как оказалось, механизмы действия ферментов, как и катализаторов, совершенно не нарушают законов термодинамики. Ферменты изменяют лишь скорость реакции, но никак не положение точки равновесия (см. главу 9). В этом отношении оказалось, что живые организмы не имеют особенных свойств, которых был бы лишен мир неживой природы.
Однако позицию сторонников «жизненной силы» такие рассуждения могли лишь пошатнуть, но не разрушить. Да, все эти выделенные ферменты – органические вещества, и они способны катализировать определенные реакции, но лишь те (по крайней мере, так казалось в тот момент), которые сходны с расщеплением продуктов в пищеварительном тракте. А все процессы, происходящие в пищеварительном тракте, нельзя рассматривать как «жизненные» в полном смысле слова, поскольку они проходят вне живых тканей.
Далее сторонники «жизненной силы» настаивали на том, что изолированные ферменты не способны и никогда не будут способны катализировать реакции, происходящие внутри самих тканей, например превращать раствор сахара в спирт. На такое способны только цельные живые клетки дрожжей, и внутриклеточный энергообмен все еще оставался делом загадочным.
Для того чтобы еще больше подчеркнуть важность «духа жизни», они ввели разделение ферментов на две категории – на участвующие и не участвующие в процессах жизнедеятельности, назвав первые «организованными ферментами», а вторые, соответственно, «неорганизованными».
В 1876 году немецкий физиолог Вильгельм Кюне продвинулся еще на один шаг дальше. Он предложил оставить термин «фермент» только для жизненных процессов, а все неорганизованные ферменты, действующие и в отсутствие какой‑либо жизни, назвать по‑другому, «энзимами», что по‑гречески означает «в дрожжах», поскольку одним из источников добычи этих ферментов могут служить дрожжи.
Итак, сторонники «жизненной силы» мудро отступали, сдавая одну позицию за другой, но сохраняя при этом нетронутым сам принцип своей веры, на протяжении всего XIX века. Принцип же этот заключался в том, что живая материя вследствие присутствия в ней «жизненной силы» подчиняется иным законам, нежели те, что известны нам из наблюдений и экспериментов над неживой природой.
Но вот в 1897 году немецкий химик Эдуард Бухнер решил как‑то раз приготовить себе для экспериментов как можно более цельный дрожжевой экстракт. Для этого ученый тщательно перемолол дрожжевые клетки песком и профильтровал полученную массу, получив таким образом чистый сок дрожжей без единой живой клетки.
По принятым в те годы воззрениям сторонников «жизненной силы», такой дрожжевой сок являлся мертвым, а значит – и неспособным к ферментированию сахара. Так что Бухнер решил, что лучшим способом предохранить экстракт от бактериального заражения будет залить его насыщенным раствором сахарозы, известной своим свойством консервировать продукты. Однако, к его вящему удивлению, добавленная в экстракт сахароза принялась ферментироваться. Сначала в растворе стали заметны пузырьки углекислого газа, а потом – обнаружился спирт.
Процесс такой ферментации, до того считавшийся прерогативой исключительно живых существ, в данном случае оказался вызванным мертвыми химическими веществами, и именно этот факт оказался смертельным ударом по представлениям о «жизненной силе». Оказалось, что с точки зрения энергетического обмена поведение «организованных» и «неорганизованных» ферментов ничем не различается. Так стало очевидно, что законы термодинамики работают и в клетках, и вне клеток, и вообще везде.
Ферменты производятся, как правило, живыми существами, но сами по себе они таковыми не являются, и действие их не имеет никакого отношения к жизни.
Но просто назвать органические катализаторы, являющиеся свойством живой материи, «ферментами» или «энзимами» – явно недостаточно, чтобы объяснить механизм их действия.
Умы биохимиков конца XIX – начала XX века были заняты вопросом о том, какова же на самом деле природа ферментов. Как свидетельствует накопленный к этому времени уже в достаточном количестве опыт работы с катализаторами реакций неорганической химии, для осуществления реакции требуется присутствие крайне малого количества катализатора, так что вполне вероятно было предположить, что экстракты ферментов способны полноценно катализировать реакции, содержа при этом слишком мало самого фермента, чтобы его можно было полноценно проанализировать. (Впоследствии оказалось, что так оно и есть.) Кроме того, любая вытяжка из живой ткани содержит столько различных веществ сложнейшего строения, что надо обладать терпением Иова и мудростью Соломона, чтобы понять, какое же из них является ферментом, если он вообще присутствует.
Так что оставалось только изобретать непрямые подходы. Если реакция идет, значит, фермент присутствует, если реакция не идет, значит, фермент отсутствует; тогда любое условие, при котором реакция останавливается (кроме, конечно, замены самих реагирующих веществ), можно трактовать как выключение действия фермента.
К примеру, слабое нагревание до температур, еще далеких до температуры кипения воды, как правило, приводит к тому, что через несколько минут катализируемая ферментом реакция останавливается. На реагирующие вещества при этом никакого эффекта не оказывается, поскольку если их отдельно нагреть, потом остудить, а потом опять добавить к ним раствор фермента, то реакция сразу же начнется снова. А вот если нагреть, а потом остудить раствор фермента и добавить его к реагирующим веществам, то никакой реакции не произойдет. Значит, нагревание однозначно воздействует как‑то на молекулу фермента, которая обладает слабой устойчивостью к высоким температурам.
Таким свойством обладают вещества одной группы – белки. Значит, ферменты – это белки? Начался сбор данных, свидетельствующих в пользу этого предположения. Стали пробовать другие виды воздействий, известных свойством приводить к распаду сложных белковых молекул (например, повышение кислотности среды или механическое взбивание раствора), и все они тоже приводили к прекращению реакций, катализируемых ферментами. Тот же эффект на реакцию оказывало и воздействие химических веществ, имеющих свойство связывать белки. Часто к прерыванию реакций, катализируемых ферментами, приводило и воздействие других ферментов, катализирующих распад белков. На основе всех этих косвенных данных в начале XX века общепринятым стало представление о том, что ферменты – это белки.
Однако в 1920 году немецкий химик Рихард Вильштеттер результатами своих работ заставил усомниться в справедливости такого воззрения. Он задался целью получить как можно более концентрированную вытяжку фермента, очистить ее от всего, от чего только получится. В итоге у ученого получился раствор с высокой каталитической активностью (что свидетельствует о наличии высокой концентрации фермента), но полностью лишенный какой бы то ни было белковой составляющей. Вильштеттер использовал все известные тесты на наличие белка в полученном растворе – и все они давали отрицательный результат. Белка не было.
Конечно, можно было предположить, что сам фермент содержится в растворе в неуловимо малом количестве, или сослаться на несовершенство тестов того времени (собственно, и то и другое впоследствии подтвердилось), но Вильштеттер оказался не столь скрупулезен. Он сделал четкий вывод: чем бы ни был фермент, это уж точно не белок. Ко мнению Вильштеттера – известного химика, лауреата Нобелевской премии – не могли не прислушаться, и представление о том, что фермент – это белок, исчезло из научной картины мира лет на десять.
А между тем в Америке мирно работал биохимик по имени Джеймс Батчеллор Самнер, занимаясь изучением растения под названием «карна‑валия мечевидная». Из этого растения ученый извлек вытяжку, которая катализировала распад мочевины на аммиак и углекислоту. По общепринятым правилам, новооткрытый фермент получил название «уреаза». Дальше Самнер выделил из уреазы маленькие кристаллики, раствор которых в чистой воде, как обнаружил химик, к своему удивлению, оказывал то же действие, что и сама уреаза.
Как ни старался Самнер в дальнейшем добиться действия вытяжки в отсутствие кристаллов, этого сделать не удалось. Разрушались кристаллы – прекращалось и действие, и в конце концов Самнер решил, что в кристаллической форме ему удалось выявить сам фермент. А поскольку результаты всех тестов свидетельствовали о том, что кристаллы состоят из белкового вещества, то пришлось признать, что как минимум один конкретный фермент – уреаза – все же является белком.
Авторитет Вильштеттера был так велик, что сперва открытию Самнера особого значения никто не придал. Но в 1930 году еще один американский биохимик, Джон Говард Нортроп, объявил, что ему с коллегами удалось выделить в кристаллической форме еще несколько ферментов, и среди них – пепсин. Тут же последовал ряд аналогичных достижений со стороны других ученых, и всякий раз выделенные кристаллы оказывались белками.
Так теория Вильштеттера рассыпалась под напором фактов, и в 30‑х годах XX века навсегда было установлено, что ферменты принадлежат к белкам. Так что сейчас мы смело можем говорить о том, что ферменты – это «белковые катализаторы», или «катализирующие белки».
Глава 16.
ПОДРОБНЕЕ О БЕЛКАХ
В свете всего описанного в предыдущей главе мы можем еще раз попробовать провести разграничение между живой и неживой природой, между ящерицей и камнем. Давайте попробуем.
Живой организм отличается способностью производить локальное и временное уменьшение энтропии путем химических реакций, катализируемых ферментами.
«Временной» эта способность названа с учетом того, что ящерица не пробудет живой дольше нескольких лет, даже если полностью удовлетворять все ее потребности. Лишь несколько видов животных (человек и некоторые черепахи) живут по сто лет, и лишь некоторые деревья – по тысяче, тогда как неживой предмет, скажем скала, может оставаться неизменным миллиарды лет, а то и бесконечно.
Таким образом, химические реакции, катализируемые ферментами, представляют собой важную часть определения. Именно их наличие отличает живой организм от систем, в которых локальное уменьшение энтропии достигается за счет подключения внешних источников энергии, таких как солнечный свет или внутреннее тепло Земли, и от рукотворных механизмов, в которых локальное уменьшение энтропии достигается за счет тепловых машин, химических батарей и т. п.
В некотором смысле, конечно, наше определение условно. Зачем подчеркивать важность ферментов? Рукотворные компьютеры и технические средства становятся с каждым годом все ближе и ближе к живым существам и даже к самому человеку. Скоро им станут доступны даже такие абстракции, как мышление, суждение, обучение… Можно ли поручиться, что рукотворные предметы никогда не поднимутся на уровень сложности, равный уровню сложности живых существ? А если это произойдет – сможем ли мы отказать им в праве называться «живыми» на том основании, что они не имеют никакого отношения к реакциям ферментации? А если на каком‑то этапе разработки искусственных механизмов в них будут включены и ферменты? Достаточно ли этого, чтобы счесть машины живыми?
Или – с другой стороны (не с такой уж и невероятной, как показывают события последних лет): что, если на других планетах обнаружатся объекты, обладающие всеми свойствами, которые принято приписывать живым существам, – возможно, даже разумом? Если химическая природа этих предметов не будет иметь ничего общего с ферментами или даже с белками вообще, если в них не будет происходить совсем никаких химических реакций – сможем ли мы счесть их живыми?
Задумываясь над этими вопросами, остается только пожалеть, что гипотеза о «жизненной силе» оказалась несостоятельной. Вот если бы она была верна, и действительно существовало бы два отдельных свода законов природы – один для живых существ, другой для неживой материи, – то тогда действительно можно было бы составить точное, корректное и безошибочное определение. Живой организм – это тот, который подчиняется таким‑то законам, а неживой предмет – таким‑то.
Увы, все объекты во Вселенной – и живые, и неживые – существуют по одним и тем же правилам, и поэтому так трудно провести разграничительную линию. Если сделать определение слишком широким – то под него обязательно подпадет какая‑нибудь звезда или даже Солнечная система, а чересчур сужая определение, можно сделать его слишком антропоморфным.
Один из вариантов решения этой проблемы – признать саму задачу принципиального различения между живой и неживой материей несущественной. Понятно, что любая попытка провозгласить принцип разделения, прежде всего, окажется попыткой выражения личных пристрастий провозглашающего. Ведь уже само представление о том, что все объекты должны строго делиться на две категории, живых и неживых, – это предрассудок, не имеющий под собой реального обоснования. На самом деле суть в том, что материя может организовываться как простыми, так и сложными способами, и часть сложных способов, которыми самоорганизовывается материя, принято называть «жизнью», а принципиальной границы между этими способами и близкими к ним провести невозможно.
Лично я считаю именно так, но беда в том, что для целей нашей книги эти рассуждения являются «абсолютно верными и абсолютно бесполезными». Условные определения не обязаны представлять собой Истину с большой буквы, главное – чтобы они помогали мыслить и чтобы их условность не отрицалась и не скрывалась. Вот, например, разделение химии на органическую и неорганическую до сих пор соблюдается не потому, что оно истинно, а просто потому, что это удобно.
Таким образом, признавая условность и возможную несостоятельность нашего определения перед лицом будущих успехов человека на ниве роботостроения и космических исследований, я выделил приведенное определение курсивом как пример адекватного ситуации и полезного принципа разделения живых и неживых существ. Оно коротко, просто, ясно и охватывает все примеры, которые вы или я можем встретить в мире на данном этапе развития человечества.
Итак, придя к удовлетворительному, с моей и, надеюсь, с вашей точки зрения, определению разницы между живой и неживой материей, одной из поставленных целей мы добились. Но было бы странно этим и ограничиться, поскольку ряд волнующих вопросов так и остался пока без ответа.
В конце концов, ведь химические реакции и катализаторы встречаются во множестве явно неживых систем. Реакции, происходящие в живых и неживых системах, в основном похожи и подчиняются одним и тем же законам природы. Так почему же разница в катализаторах приводит к таким кардинальным различиям, какие мы видим между живой и неживой природой?
Никто не спорит с тем, что пчела – более тонкий и сложный механизм, чем самолет, а мышь – более удивительная конструкция, чем гора.
Если такую разницу создает одно лишь присутствие фермента, то давайте же присмотримся к нему пристальнее.
Если сравнивать ферменты с обычными катализаторами из неорганических систем, то в глаза бросается множество различий. Ферменты гораздо более хрупки, их легче отключить, они более требовательны к условиям функционирования – им нужны строго определенный уровень температуры и кислотности, присутствие в небольших количествах одних ионов, полное отсутствие других и так далее.
Кроме того, ферменты в высшей степени специализированы. Если неорганические катализаторы, подобные платине или кислотам, способны ускорять множество реакций, то ферменты могут катализировать их лишь строго ограниченное количество. Очень часто один фермент проявляет способность катализировать лишь одну‑единственную реакцию, никак не влияя на ход других, как бы они ни были на нее похожи.
Причиной этих различий (скорее количественных, чем качественных, но тем не менее бросающихся в глаза) является различие в строении неорганических катализаторов и ферментов. Ферменты – это белки, а другие катализаторы – нет. И естественно предположить, что необычные свойства ферментов – следствие их белковой природы.
С этого и начнем.
На протяжении XIX века про молекулы белков точно знали только одно – что они большие.
Так, в 1860 году шотландский химик Томас Грэм обнаружил, что если с помощью листа пергамента разделить раствор некоего вещества в воде на участки с собственно раствором и чистой водой, то частицы растворенного вещества часто все же могут проникнуть через бумажную мембрану в «очищенную» часть. Химические тесты того времени позволяли легко обнаружить их.
Но оказалось, что таким свойством обладают далеко не все растворимые вещества. Поваренная соль и другие неорганические вещества проходят сквозь пергамент без проблем. Такие органические вещества, как сахара, – тоже. А вот растворенный белок так и остается по «свою» сторону пергамента. Грэм разделил все вещества на две категории – те, растворы которых проходят сквозь пергамент, и те, растворы которых не проходят. Поскольку проходящие сквозь пергамент вещества при испарении раствора легко проявляются в виде кристаллов, то он назвал их кристаллоидами, а клееобразные белковые растворы – «коллоидами», от греческого слова «колла» – «клей».
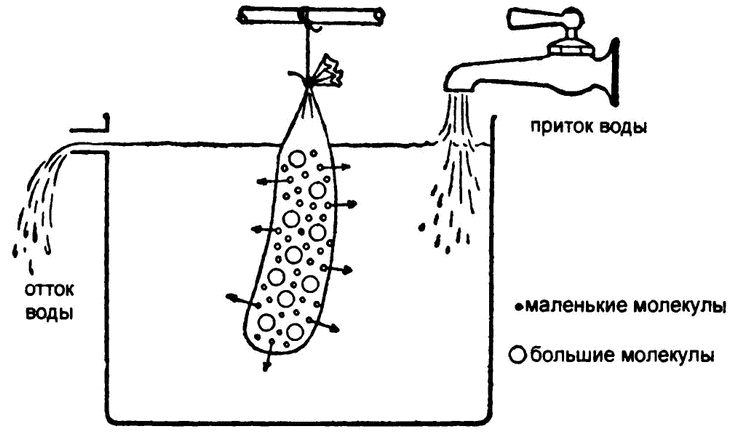
Рис. 23. Диализ с помощью полупроницаемой мембраны
Самое простое (и, за некоторыми уточнениями, верное) объяснение этому явлению кроется в том, что в пергаменте есть микроскопические поры, сквозь которые маленькие молекулы пролезают, а большие – нет. В результате пергамент и подобные ему мембраны – в первую очередь мембраны, окружающие живые клетки, – стали называть полупроницаемыми.
Так появился один из самых распространенных ныне способов очистки белковых растворов. Раствор белка помещали в мешок из полупроницаемой мембраны (в те времена самым распространенным материалом такого рода оказывалась колбасная оболочка – кишка) и подвешивали в проточной воде. Все вещества с малым молекулярным весом просачивались сквозь мембрану и смывались, а большие белковые молекулы оставались в мешке. Этот процесс носит название «диализ», или «мембранная сепарация» (рис. 23).
Тот факт, что белки не проходят сквозь полупроницаемую мембрану, устанавливает нижнюю планку размера белковой молекулы; тот факт, что белки все же растворяются, – верхнюю. Последний момент надо объяснить подробнее.
На каждую растворенную в воде частицу действуют две противоположно направленные силы. Первая – это сила тяжести, тянущая частицы вниз (предположим, что их плотность больше плотности воды; как правило, это так и есть), а вторая – это бомбардировка молекулами воды, постоянные случайные удары, поддерживающие вещество в равномерно растворенном состоянии. (Если частицы несут электрический заряд, то есть еще притягивающие и отталкивающие электрические силы, но этого момента мы сейчас касаться не будем.)
Для частиц любого видимого размера самой важной является сила тяжести, поэтому в конечном итоге они тонут. Однако чем меньше частица, тем большее значение приобретает бомбардировка молекулами и тем меньше становится скорость осаждения вещества. Описанное мной распределение явно видно, если горсть земли бросить в миску с водой. Любые камушки, если таковые там окажутся, тут же опустятся на дно. Чуть позже осядут и частицы чуть покрупнее, потом – помельче, наконец, – самые крохотные. В итоге в воде останется взвесь, поскольку какие‑то частицы так и не опустятся на дно, потому что они настолько малы, что молекулярная бомбардировка нивелирует действие силы тяжести, сводя скорость их осаждения до крайне малых значений, а то и до нуля.
На самом деле частицы, чей размер достаточно мал, чтобы они оставались во взвешенном состоянии вечно, глазом неразличимы. Однако для того, чтобы рассеивать свет, их размера вполне достаточно – это явление обнаружил в 70‑х годах XIX века британский физик Джон Тиндаль, и в его честь оно называется «эффект Тиндаля». Если пропустить через такой раствор луч света и посмотреть на емкость с раствором под прямым углом к лучу, то луч будет выглядеть как светлый туннель, проходящий сквозь туман. Именно благодаря взвеси мельчайших частиц, рассеивающих свет в направлении глаза наблюдателя, и виден луч.
Если же вместо человеческого глаза за происходящим наблюдает специальный микроскоп («ультрамикроскоп»), то через него видны и сами частицы в виде ярких точек.
Чем меньше частицы, тем слабее эффект рассеивания света, и когда их размер уменьшается настолько, что они уже могут проходить сквозь полупроницаемую мембрану, то эффект становится незаметным, и физики говорят, что раствор «оптически чист».
В растворах белков эффект Тиндаля наблюдается. С учетом того, что белковые молекулы достаточно велики, чтобы полупроницаемые мембраны оказывались для них непреодолимыми, и при этом достаточно малы, чтобы пребывать во взвешенном состоянии, в целом можно сказать, что они «коллоидных размеров».
«Коллоидные размеры» включают от 1 до 1000 миллимикронов в диаметре (напомню, миллимикрон – это одна миллиардная метра). Даже самые маленькие из коллоидных частиц должны состоять, соответственно, из тысяч атомов, а самые крупные – из триллионов. А средний вес одного атома молекулы белка – 7. Соответственно, можно сказать, что молекулярный вес белков, раз они лежат на отрезке «коллоидных размеров», – от 7000 до 7 000 000 000 000.
Столь большой разброс никак не может нас устроить в качестве «точных данных», но даже его достаточно, чтобы понять, что молекулы белка гораздо крупнее, чем молекулы таких веществ, как поваренная соль (молекулярный вес 58,5) или глюкоза (180).
Дата добавления: 2016-01-26; просмотров: 1552;
