ЭЛЕКТРОННЫЕ ОБОЗНАЧЕНИЯ

Противоположную картину представляет собой атом хлора – его 17 электронов распределены между оболочками следующим образом: 2, 8 и 7. При таком распределении для того, чтобы внешняя оболочка имела 8 электронов, нужно, наоборот, где‑то «добыть» недостающий, восьмой.
Понятно, что с такими потребностями атом натрия и атом хлора имеют прямо противоположные, дополняющие друг друга стремления. Если они случайно столкнутся, атом первого легко отдаст электрон атому последнего, и в результате оба обретут более стабильное состояние. Потеряв электрон, атом натрия потеряет и электрический баланс, ведь теперь отрицательный заряд его электронов окажется недостаточным, чтобы уравновешивать положительный заряд ядра, равный по‑прежнему 11, тогда как суммарный заряд электронов атома теперь равняется всего лишь ‑10. Соответственно, весь атом натрия теперь является носителем общего заряда в +1, превратившись, таким образом, в положительно заряженный ион натрия, Na+.
С другой стороны, атом хлора, получив дополнительный электрон, теперь имеет 18 отрицательно заряженных электронов с суммарным зарядом, соответственно, ‑18, и ядро с положительным зарядом всего 17. Так что общий заряд атома хлора теперь ‑1, и он превратился в отрицательно заряженный ион хлора Сl‑. Так в XX веке, на основании новых представлений о строении атома, был окончательно постигнут механизм формирования ионов, выдвинутый еще в XIX веке как теория, объясняющая функционирование электрической батареи (см. главу 10).
Положительно заряженный ион натрия и отрицательно заряженный ион хлора удерживаются вместе силой электростатического притяжения, существующего между разнонаправленно заряженными частицами, и в результате получается соединение NaCl. Связь, образованная таким образом, называется «ионная связь».
Понятно теперь, почему валентность натрия – 1, ведь у него есть только один электрон, избавившись от которого атом достигнет стабильности в их распределении. И понятно, почему валентность у хлора 1, поскольку для той же самой стабильности ему достаточно получить 1 атом. Вот кальцию и магнию надо будет для того же самого избавиться уже от двух электронов, поэтому и валентность каждого из них равна 2. У кислорода же во внешней оболочке 6 электронов, и для обретения стабильности ему надо присоединить 2, так что его валентность – тоже 2. Если атом кальция отдаст свои два электрона атому кислорода, то и получившийся ион кальция, Са2+, и получившийся ион кислорода, О2‑, обретут стабильное состояние в составе образовавшегося вещества с сильной внутренней ионной связью, СаО (оксид кальция – негашеная известь).
Однако для образования межатомной связи совсем не обязательно, чтобы один атом отдавал свой электрон другому. Вот, например, два атома хлора – что удерживает их вместе? Каждому из них не хватает одного электрона, оба в равной степени склонны к приобретению электронов, и ни один не собирается свой электрон отдавать. В общем, невероятно, чтобы в молекуле, состоящей из двух атомов хлора, один из них вдруг поступился собственным электроном в пользу второго.
Этого и не происходит – вместо этого атомы «по‑братски» формируют общий для них обоих пул электронов. Чтобы показать наглядно, как это происходит, давайте обозначим электроны одного из них как точки, а второго – как крестики. Еще раз повторюсь – это делается исключительно для удобства восприятия и ни в коем случае не должно восприниматься как свидетельство каких‑либо качественных различий между электронами первого и второго атома. Насколько известно, все электроны всех атомов одинаковы. Итак, соединение двух атомов хлора в молекулу хлора можно обозначить так:
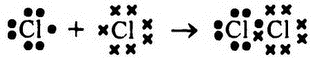
В составе молекулы хлора 2 атома хлора обладают все теми же 14 электронами внешних оболочек в сумме; никаких новых электронов в систему не добавлено. Однако 2 электрона, представленные на схеме, как находящиеся посередине между атомами (один – точкой, а второй – крестиком), одновременно принадлежат внешней оболочке и того и другого атома. Соответственно, во внешней оболочке каждого из атомов находится по 8 электронов, и состояние двухатомной молекулы гораздо стабильнее, чем состояние двух отдельных атомов. И поскольку находиться в двух внешних оболочках одновременно электроны могут только в том случае, когда атомы прижаты друг к другу, то для того, чтобы растащить атомы в стороны, то есть перевести их от более стабильного состояния к менее стабильному, требуется затратить энергию.
Другими словами, формирование молекулярного хлора из атомов хлора сопровождается снижением уровня свободной энергии и является, таким образом, спонтанной реакцией. А разложение молекулы хлора требует увеличения свободной энергии, а значит, спонтанно протекать не может.
Роль связки между атомами выполняет в данном случае пара «общих» электронов. Такая связь называется «ковалентной», и именно такую природу имеет большинство связей в органических соединениях.
Метан (СН4) с электронной точки зрения можно рассматривать как сочетание атома углерода, с его четырьмя электронами во внешней оболочке, с четырьмя атомами водорода, каждый из которых имеет единственный электрон.
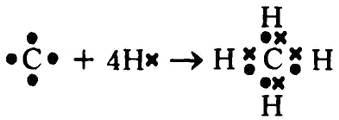
Атом углерода каждый из своих электронов передает в общее пользование с одним из атомов водорода, а каждый из атомов водорода, в свою очередь, тоже предоставляет собственный электрон в общее пользование. В результате каждый атом водорода имеет по два электрона в своей единственной оболочке (которая обретает, таким образом, стабильное состояние), а внешняя оболочка атома углерода тоже получает стабильное число 8.
Правильное «обобществление» внешних электронов позволяет объяснить все факты, ранее объяснявшиеся через систему прямолинейных связей Кекуле, и, более того, через электроны оказалось возможным объяснить некоторые факты, перед которыми изначальная система формул Кекуле оставалась бессильной.
Вот, к примеру, два атома хлора, составляющие молекулу хлора, одинаковые и электроны держат одинаково крепко. Поэтому и «общие» электроны они распределяют между собой поровну. Атомы водорода и углерода тоже удерживают свои атомы с примерно равной силой, так что и в метане «общие» атомы распределены примерно поровну.
А вот в случае ковалентных связей между водородом и кислородом все несколько по‑другому. Атом кислорода с атомом водорода тоже формируют «общую» пару электронов, но при этом атом кислорода, крепче удерживающий свои электроны, будет сильнее перетягивать их в свою собственную внешнюю оболочку, так что оболочке атома водорода электроны будут принадлежать в несколько меньшей степени.
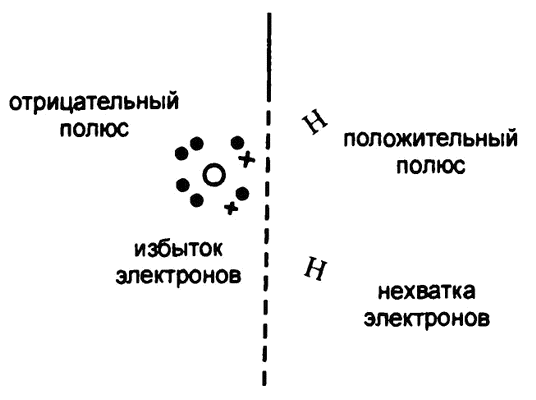
Рис. 27. Поляризованная молекула воды
А раз атом кислорода перетягивает на себя больше половины «общих» электронов, то и отрицательный заряд их большей частью придется на атом кислорода. Соответственно, атом кислорода в целом будет иметь отрицательный электрический заряд дробного значения, а «обделенный» электронами атом водорода – положительный заряд ровно такого же значения.
Соответственно, молекула воды будет обладать небольшим перекосом положительного заряда в сторону водорода и отрицательного – в сторону кислорода, как это показано на рис. 27. Молекулы, в которых наблюдается подобное, называют «полярными», поскольку полюса электрического заряда – водород и кислород – можно рассматривать в них как полюса магнита. А молекулы вроде хлора или метана, где четкой концентрации заряда на конкретных участках не наблюдается, являются «неполярными».
Электрические заряды противоположной направленности двух различных поляризованных молекул будут притягивать друг друга, так же как и противоположно заряженные ионы. Другими словами, молекулы воды в жидком состоянии этого вещества (а во льду – тем более) склонны принимать такое положение, чтобы отрицательно заряженная кислородная часть одной молекулы прилегала к положительно заряженной водородной части молекулы соседней.
Значения зарядов полярных молекул, в которых заряд одного и того же электрона просто оказывается неравномерно распределенным, – гораздо меньше, чем в тех случаях, когда речь идет о полноценной передаче электрона от одного атома к другому. Поэтому и притяжение между полярными молекулами гораздо слабее, чем ионная связь. Эти межмолекулярные притяжения на самом деле в двадцать раз слабее ковалентных связей.
Однако этого оказывается достаточно, чтобы, например, молекулы воды «липли» друг к другу и, соответственно, требовалось гораздо больше энергии на разрыв этих межмолекулярных связей (имеется в виду растапливание льда или выпаривание воды), чем для произведения тех же самых действий в отношении, например, метана.
Поэтому, хотя молекулы метана и воды имеют приблизительно одинаковые размер и сложность строения, температура плавления метана ‑184 °С, а воды – 0°С; а температура кипения этих веществ ‑161°С и +100°С соответственно.
Сильнее всего межмолекулярные силы притяжения проявляются тогда, когда в состав молекулы входит положительно заряженный атом водорода, поскольку его размеры настолько малы (водород – самый маленький атом), что он может ближе всего подойти к атомам с сильным отрицательным зарядом (например, кислороду, азоту или фтору). Поскольку известно, что электростатическое притяжение изменяется обратно пропорционально квадрату расстояния между центрами атомов, то понятно, что чем меньше расстояние, тем больше сила притяжения.
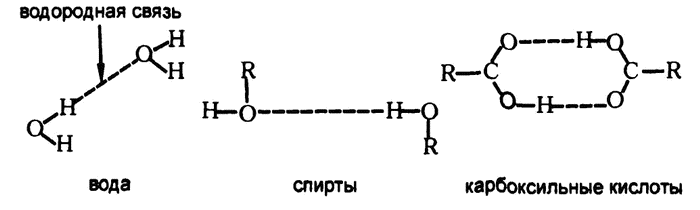
Рис. 28. Водородная связь
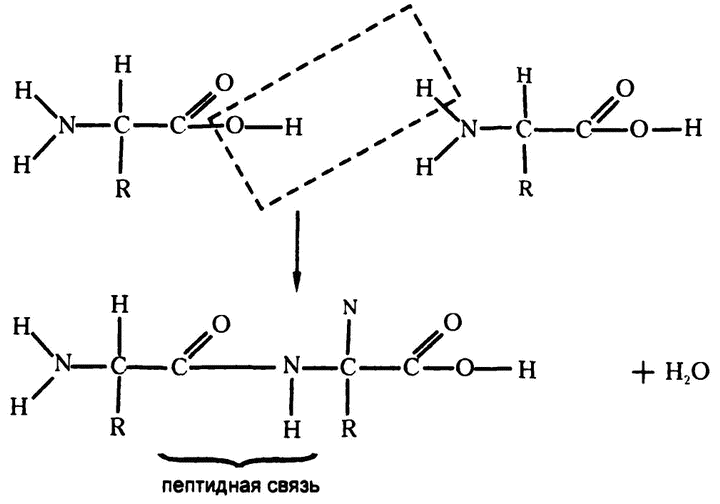
Рис. 29. Соединение аминокислот
Соответственно, достаточно сильными, чтобы вообще оказаться замеченными, силы межмолекулярного притяжения являются только в тех случаях, когда между двумя отрицательно заряженными атомами оказывается атом водорода. Поэтому такая связь получила название «водородная связь» (рис. 28).
Сразу же становится понятно, какое отношение все вышеизложенное имеет к строению белка. Для начала давайте рассмотрим строение аминокислоты в отображении по системе Кекуле:
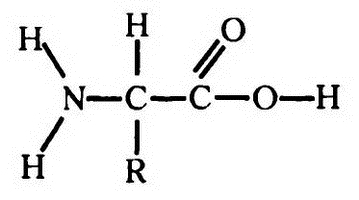
Соединение NH2, изображенное слева, – это аминогруппа; соединение СООН справа – это карбоксильная группа. R, прикрепленное к центральному атому углерода, – это радикал, для каждой конкретной аминокислоты – свой.
Когда соединяются две аминокислоты, то карбоксильная группа одной теряет ОН, а аминогруппа другой – Н. Высвободившиеся части тут же объединяются в молекулу воды. А лишившиеся части атомов аминокислоты тоже объединяются с использованием тех связей, которые освобождаются от ОН и Н соответственно. Этот процесс хорошо показан на рис. 29.
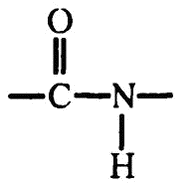
Пептидная связь, соединяющая аминокислоты, имеет, как видите, вот такое строение:
Если представить, что цепочка аминокислот в каком‑то трехмерном пространстве наложится сама на себя, то вполне может возникнуть ситуация, когда водород, крепящийся к азоту одной пептидной связи, окажется по соседству с кислородом, крепящимся к углероду другой пептидной связи. А если атом водорода находится между атомами азота и кислорода – то мы имеем идеальные условия для возникновения водородной связи. Один из вариантов такой ситуации изображен на рис. 30, и, как видите, при нем вполне воспроизводится ситуация, продемонстрированная на рис. 25. Водородная связь и есть та «слабая связь», о которой я упоминал.
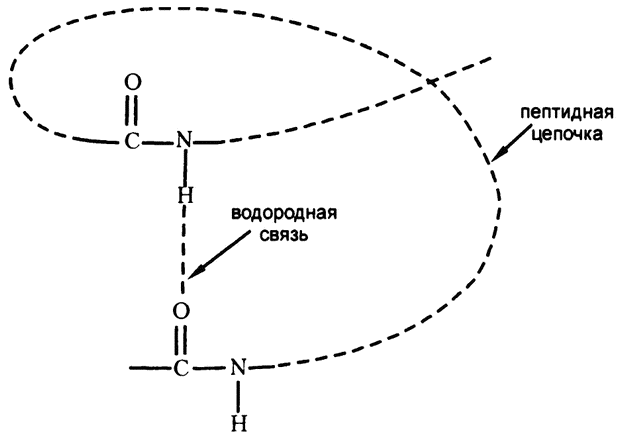
Рис. 30. Водородная связь и пептидная цепочка
В 1936 году американские биохимики Лайнус Полинг и А.Е. Мирски предположили, что именно присутствие в молекуле белка водородных связей делает ее столь хрупкой. Получается, что за особые свойства белка отвечает не только схема аминокислотной цепочки (какие именно аминокислоты и в каком порядке представлены), но и ее трехмерная структура, определяемая водородными связями.
На прочные ковалентные связи, которыми скреплена пептидная цепочка, легкое нагревание действия не окажет, но вот водородные связи, которые в двадцать раз слабее, вполне может разорвать. Из «правильно сложенной» аминокислотная цепочка превращается в таком случае в «свободно болтающуюся», и в результате мы имеем денатурированный белок, утративший свойства белка природного.
Но для того, чтобы понять, как именно должна быть «сложена» аминокислотная цепочка, надо сперва уяснить геометрию молекулы вообще. Насколько удалены друг от друга атомы в молекуле? Какие положения относительно друг друга они занимают? Иными словами – насколько длинными являются межатомные связи и под какими углами друг к другу они расходятся? Можно написать на бумаге двухмерную структурную формулу, но ведь на самом деле структура молекул трехмерна!
Ответ на эти вопросы пришел только с использованием рентгеновских лучей. Если направить пучок рентгеновских лучей на кристалл какого‑либо вещества, то упорядоченные слои атомов, составляющие кристалл, частично отразят их. По результатам анализа этого отражения и можно подсчитать расстояние между похожими атомами в структуре кристалла. А там недалеко уже до того, чтобы вывести и саму структуру кристалла.
Этот метод основан на том факте, что облучаемый рентгеновскими лучами объект состоит из упорядочение расположенных атомов. В начале 20‑х годов XX века было проведено исследование волокон шелка с помощью рентгеновских лучей. Шелк, разумеется, не кристалл, но и строение его аминокислотных цепочек оказалось в достаточной степени упорядоченным, чтобы произвести соответствующее отражение лучей. Полученные данные позволили показать, к примеру, что длина одной аминокислотной составляющей пептидной цепочки – 0,35 миллимикрона. Отсюда стало возможно высчитать и длину отдельных связей и углы между ними. Затем в 30‑х годах XX века с помощью той же технологии были исследованы и другие белки, например содержащийся в волосах кератин.
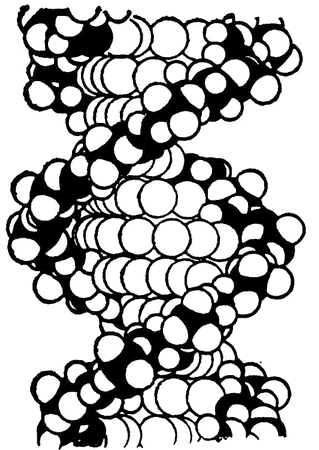
Рис. 31. Спиралевидная молекула
В начале 50‑х годов Полинг с коллегами показали на основании полученных данных, что пептидные цепочки могут сворачиваться в спираль (похожую на спираль винтовой лестницы), не теряя при этом ни одной из своих естественных связей. Спиралевидная форма предоставляет прекрасные возможности для образования водородных связей. Более того, несколько таких спиралей могут и сами сворачиваться в спираль (так же, как канат может состоять из нескольких волокон, скрученных таким же образом, как и он сам, из других, более тонких, волокон), и в этом случае опять же вся структура удерживается в нужной форме с помощью водородных связей (рис. 31).
Эта гипотеза нашла экспериментальное подтверждение, и сейчас представление о спиралевидном строении белковых молекул является общепринятым.
Глава 18.
Дата добавления: 2016-01-26; просмотров: 2072;
