НЕОБХОДИМЫЕ АМИНОКИСЛОТЫ
Аминокислота … Ежедневная норма (г)
Фенилаланин … 1,1
Метионин … 1,1
Лейцин … 1д
Лизин … 0,8
Валин … 0,8
Изолейцин … 0,7
Треонин … 0,5
Триптофан … 0,25
Таким образом, часть аминокислот можно исключить из пищи и организм сам будет синтезировать их в достаточном количестве.
С другой стороны, если исключался из диеты, например, лизин, то у обследуемого тут же фиксировался отрицательный азотный баланс. Лизин необходимо получать с пищей; организм явно не умеет производить его самостоятельно, независимо от наличия в нем других аминокислот. Поэтому лизин входит в число «необходимых» аминокислот.
Роуз установил, что «необходимых» аминокислот, то есть таких, которые организм должен получать с пищей, – всего восемь, и подсчитал минимальную ежедневную норму потребления каждой из них, при которой в организме не наблюдается отрицательного азотного баланса и расщепления собственных тканей. Аминокислоты и их ежедневная норма потребления приведены в таблице 8.
Таков еще один пример ограничений, налагаемых природой на гибкость химических процессов живого организма, помимо невозможности производить витамины. Витаминов достаточно потреблять в день по нескольку миллиграммов, а вот аминокислоты необходимо получать в количествах, превышающих аналогичные цифры для витаминов в сотни и даже тысячи раз.
Глава 20.
ЖИЗНЬ БЕЗ ВОЗДУХА
Как видите, многое о процессах, происходящих в живой ткани, можно сказать на одной лишь основе рассмотрения веществ, которые мы имеем на входе в организм и на выходе из него. Мы решили, что должен существовать некий общий строительный «кирпичик», из которого создаются и белки, и жиры, и углеводы. Мы пришли к выводу, что все структурные единицы пищи – глюкоза, жирные кислоты, аминокислоты и прочие – либо катаболизируются на углекислый газ и воду, либо анаболизируются в крахмал, белки или жиры. Мы даже установили, что одни вещества, такие как аланин, вырабатываются организмом самостоятельно, а другие, такие как лизин, – нет.
Это все, до чего мы могли додуматься, или есть еще резервы?
Ну, например, мы можем воспроизвести такое умозаключение: фермент может катализировать реакцию только в точке равновесия, причем не важно, с какой стороны идет реакция (см. главу 12). Следовательно, когда сложные вещества, поступающие с пищей, подвергаются гидролизу с помощью пищеварительных ферментов, то это тоже происходит в точке равновесия реакции. И известно, что гидролиз проходит полностью, поскольку практически все содержащиеся в пище сложные вещества в итоге оказываются гидролизованными и впитываются организмом.
Впитываются! По мере впитывания организмом аминокислоты жирные кислоты и простые сахара исчезают со сцены. Остаются только сложные вещества. Они тоже распадаются и так далее. Иными словами, соблюдается закон действия масс (см. главу 9) – путем удаления конечных продуктов точка равновесия сдвигается все дальше в сторону гидролиза.
Позволяют ли нам эти данные выдвинуть какие‑то предположения о происходящем в клетках? Внутри тканей присутствуют только продукты гидролиза, так что можно представить те же самые ферменты катализирующими обратную реакцию в той же самой точке равновесия. Вместо разрыва связей путем добавления воды, от одной из аминокислот, скажем, отнимается атом водорода, а от другой – соединение атома водорода с атомом кислорода, тогда у обеих аминокислот освобождается по одной возможности для образования пептидной связи (см. формулу после рис. 29). Такой «антигидролиз» называют «конденсацией». Если конечные продукты этой реакции (белок и воду в данном случае) удалять из клетки с той же скоростью, с какой они образуются, то реакция конденсации может идти сколько угодно, вплоть до полной обработки всех имеющихся веществ.
Картинка, при которой одни и те же ферменты управляют процессами как анаболизма, так и катаболизма, в зависимости от того, какие именно вещества удаляются с места прохождения реакции, конечно, выглядит красиво. Но насколько она соответствует реальности?
В частности, в пользу этого предположения свидетельствует тот факт, что в лабораторных условиях пищеварительные ферменты можно заставить катализировать анаболитические реакции. К примеру, если аминокислоты подвергнуть при соответствующих условиях воздействию пепсина или химотрипсина, то действительно, происходит некий синтез, и в итоге получается нерастворимое белкообразное вещество пластеин. Пластеин – это смесь пептидов с малой молекулярной массой, цепочки которых состоят не более чем из десяти–двенадцати аминокислот; но вполне вероятно, что внутри живых тканей условия для формирования белков более благоприятны, чем в лабораторной пробирке, и там могут создаваться более крупные и сложные белки.
Но, увы, в целом теория имеет и ряд серьезных недостатков. Во‑первых, пищеварительные ферменты в живых тканях никогда не встречаются. Какая разница, может пепсин или химотрипсин способствовать формированию белка или нет, если и тот и другой все равно отсутствуют в клетках, где это формирование происходит?
И опять же, нельзя забывать о свободной энергии. В целом реакции катаболизма сопровождаются снижением ее уровня. В случае гидролиза это снижение невелико по сравнению с другими видами реакций катаболизма, о которых чуть позже, но все же достаточно велико в целом. При гидролизе пептидной связи свободная энергия уменьшается на величину от 0,5 до 4 килокалорий на моль вещества, в зависимости от того, какие именно аминокислоты были задействованы в разорванной связи.
Это означает, что гидролиз белка – реакция, направленная «вниз с холма», и точка равновесия при ней сильно смещена в сторону полного гидролиза. Уровень свободной энергии снижается достаточно сильно, чтобы обратимость реакции не оказывалась ярко выраженной. На самом деле в точке равновесия подвергнувшимися гидролизу оказывается около 99 процентов белков.
Это не означает, что реакцию совсем нельзя обратить – надо просто создать для этого правильные условия. В лабораторной пробирке обеспечивается удаление воды сразу же по мере ее формирования (вода является одним из продуктов реакции конденсации). Соответственно, реакция сдвигается в сторону белка и идет производство пластеина. Однако в живой клетке образующаяся в большом количестве вода не может удаляться с нужной скоростью, и удалять с такой скоростью образующийся белок тоже сложно. Так что, если описанный путь – единственно возможный, значит, надо искать, как организм решает задачу быстрого удаления из клетки образующихся веществ. Вообще‑то живая ткань преподносит много сюрпризов, и вполне возможно, что данная задача тоже нашла у природы какое‑то оригинальное решение. Но все же, может быть, в живой ткани происходит не простое «обращение реакции», а какой‑то иной процесс?
Что ж, если при реакции катаболизма уровень свободной энергии, как правило, снижается, то при имеющей обратную направленность реакции анаболизма он должен повышаться. Вместо того чтобы с безумной скоростью удалять продукты и клетки для того, чтобы сдвинуть точку равновесия ради протекания реакции в обратном направлении, не проще ли напрямую затратить на осуществление реакции немного энергии? В этом случае реакция пойдет куда надо, в зависимости не от состава веществ в клетке, а от приложения энергии. Не поступает энергия – идет реакция катаболизма; подали энергию – идет реакция анаболизма.
Откуда же возьмется в таком случае энергия? Самый простой ответ – из дальнейшего катаболизма структурных единиц. Из превращения глюкозы в углекислоту и воду можно получить на единицу веса в сотни раз больше энергии, чем из гидролиза гликогена на глюкозу (и, соответственно, чем требуется для конденсации глюкозы в гликоген). Следовательно, пожертвовав на катаболизм одной молекулой глюкозы, можно добиться соединения сотни других молекул глюкозы в гликоген.
Хорошо, но каков же тогда конкретный механизм, перевода энергии катаболизма на полезные цели – на проведение энергоемких реакций анаболизма? Чтобы ответить на этот вопрос, надо сначала подробно рассмотреть катаболизм. Никуда теперь от этого не деться. Необходимо понять, что происходит с питательными веществами после того, как их структурные единицы впитываются клетками. Пора проникнуть в тайны промежуточного метаболизма.
Одним из видов катаболизма, интересовавшим ученых с давних пор и послужившим исходной точкой для исследования промежуточного метаболизма, является факт ферментации глюкозы дрожжами. Во‑первых, ферментация дрожжами Сахаров всегда, начиная с доисторических времен, имела для человечества большое практическое значение, так что мотивация для изучения этого явления была вполне достаточной. А во‑вторых, дрожжевая ферментация – все же достаточно простое явление, которое можно изучать, не сталкиваясь с теми осложнениями, которые возникают при рассмотрении тканей животных. Ферментирующее действие дрожжей приводит к распаду глюкозы на этиловый спирт с высвобождением углекислого газа, так что выражение для этого процесса можно записать так:
С6Н12O6 → 2С2H6O + 2CO2.
Обратите внимание – это выражение уравновешено! Каждая молекула глюкозы в процессе катаболизма распадается на две молекулы этилового спирта и две молекулы углекислого газа. Больше ничего.
Это кажется удивительным. После того как Лавуазье продемонстрировал, что животные не могут существовать без кислорода, казалось естественным, что при всех важных реакциях катаболизма должен быть как‑то задействован и кислород. Однако здесь его нет.
А в других реакциях, происходящих с участием дрожжей? И на этот вопрос был дан отрицательный ответ. Такой приговор вынес Луи Пастер в 1861 году – он показал, что все без исключения процессы жизнедеятельности дрожжей проходят при полном отсутствии кислорода. Он назвал это «la vie sans air» – «жизнь без воздуха».
Превращение глюкозы в этиловый спирт и углекислый газ – пример «гликолиза» (что по‑гречески значит «расщепление сахара»), а для подчеркивания того факта, что этот процесс проходит «без воздуха», его часто называют еще «анаэробным гликолизом», где «анаэробный» по‑гречески и означает «без воздуха».
Начиная с наблюдений за горящим топливом весь опыт человечества говорит о том, что получение энергии связано с соединением углесодержащих веществ с кислородом, но не будем же слишком строги в этом отношении. Энергию можно производить и другими способами.
При расщеплении одного моля глюкозы на этиловый спирт и углекислый газ высвобождается около 36 килокалорий свободной энергии. Это, конечно, гораздо меньше, чем можно было бы получить путем полного превращения этого же количества глюкозы в воду и углекислый газ; в последнем случае изменение уровня свободной энергии составило бы 686 килокалорий, так что при гликолизе производство энергии составляет лишь двадцатую часть от возможного. Однако для жизнедеятельности дрожжей этого оказывается достаточно.
Более того, вполне вероятно, что когда‑то давным‑давно никакого кислорода в атмосфере Земли не было, так что единственными способами выработки энергии для тогдашних живых существ были методы, родственные гликолизу. Даже сегодня сложные организмы, обычно получающие энергию за счет катаболизма глюкозы до уровня воды и углекислого газа с потреблением кислорода, при особых обстоятельствах могут временно переключиться и на гликолиз.
В качестве примера можно назвать мышечную ткань. В начале XX века было обнаружено, что мышцы содержат в небольшом количестве молочную кислоту, трехуглеродное соединение с эмпирической формулой С3H6O3. (Раньше это вещество обнаруживали только в прокисшем молоке, отсюда и название.) Выяснилось также, что в процессе работы мышц содержание молочной кислоты в них повышается.
В 1918 году немецкий биохимик Отто Майерхоф показал, что повышение содержания в мышцах молочной кислоты сопровождается снижением содержания в них гликогена. Казалось очевидным, что мышечная деятельность подразумевает расщепление гликогена на глюкозу и превращение последней в молочную кислоту. Реакцию перевода глюкозы в молочную кислоту можно записать так:
С6Н12О6 → 2С3H6O3.
И снова перед нами уравновешенное выражение. Одна молекула глюкозы расщепляется на две молекулы молочной кислоты без какого‑либо участия кислорода. Наверное, именно эта или очень похожая реакция происходит и при прокисании молока, когда попавшие в него бактерии превращают молочный сахар в лактозу. Результат, получаемый в мышцах или в прокисшем молоке, отличается от результата, получаемого в дрожжах, поскольку в последнем случае молочная кислота продолжает расщепляться дальше:
С3Н6О3 → С2Н6О + СО2,
то есть на этиловый спирт и углекислый газ. Однако с точки зрения энергетики это маловажная деталь, поскольку на этом дополнительном шаге не вырабатывается какого‑либо существенного объема энергии.
Хорошо, что этого не происходит в мышцах. Спирт – гораздо более ядовитое вещество, чем молочная кислота, и его присутствие в клетке было бы гораздо опаснее. Дрожжи могут себе позволить вырабатывать спирт, ведь они выбрасывают его в окружающую среду; но даже при этом они умирают, когда концентрация спирта в окружающей среде достигает около 18 процентов. А мышцам пришлось бы выбрасывать спирт в кровь, так что организм очень быстро опьянел бы и умер. В принципе, наверное, и приспособиться к высокой концентрации спирта в крови организм мог бы, но этого не произошло. Очевидно, более выгодным в процессе эволюции многоклеточных оказалось избавиться от завершающего этапа гликолиза, чем вводить механизмы ликвидации его последствий.
Майерхоф не просто показал, что сложные организмы способны проводить анаэробный гликолиз, несмотря на то что, как правило, они пользуются более эффективными реакциями с задействованием кислорода. Он обнаружил также, что и дрожжи, и мышцы пользуются при этом одними и теми же коферментами. Стало ясно, что и глюкоза в клетках обоих видов расщепляется с помощью сходных реакций. Так постепенно становилось ясно, что метаболические механизмы всех живых существ в принципе сходны и различия между ними не так уж существенны. Все проводимые со времен Майерхофа исследования только подтверждают эту точку зрения.
Легко понять, зачем мышцам нужна способность к гликолизу. Конечно, мышцы могут получить из глюкозы гораздо больше энергии путем полного расщепления ее на воду и углекислый газ – так они и делают в условиях отсутствия особой нагрузки. Однако для этого им, естественно, необходим кислород. Он попадает в мышцы с потоками крови, и если бы вся требуемая мышцам энергия могла вырабатываться только путем «правильного» полного расщепления, то их работоспособность была бы ограничена скоростью поступления кислорода.
Когда мышцы начинают расходовать больше энергии (например, при занятиях спортом), организм начинает ускорять кровоток. Человек принимается глубже и чаще дышать, сердце бьется чаще и сильнее. Естественно, скорость поступления в мышцы кислорода тоже повышается, и в них начинает вырабатываться больше энергии. Однако скорость дыхания и сердцебиения не может возрастать безгранично. А вдруг мышцам требуется еще больше энергии, чем они могут произвести с использованием всего поступающего объема кислорода, пусть и увеличенного?
«Ничего не получится» – теоретически вполне допустимый с научной точки зрения ответ, но на самом деле это не так. Эволюция всегда приводит к распространению механизмов, позволяющих их носителям хоть чуть‑чуть, да опередить конкурентов. Так что с точки зрения выживаемости мышцам оказалось «выгодно» сохранить устаревшую способность к анаэробному гликолизу, ведь она позволяет вырабатывать «еще чуть‑чуть» энергии дополнительно к получаемой с помощью кислородозависимых реакций.
Конечно, это неэффективный способ. Для того чтобы добиться того же эффекта, что при расщеплении одной молекулы глюкозы на воду и углекислоту, путем расщепления той же глюкозы на молочную кислоту, нужно потратить девятнадцать молекул против одной. Но в случае необходимости лучше неэффективно растратить запас глюкозы, чем оказаться в ситуации, когда какого‑то мизерного количества энергии не хватает, чтобы спасти, скажем, собственную жизнь.
Этот процесс тоже имеет свои ограничения. Молочная кислота накапливается в мышцах по мере их работы, и, хотя она и не столь токсична, как спирт, все же и ее присутствие можно терпеть лишь до определенной концентрации. В мышцах, находящихся в состоянии покоя, концентрация молочной кислоты – 0,02 процента. В процессе работы она может доходить до 0,25 процента, но не более. Мы ощущаем возрастание молочной кислоты как один из признаков усталости, и в итоге любая мышца, как ее ни стимулируй, должна прекратить свою деятельность. Она не выдержит большего количества молочной кислоты.
Что же далее происходит с молочной кислотой? Ведь в процессе отдыха мышца должна, очевидно, восстановиться? Британский физиолог Арчибалд Вивиен Хилл показал, что после насыщения молочной кислотой мышца начинает больше обычного потреблять кислород. Такое ощущение, что кислород, которого так не хватало для сжигания глюкозы во время работы, теперь стремится наверстать упущенное. Получается нечто вроде возмещения «кислородного долга», и именно благодаря этому мы еще долго продолжаем тяжело дышать, а наше сердце – усиленно биться уже после того, как работа завершена. Теперь кислород необходим нашим тканям уже не для совершения работы, а в качестве «возмещения долга».
Химически это «возмещение долга» выражается в расщеплении молочной кислоты на воду и углекислоту. При этом вырабатываются те самые оставшиеся восемнадцать девятнадцатых энергии, потенциально скрытые в расщеплении глюкозы:
2С3H6O3 + 6O2 → 6СO2 + 6H2O
ΔF = ‑650 ккал.
При этом вырабатывается гораздо больше энергии, чем, требуется для того, чтобы снова собрать из двух (Молекул молочной кислоты молекулу глюкозы:
2C3H6O3 → C6H12O6
ΔF = +36 ккал.
Если предположить, что вырабатываемую при катаболизме молочной кислоты энергию можно пустить на формирование глюкозы из других молекул молочной кислоты, то понятно, что катаболизма одной молекулы молочной кислоты хватит для анаболизма множества других молекул. Даже если эффективность передачи энергии при этом будет составлять процентов 50, все равно достаточно расщепить на воду и углекислоту одну молекулу молочной кислоты, чтобы десять других объединить в молекулы глюкозы.
В итоге, когда «кислородная задолженность» ликвидирована, большинство молекул молочной кислоты снова оказываются в составе гликогена, наготове для следующего этапа работы, а потери гликогеновых запасов компенсируются бесконечным притоком глюкозы из печени.
Катаболизм молочной кислоты, благодаря которому становится возможным анаболизм других ее же молекул, является примером «парной реакции» (рис. 44). В целом реакция сопровождается снижением уровня свободной энергии. То есть, несмотря на то что при формировании глюкозы из молочной кислоты уровень свободной энергии повышается, это происходит не иначе как в ответ на распад молочной кислоты на углекислоту и воду, а при этом процессе уровень свободной энергии снижается, причем общая величина снижения за счет реакций второго типа – больше, чем общая величина повышения за счет реакций первого типа, так что в целом мы наблюдаем снижение, как и всегда при любых других проявлениях жизнедеятельности.
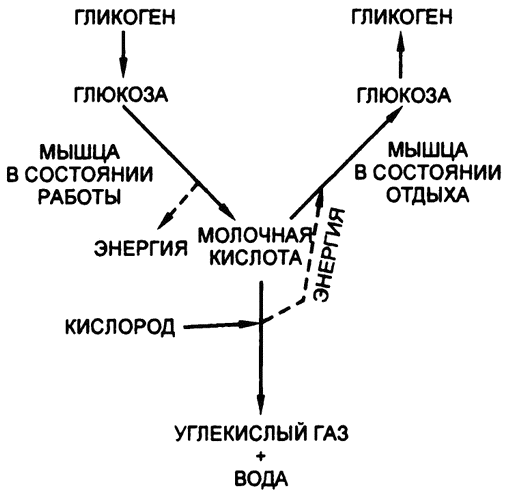
Рис. 44. Молочная кислота в мышцах
Легко говорить о парности реакций катаболизма и анаболизма молочной кислоты, но как именно такая парность обеспечивается? Каким образом энергия, вырабатываемая при одной реакции, передается другой?
Первая подсказка была получена в 1905 году. Английские химики Харден и Янг (те самые первооткрыватели зимазы) обнаружили, что если скорость производства дрожжами углекислого газа падает, то ее можно вернуть на прежний уровень, если добавить в дрожжи неорганический фосфат (примером такого вещества может служить фосфат калиевой кислоты, КН2РO4). Более того, по мере выработки углекислого газа количество фосфата в растворе уменьшалось!
Харден и Янг решили, что единственное, куда мог деваться фосфат, – это соединяться с каким‑то органическим веществом. В этом случае он действительно перестал бы встречаться в виде простого иона и, соответственно, реагировать с тестовым реагентом. Ученые принялись анализировать смесь на предмет наличия в небольших количествах какого‑нибудь органического вещества с содержанием фосфатной группы – и нашли такое вещество! Фосфатная группа оказалась связанной с молекулой сахара с помощью некоей связи, характерной для подобных соединений, именуемых «эфирами». Соответственно, данное вещество получило название «эфир Хардена–Янга». Со временем было установлено и точное строение этого вещества; оказалось, что это простой сахар, фруктоза, к которому крепятся две фосфатные группы. Теперь его так и называют – фруктозодифосфат.
Фруктозодифосфат является примером «метаболического посредника», вещества, встречающегося в схеме обмена веществ где‑то посередине между известным исходным веществом (в данном случае это глюкоза) и легко определяемым итоговым веществом (в данном случае это этиловый спирт и углекислота). Определение и установление метаболических посредников крайне важно для правильного понимания процессов обмена веществ, происходящих в живой ткани, так что можно сказать, что с 1905 года начался отсчет систематического изучения метаболических посредников.
Вскоре были обнаружены и другие органические фосфаты, и, ко всеобщему изумлению, стало ясно, что именно фосфатные группы имеют непосредственное отношение практически к каждому шагу метаболизма. Ранее считалось, что фосфатные группы в живых организмах встречаются только в костях как часть неорганического скелета, а об их присутствии в большом количестве в мягких тканях по большей части не подозревали, а если ученые их там и обнаруживали, то не придавали этому факту особого значения. Теперь же фосфаты вдруг оказались в центре всеобщего внимания, поэтому и нам не грех будет посвятить им целую главу.
Глава 21.
ЗНАЧЕНИЕ ФОСФАТОВ
Перед тем как обсуждать связь между фосфатными группами и метаболизмом, надо сначала немного поговорить о самом фосфоре.
В таблице Менделеева фосфор находится сразу же под азотом, что свидетельствует о сходстве атомного строения этих двух элементов. У атома азота две электронные оболочки, во внешней из них находится пять электронов, а у атома фосфора – три оболочки, во внешней из которых тоже находится пять электронов. Соответственно, в электронном изображении фосфор можно представить как

то есть точно так же, как и азот.
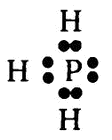
Атом фосфора может принимать в совместное пользование три электрона других атомов, предоставляя при этом в совместное пользование и три своих, так чтобы в целом достигать стабильного числа восемь. Так, например, с водородом фосфор образует соединение (фосфин, РН3) таким образом:
Точно так же образуется и аммиак (см. главу 17).
Кроме трех электронов, которые фосфор может предоставлять в совместное пользование, у него есть еще два, которые он никуда предоставлять не собирается (к примеру, в фосфине они остаются в полном распоряжении фосфора). Однако эти два электрона вполне могут быть предоставлены в пользование атому, которому только их и не хватает для обретения заветных восьми электронов во внешней оболочке. Естественно, первым из такого рода атомов нам приходит в голову кислород, во внешней оболочке которого всего шесть атомов.
Если сосредоточиться только на фосфоре и кислороде, то можно представить «разделяемые» его атомы как «просто связи» и рассматривать только «неразделяемые», таким вот образом:
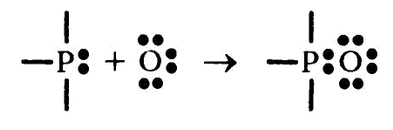
Как видите, теперь потребность атома кислорода в восьми электронах удовлетворена без каких‑либо потерь для фосфора, который также сохраняет эти электроны в своей внешней оболочке.
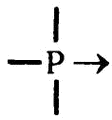
Связь, образуемая подобным образом – когда оба электрона предоставляются одним и тем же атомом, – так же сильна, как и образуемая обычным способом, когда каждый атом предоставляет по одному электрону для образования пары. В химии она именуется «координационной связью», и ее часто изображают на схемах в виде маленькой стрелочки, указывающей от того атома, который предоставляет электроны, на тот, который их принимает. Таким образом, фосфор имеет три ковалентных и одну координационную связь, что можно изобразить так:
Зачастую, как в случае с фосфином, задействованными оказываются только три ковалентные связи. Однако, особенно в тех случаях, когда речь заходит об атомах кислорода, для координационной связи тоже находится работа[7]. Кстати, все вышесказанное в равной степени относится и к атомам азота.
Самым важным фосфорсодержащим соединением является ортофосфорная кислота, которую часто называют просто «фосфорной кислотой» (Н3РO4), в которой всеми четырьмя связями фосфор соединен с атомами кислорода. Ее можно представить таким образом:
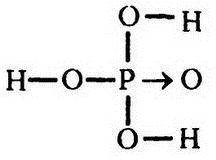
Где бы в живой ткани ни появлялся атом фосфора, он всегда оказывается входящим в состав соединения, родственного фосфорной кислоте. К примеру, фосфорная кислота может ионизироваться, сначала за счет ионизации одного атома водорода (Н+), в результате чего получается «первичный фосфат‑ион» Н2РО4‑, с отрицательным зарядом ‑1, а затем – второго и третьего атомов водорода с образованием вторичного и третичного фосфат‑ионов: НРО42‑ и РО43‑. Первые два из этих ионов обнаруживаются и в крови, и в тканях.
Кроме того, фосфорная кислота или получаемые из нее ионы могут вступать в соединение с другими веществами. В таких соединениях участвуют (иногда и более одной) гидроксильные (содержащие и водород, и кислород) группы, присутствующие в молекуле. Мы сосредоточимся именно на этой части молекулы фосфорной кислоты и, краткости и удобства ради, обозначим оставшуюся часть как (P). В таком виде краткая запись молекулы фосфорной кислоты будет выглядеть как Н – О – (P). В тех случаях, когда речь будет идти более чем об одной гидроксильной группе, к центральной (P) будут обозначены присоединенными вторая и третья гидроксильные группы.
При вступлении в соединение фосфорная кислота или ее ионы обычно непосредственно соединяются с гидроксильной группой другого вещества, что можно изобразить так: R – О – Н, где R – любая углеродосодержащая группа. Таким образом, запись R – О – Н может обозначать и спирт, и сахар или другие соединения, о которых мы не упоминали, – в общем, любое вещество, в состав которого входит гидроксильная группа.
Таким образом, реакцию фосфорной кислоты, скажем, с сахаром можно представить на рис. 45. В процессе присоединения отщепляется молекула воды, то есть мы имеем дело с реакцией конденсации, значит, реакцию обратную данной следует признать реакцией гидролиза.
Обычно уменьшение свободной энергии связано именно с гидролизом, так что точка равновесия данной реакции смещена далеко в сторону смеси сахара и фосфорной кислоты. При гидролизе сахарофосфата (примером такого вещества является упомянутый в предыдущей главе эфир Хардена–Янга) высвобождается от 2 до 4 килокалорий на моль вещества, в зависимости от конкретного вещества. То есть при гидролизе эфирной связи сахарофосфата высвобождается примерно столько же свободной энергии, сколько и при гидролизе пептидной связи белковой молекулы.
Естественно, для того, чтобы сформировать эфир путем конденсации сахара и фосфорной кислоты, необходимо затратить те же 2–4 килокалории на моль. Значит, чтобы создать такого рода эфирную связь, надо потратить столько же энергии, сколько на создание пептидной связи.

Рис. 45. Фосфорная кислота и сахар
Поскольку фосфорная кислота обладает гидроксильной группой, то одна молекула фосфорной кислоты вполне может конденсироваться и с другой такой же молекулой. В результате получается сочетание атомов типа – О – (|3), «пирофосфатная связь».
Конденсированные кислоты, приведенные на рис. 46, оставались бы вне поля зрения органической химии, если бы не тот факт, что в 1929 году немецкий биохимик К. Лохманн сумел выделить из мышц вещество, оказавшееся продуктом конденсации трифосфорной кислоты с органическим веществом аденозином, встречающимся в составе нуклеиновых кислот[8]. Соответственно, продукт конденсации получил название «аденозинтрифосфат».
Постепенно обнаруживалось участие аденозинтрифосфатов (теперь их принято обозначать общеизвестным уже сокращением АТФ) в различных реакциях, протекающих в организме. Они участвуют в процессе сокращения мышц; в передаче нервных сигналов; практически во всех стадиях обмена веществ.
Почему? Ну, начать хотя бы с того, что две фосфатные группы на удаленном от аденозина конце молекулы легче подвергаются гидролизу, чем фосфатные связи в целом. Это свидетельствует о том, что при гидролизе пирофосфатной связи уровень свободной энергии уменьшается сильнее, чем при гидролизе обычной фосфатной связи. Исследования подтвердили это предположение. Фриц Липман, американский физик немецкого происхождения, предположил по результатам своих исследований начала 40‑х годов XX века, что существуют два типа фосфатных связей – обычные фосфатные связи, как в сахарофосфате, «низкоэнергетические», и «высокоэнергетические», примером которых является пирофосфатная связь.
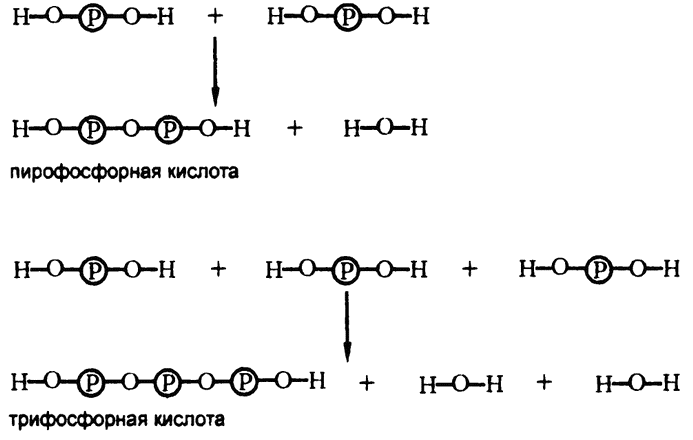
Рис. 46. Пирофосфатная связь
Сперва выяснилось, что при гидролизе высокоэнергетической фосфатной связи высвобождается от 11 до 16 килокалорий энергии на моль вещества, просто колоссальная цифра по сравнению с двумя–четырьмя килокалориями на моль, высвобождаемыми при гидролизе обычной фосфатной связи. Однако дальнейшие исследования показали, что эта цифра завышена. В 50‑х годах XX века уточненные исследования показали, что в среднем при гидролизе высокоэнергетических фосфатных связей высвобождается от 5 до 10 килокалорий, в среднем – 8. А при гидролизе некоторых фосфатных связей, которые принято было считать низкоэнергетическими, могло высвобождаться и до 6 килокалорий на моль. Получается, никакого строгого разрыва между этими двумя группами нет вообще.
Но все же остается признать, что существует один тип фосфатных связей, при гидролизе которых выделяется в среднем 8 килокалорий на моль вещества, и другой, при гидролизе связей которого выделяется в среднем 4 килокалории на моль. Хотя различие между ними не так велико, как показалось сначала, и некоторые биохимики уже начинают колебаться, есть ли оно вообще, я все же считаю оправданным разделение фосфатных связей на высоко‑ и низкоэнергетические.
Многие биохимики по привычке разделяют высоко‑ и низкоэнергетические фосфатные связи графическим обозначением валентной связи в формуле. Низкоэнергетическая связь обозначается обычным образом R – О – (P), а высокоэнергетическая фосфатная связь – волнистой линией. Так, обозначив АТФ за А, можно представить формулу таким образом:

Последние две связи, как видите, – пирофосфатные и высокоэнергетические. Если одну из них разорвать посредством гидролиза, то останется «аденозиндифосфат», или АДФ, формула которого выглядит как А – О – (P) – О – (P). Если разорвать еще одну, то останется «аденозинмонофосфат», или АМФ (он же «адениловая кислота»), формула которого А – О – (P). Теперь осталась только низкоэнергетическая фосфатная связь. Ее тоже можно разорвать с помощью гидролиза, так чтобы остался только аденозин, но энергии при этом третьем по счету гидролизе выделится немного – в два раза меньше, чем в любом из предыдущих случаев.
Помимо иирофосфатной, существуют и другие высокоэнергетические фосфатные связи. Возьмем органическую кислоту в общем случае (общую формулу можно записать так:
где R – любое из бесчисленного множества углеродсодержащих соединений, а СООН – «карбоксильная группа»), с которой мы уже не раз встречались.
Если фосфорная кислота конденсируется с гидроксильной частью карбоксильной группы (как на прилагаемой диаграмме), то в результате получается «ацилфосфат», изображаемый с волнистой связью, чтобы подчеркнуть ее высокую энергию (рис. 47).
Теперь давайте посмотрим, как высокоэнергетическая связь вступает в игру. Для этого вернемся к гликогену. Гликоген, содержащийся в печени и мышцах животных, в подробностях строения не совсем похож на крахмал, хранящийся в «запасниках» растений, но и гликоген, и крахмал формируются из молекул глюкозы, которые конденсируются с выделением при этом воды. Когда крахмал расщепляется в пищеварительном канале, амилазы катализируют процесс гидролиза единиц глюкозы на отдельные молекулы, добавляя воду обратно и разбивают крахмал на все более короткие цепочки, пока не получаются снова отдельные молекулы глюкозы.
И печень, и мышцы тоже должны уметь расщеплять гликоген на отдельные молекулы глюкозы, чтобы поддерживать должный ее уровень в крови. Так что логично предположить, что в тканях тоже работает некий фермент, подобный амилазам, который выполняет сходную работу – катализирует гидролиз.
Для проверки этого предположения необходимо было придумать такой эксперимент, который позволил бы понять, какие именно реакции происходят в живых тканях. Проще всего было бы сделать это, выбрав в качестве живой пробирки какое‑нибудь подходящее животное вроде мыши. К сожалению, даже мышь – слишком сложное для такой задачи существо, в ее организме одномоментно проходят тысячи реакций.
Поэтому для упрощения задачи мышь придется убить и взять для исследования крошечные кусочки ее печени и мышц. Если правильно извлечь эти ткани и быстро подвергнуть обследованию, можно застать в образцах ферменты в работоспособном состоянии. Такие образцы помещали в растворы различных химических веществ. Действие ферментов настолько специфично, что если та или иная ткань катализирует определенную реакцию в лабораторных условиях, то вполне вероятно, что и в живом организме она катализирует ту же реакцию.

Рис. 47. Ацилфосфат
Если необходимо ускорить дело, то образец можно растолочь до полужидкой гомогенной кашицы («гомогената»), которую и поместить в субстрат. Тогда не придется ждать, пока субстрат проникнет в клетки–в процессе размешивания все ферменты лишились защиты клеточных мембран, и ничто не мешает им теперь проявлять каталитические свойства.
В гомогенате тоже содержится очень много ферментов, и обычно требуется сократить их число во избежание побочных реакций, которые могут помешать, и для того, чтобы концентрация необходимого фермента оказалась более высокой, чем в живом организме.
Это достигается путем подвергания гомогената условиям, о которых известно, что в них один фермент отделяется от другого. При помещении материала в некоторые растворы одни белки втягиваются в раствор, другие остаются в гомогенате. Отфильтровав после этого смесь, мы получим раствор, в котором содержатся только растворимые белки, «экстракт ткани», или «вытяжка из ткани». Получившуюся вытяжку можно дальше подвергнуть воздействию определенных кислот, ионов или некоторых органических растворов при низких температурах. При каждом из этих действий одни ферменты будут осаждаться, а другие останутся в растворе. Если повезет – можно дойти и до такого этапа, когда в растворе останется вообще только один, нужный, фермент.
Именно в результате длительной работы с вытяжками из ткани чета американских биохимиков чешского происхождения, Карл Кори и Герти Кори, сумели показать, что расщепление гликогена в тканях не имеет ничего общего с гидролизом и не катализируется амилазами.
В 1935 году К. и Г. Кори обнаружили, что если поместить вытяжку из мышц в гликоген, то никакого расщепления происходить не будет, пока в раствор не будет добавлен фосфат‑ион. Естественно, первым делом исследователи предположили, что продукт распада должен будет вступить в соединение с фосфат‑ионом, стали искать и в конце концов нашли в смеси сахарофосфат (не глюкозу!). В 1937 году они установили, что этот сахарофосфат, получивший к тому времени название «эфир Кори», является «глюкозо‑1‑фосфатом». (Шесть атомов углерода, входящих в состав глюкозы, имеют, согласно международной договоренности, номера от 1 до 6, и глюкозо‑1‑фосфат – это молекула, в которой фосфатная группа крепится к атому углерода № 1.)
Так оказалось, что гликоген в организме подвергается не гидролизу, а распаду с использованием фосфорной кислоты. Я поясню, что я имею в виду, на примере прилагаемой диаграммы. Пусть G – глюкоза, тогда гликоген – это цепочка G3, соединенная кислородными связями.
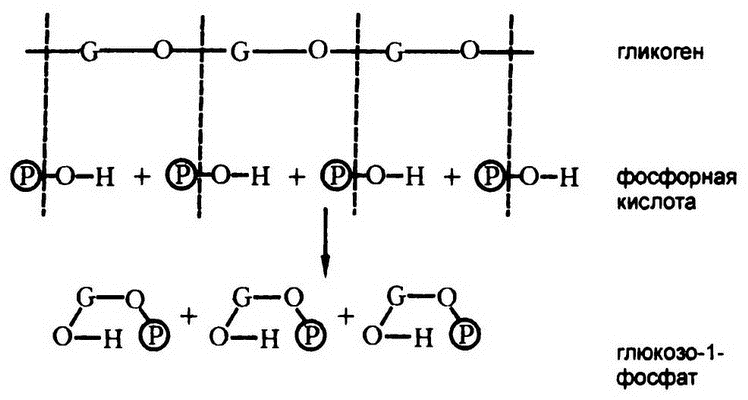
Рис. 48. Фосфоролиз гликогена
Длинная глюкозная цепочка гликогена расщепляется на одиночные молекулы сахара путем добавления наперерез связям элементов фосфорной кислоты. Если бы добавляемые элементы были молекулами воды, то речь шла бы о гидролизе. Раз вместо воды используется фосфорная кислота, то и реакцию эту естественно назвать «фосфоролизом» (рис. 48). Таким образом, гликоген в живых тканях расщепляется на глюкозо‑1‑фосфаты с помощью фосфоролиза.
Разница между этими двумя типами реакций имеет отношение к свободной энергии. Гидролиз гликогена на глюкозу подразумевает значительное уменьшение уровня свободной энергии, а для того, чтобы подобным же образом снова создать гликоген из глюкозы, потребуется такое же количество энергии приложить на каждое заново формируемое звено связи.
Фосфоролиз же гликогена на глюкозо‑1‑фосфат подразумевает крайне малое снижение уровня свободной энергии. Гликоген и глюкозо‑1‑фосфат находится почти на одинаковом энергетическом уровне. Соответственно, реакция фосфоролиза легко обратима, так что при равных концентрациях организм может легко переключаться между расщеплением и построением гликогена, в зависимости от потребностей, поддерживая таким образом необходимую для здоровья гармонию, что уже упоминалось в главе 19.
Однако производство глюкозо‑1‑фосфата всей полноты проблемы не снимает. Прежде всего, сахарофосфаты по какой‑то причине не могут проникать через клеточную мембрану, так что любое соединение, содержащее глюкозо‑1‑фосфат, будучи созданным в клетке печени, обречено в ней и оставаться, пока не утратит фосфат. Поэтому при пищеварении образуется именно глюкоза, поскольку только она способна преодолеть кишечные мембраны и попасть в клетки тканей – глюкозо‑1‑фосфат не смог бы. И только глюкоза может присутствовать в крови, поскольку только она, а не глюкозо‑1‑фосфат, может проникать из крови в клетки и питать их. Поэтому именно глюкозу, а не глюкозо‑1‑фосфат, клетки печени должны выбрасывать в кровь.
Так и происходит. В клетках печени был обнаружен фермент, катализирующий превращение глюкозо‑1‑фосфата в глюкозо‑6‑фосфат (фосфатная группа при этом смещается от углерода‑1 к углеро‑ду‑6, что не требует каких‑либо заслуживающих упоминания перемен в энергии), а затем был обнаружен и второй фермент, действие которого заключается в отсечении фосфатной группы посредством гидролиза. Этот шаг высвобождает глюкозу, которая просачивается сквозь клеточную мембрану и попадает в кровоток.
Но обойти требования, касающиеся свободной энергии, невозможно. При переходе от глюкозо‑6‑фосфата к непосредственно глюкозе происходит ее высвобождение. То же самое произошло бы и при расщеплении гликогена на глюкозу напрямую; так не все равно – расщеплять гликоген напрямую или через посредническую цепочку из двух сахарофосфатов? Чем это лучше? Тогда перед тем, как образовывать гликоген из глюкозофосфатов, для образования глюкозофосфатов из глюкозы организму все равно придется где‑то брать энергию – так не проще ли сразу образовывать его из глюкозы, минуя промежуточные стадии?
Нет. При формировании гликогена перед организмом встают две основные проблемы: надо создать большую и сложную молекулу из простых и маленьких и надо найти энергию для соединения каждой из связей в цепочке, каковых в каждой молекуле гликогена по тысяче. Если организм будет поставлен перед задачей создать гликоген сразу из глюкозы, ему придется решать обе эти проблемы одновременно, и очевидно, что организм с ними не справляется.
Если же сначала глюкоза преобразуется в глюкозо‑6‑фосфат, то энергию искать все равно приходится, но первая проблема при этом снимается – простое вещество переходит в другое, почти столь же простое. Затем, когда глюкозофосфат уже сформирован, организму остается только объединить единицы глюкозы в огромную молекулу, но энергии для этого уже почти не требуется. Таким образом, одна сложная задача для организма разбивается на две простые, и с ними поодиночке организм вполне справляется.
Описываемый баланс гликогена и глюкозы проиллюстрирован на рис. 49.
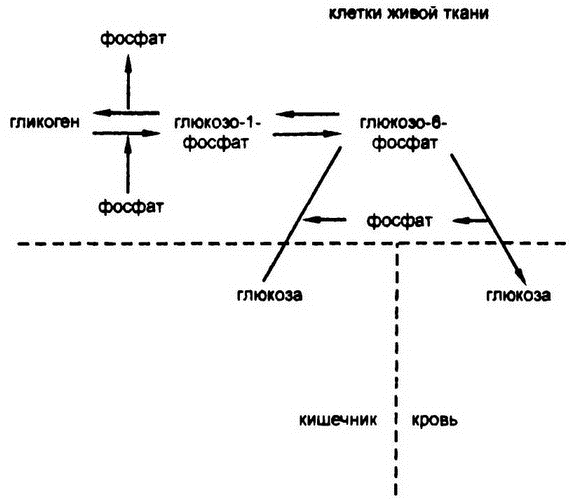
Рис. 49. Связь гликогена и глюкозы
Следующий вопрос таков: так или иначе, при переходе от глюкозы к гликогену организму все же необходимо найти‑то источник энергии. Где же он ее берет? Иными словами, глядя на рис. 49, мы можем спросить: за счет чего организм переводит глюкозу в глюкозо‑6‑фосфат?
Вот здесь и проявляется роль высокоэнергетической фосфатной связи. Для перехода от глюкозы к глюкозо‑6‑фосфату требуются две вещи – фосфатная группа и энергия. АТФ обладает и тем и другим.
Реакцию глюкозы с АТФ можно выразить следующим образом:
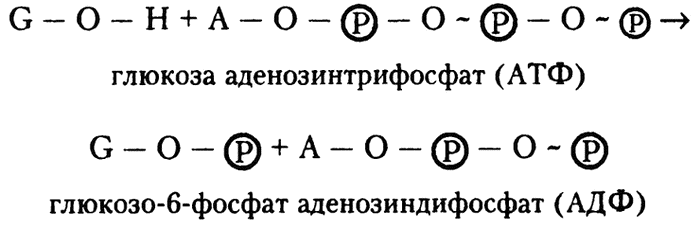
Представим себе, что это выражение представляет собой комбинацию двух реакций. Первая – это перевод глюкозы в глюкозо‑6‑фосфат. При этом формируется низкоэнергетическая фосфатная связь, для чего требуется затратить около 4 килокалорий на моль вещества. Вторая – перевод АТФ в АДФ путем гидролиза высокоэнергетической фосфатной связи, в процессе чего высвобождается около 8 килокалорий на моль вещества. Получается, что гидролиза АТФ более чем достаточно для того, чтобы глюкоза могла превратиться в глюкозо‑6‑фосфат.
Это пример специфической парной реакции, при одной части которой высвобождается больше энергии, чем при второй – тратится, так что в итоге энергия все равно высвобождается (второй закон термодинамики не обойдешь).
До последнего времени существовало мнение, что АТФ – это и есть энергетический концентрат организма, и везде, где требуется проведение энергоемкой реакции, подключается АТФ. Однако с помощью современных методик анализа ткани было установлено, что существуют и другие трифосфаты, и теперь считается, что для различных реакций существуют и различные источники энергии. Тем не менее все они действуют по тому же принципу, и то, что я рассказал об АТФ, в равной степени относится и к близким к нему веществам.
Фруктоза и галактоза, два других простых сахара, впитываемые организмом, тоже образуют соединения при энергетической помощи АТФ (и особых ферментов, разумеется, не тех, которые действуют в отношении глюкозы). Фруктозо‑1‑фосфат и галактозо‑1‑фосфат превращаются в тот же глюкозо‑1‑фосфат с помощью реакций, не требующих заслуживающей упоминания энергии, а дальше фруктоза и галактоза обычным путем превращаются в гликоген.
Формирование гликогена из простых Сахаров, таким образом, «называется «гликогенезом», а расщепление гликогена на простые сахара – «гликогенолизом». Схема с участием АТФ и всех трех Сахаров представлена на рис. 50.
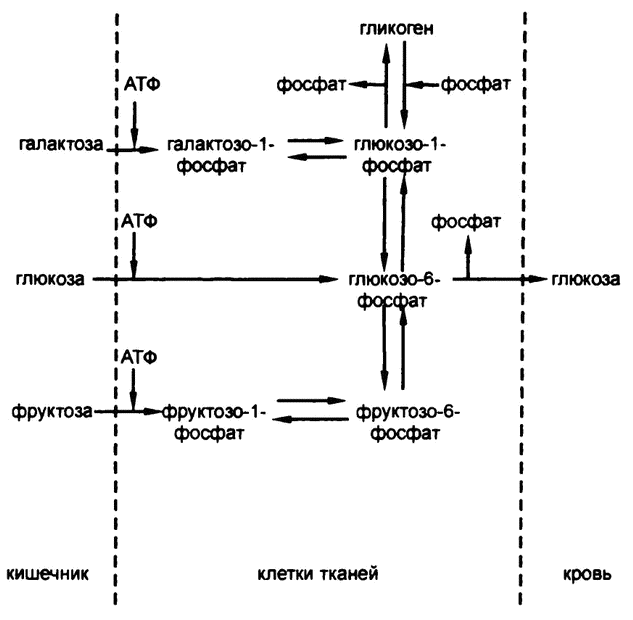
Рис. 50. АТФ и гликоген
Но что‑то слишком гладко все получается. И правда, не можем же мы утверждать, что энергетический запас АТФ и подобных ему молекул – ответ на все задачи жизни? Что же происходит, когда он исчерпывается?
Естественно, он не исчерпывается, потому что если бы он исчерпался, то анаболизм прекратился бы, а вместе с ним – и жизнь. Поскольку жизнь не прекращается, значит, запас энергии каким‑то образом возобновляется так же быстро, как и тратится.
Это означает, что организм каким‑то образом строит АТФ из АДФ с той же скоростью, с какой АТФ расщепляется до АДФ в ходе множества парных реакций. Кажется, мы совсем запутались. Решив проблему энергоемких (4 килокалории на моль) процессов соединения глюкозы за счет гидролиза АТФ до АДФ, теперь мы должны решить проблему еще более энергоемких (8 килокалорий на моль) процессов создания АДФ из АТФ?
Что ж, они происходят в ходе анаэробного гликолиза, который я описывал в предыдущей главе.
На протяжении 30‑х годов XX века биохимики выделяли промежуточные вещества реакций гликолизации дрожжей или живых тканей и искали ферменты, катализирующие реакции с участием этих промежуточных веществ. Выделение промежуточных веществ и изучение реакций позволило им шаг за шагом собрать, как мозаику, всю цепь катаболизма от глюкозы до молочной кислоты.
Сначала к глюкозе присоединяется фосфатная группа, затем, после перехода во фруктозу, – вторая. (Образованный таким образом фруктозодифосфат – это и есть тот самый «эфир Хардена–Янга», который я упоминал в прошлой главе.) Прикрепление каждого фосфата требует участия АТФ, так что может показаться, что цепочка гликолиза лишь усугубляет проблему, используя АТФ для своих целей, вместо того чтобы его создавать. Но мы ведь еще не закончили.
Фруктозодифосфат со своими шестью атомами углерода расщепляется на две половинки по три атома углерода в каждой (глицеральдегид‑3‑фосфата), в каждой из которых оказывается по одному фосфату. Что происходит с этим веществом дальше, показано на рис. 51.
Как видите, к нему добавляется вторая фосфатная группа, но не методом обычной конденсации. То есть в ходе этой реакции не образуется вода (Н – О – Н). Вместо этого выделяются два атома водорода – и все. Такой процесс называется дегидрогенизацией. При этом два выделяющихся атома водорода не образуют молекулы газообразного водорода, хотя я и записал их в выражении как просто 2Н. Их дальнейшая судьба немного сложнее, и мы вернемся к ним позже.
В результате дегидрогенизации образуется ацилфосфат, который, как я уже упоминал, является высокоэнергетическим соединением. Откуда же берется энергия для его образования? Из потери двух атомов водорода. Дегидрогенизация подразумевает снижение уровня свободной энергии на 35–70 килокалорий на моль вещества, и этого более чем достаточно, чтобы получить необходимые 8 килокалорий для формирования высокоэнергетической связи. (В строго анаэробных условиях такого масштабного пустого расходования энергии, что нам приходит в голову при виде приведенных цифр, не получается, потому что оба атома водорода в итоге потом возвращаются – вместе со своей энергией.)
Далее в цепочке формируется вторая высокоэнергетическая связь в ходе реакции, менее энергичной, чем дегидрогенизация, но тем не менее достаточной для превращения уже существующей низкоэнергетической связи в высокоэнергетическую.
Любое вещество, в состав которого входит высокоэнергетическая фосфатная связь (например, 1,3‑дифосфоглицериновая кислота), может вступать в реакцию с АДФ для передачи ему этой фосфатной связи, образуя АТФ. На такой перенос связи никаких заслуживающих упоминания энергозатрат не требуется. Таким образом, формирование любой высокоэнергетической фосфатной связи равносильно формированию молекулы АТФ.
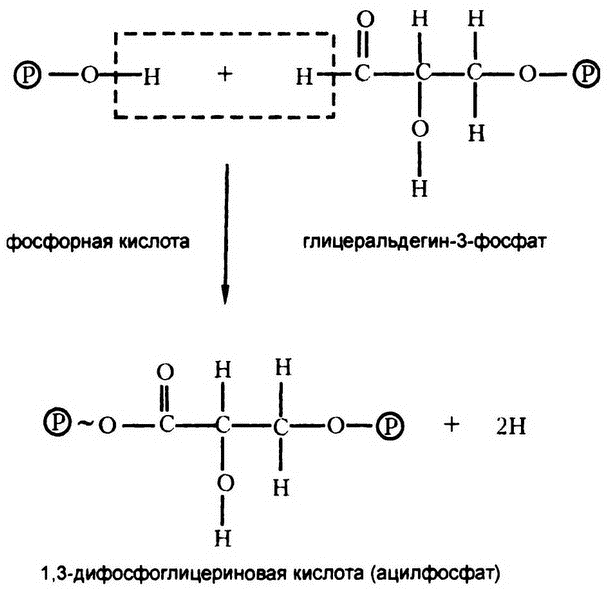
Рис. 51. Дегидрогенация

Рис. 52. Схема гликолиза
Итак, подытожим. При анаэробном гликолизе каждая молекула глюкозы начинает свое превращение в молочную кислоту с помощью двух молекул АТФ. Однако в конечном итоге глюкоза распадается на соединения с тремя атомами углерода, каждый из которых к моменту окончательного превращения в молочную кислоту доставляет в организм две молекулы АТФ.
Следовательно, шесть атомов углерода, содержащихся в глюкозе, используя две молекулы АТФ, создают их четыре, таким образом принося организму доход в две молекулы АТФ (рис. 52), которые потом можно использовать в парных реакциях для осуществления процессов анаболизма.
Но, как я уже говорил, гликолиз – неэффективный способ производства энергии. Если бы организм жил на одном гликолизе, он вел бы такое же тупое существование, как и дрожжи. Нас интересует большее, поэтому мы сейчас обратимся к кислороду.
Глава 22.
Дата добавления: 2016-01-26; просмотров: 1422;
