АМИНОКИСЛОТЫ, ИХ СВОЙСТВА
Белки и пептиды. Первичная структура белков и пептидов
Белки – высокомолекулярные биополимеры, построенные из остатков аминокислот. Молекулярная масса белков колеблется в пределах от 6 000 до 2 000 000 Да. Именно белки являются продуктом генетической информации, передаваемой из поколения в поколение, и осуществляют все процессы жизнедеятельности в клетке. Этим удивительным по разнообразию полимерам присущи одни из наиболее важных и разносторонних клеточных функций.
Белки можно разделить:
1) по строению:простые белки построены из остатков аминокислот и при гидролизе распадаются, соответственно, только на свободные аминокислоты или их производные.
Сложные белки – это двухкомпонентные белки, которые состоят из какого-либо простого белка и небелкового компонента, называемого простетической группой. При гидролизе сложных белков, помимо свободных аминокислот, образуются небелковая часть или продукты ее распада. В их состав могут входить ионы металлов (металлопротеины), молекулы пигментов (хромопротеины), они могут образовывать комплексы с другими молекулами (липо-, нуклео-, гликопротеины), а также ковалентно связывать неорганический фосфат (фосфопротеины);
2. растворимости в воде:
– водорастворимые,
– солерастворимые,
– спирторастворимые,
– нерастворимые;
3. выполняемым функциям:к биологическим функциям белков относятся:
– каталитическая (ферментативная),
– регуляторная (способность регулировать скорость химических реакций в клетке и уровень метаболизма в целом организме),
– транспортная (транспорт веществ в организме и перенос их через биомембраны),
– структурная (в составе хромосом, цитоскелета, соединительных, мышечных, опорных тканей),
– рецепторная (взаимодействие рецепторных молекул с внеклеточными компонентами и инициирование специфического клеточного ответа).
Кроме этого, белки выполняют защитные, запасные, токсические, сократительные и другие функции;
4) в зависимости от пространственной структуры:
– фибриллярные (они используются природой как структурный материал),
– глобулярные (ферменты, антитела, некоторые гормоны и др.).
АМИНОКИСЛОТЫ, ИХ СВОЙСТВА
Аминокислотами называются карбоновые кислоты, содержащие аминогруппу и карбоксильную группу. Природные аминокислоты являются 2-аминокарбоновыми кислотами, или α-аминокислотами, хотя существуют такие аминокислоты, как β-аланин, таурин, γ-аминомасляная кислота. В общем случае формула α-аминокислоты выглядит так:

У α-аминокислот при 2-м атоме углерода имеются четыре разных заместителя, т. е. все α-аминокислоты, кроме глицина, имеют асимметрический (хиральный) атом углерода и существуют в виде двух энантиомеров – L- и D-аминокислот. Природные аминокислоты относятся к L-ряду. D-аминокислоты встречаются в бактериях и пептидных антибиотиках.
Все аминокислоты в водных растворах могут существовать в виде биполярных ионов, причем их суммарный заряд зависит от рН среды. Величина рН, при которой суммарный заряд равен нулю, называется изоэлектрической точкой. В изоэлектрической точке аминокислота является цвиттер-ионом, т. е. аминная группа у нее протонирована, а карбоксильная – диссоциирована. В нейтральной области рН большинство аминокислот являются цвиттер-ионами:
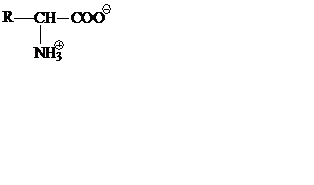
Аминокислоты не поглощают свет в видимой области спектра, ароматические аминокислоты поглощают свет в УФ области спектра: триптофан и тирозин при 280 нм, фенилаланин при 260 нм.
Белки дают ряд цветных реакций, обусловленных наличием определенных аминокислотных остатков или общих химических группировок. Эти реакции широко используются для аналитических целей. Среди них наиболее известны нингидриновая реакция, позволяющая проводить количественное определение аминогрупп в белках, пептидах и аминокислотах, а также биуретовая реакция, применяемая для качественного и количественного определения белков и пептидов. При нагревании белка или пептида, но не аминокислоты, с CuSO4 в щелочном растворе образуется окрашенное в фиолетовый цвет комплексное соединение меди, количество которого можно определить спектрофотометрически. Цветные реакции на отдельные аминокислоты используются для обнаружения пептидов, содержащих соответствующие аминокислотные остатки. Для идентификации гуанидиновой группы аргинина применяется реакция Сакагучи – при взаимодействии с а-нафтолом и гипохлоритом натрия гуанидины в щелочной среде дают красное окрашивание. Индольное кольцо триптофана может быть обнаружено реакцией Эрлиха – красно-фиолетовое окрашивание при реакции с п-диметиламино-бензальдегидом в H2SO4. Реакция Паули позволяет выявить остатки гистидина и тирозина, которые в щелочных растворах реагируют с диазобензол-сульфокислотой, образуя производные, окрашенные в красный цвет.
Биологическая роль аминокислот:
1) структурные элементы пептидов и белков, так называемые протеиногенные аминокислоты. В состав белков входят 20 аминокислот, которые кодируются генетическим кодом и включаются в белки в процессе трансляции, некоторые из них могут быть фосфорилированы, ацилированы или гидроксилированы;
2) структурные элементы других природных соединений – коферментов, желчных кислот, антибиотиков;
3) сигнальные молекулы. Некоторые из аминокислот являются нейромедиаторами или предшественниками нейромедиаторов, гормонов и гистогормонов;
4) важнейшие метаболиты, например, некоторые аминокислоты являются предшественниками алкалоидов растений, или служат донорами азота, или являются жизненно важными компонентами питания.
Номенклатура, молекулярная масса и значения pK аминокислот приведены в таблице 1.
Таблица 1
Дата добавления: 2015-12-22; просмотров: 2422;
