Фрагментация полипептидной цепи.
Ферментативные методы. Для специфического расщепления белков по определенным точкам применяются как ферментативные, так и химические методы. Из ферментов, катализирующих гидролиз белков по определенным точкам, наиболее широко используют трипсин и химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет белки после остатков ароматических аминокислот – фенилаланина, тирозина и триптофана. При необходимости специфичность трипсина может быть повышена или изменена. Например, обработка цитраконовым ангидридом исследуемого белка приводит к ацилированию остатков лизина. В таком модифицированном белке расщепление будет проходить только по остаткам аргинина. Также при исследовании первичной структуры белков широкое применение находит протеиназа, которая также относится к классу сериновых протеиназ. Фермент имеет два максимума протеолитической активности при рН 4,0 и 7,8. Протеиназа с высоким выходом расщепляет пептидные связи, образованные карбоксильной группой глутаминовой кислоты.
В распоряжении исследователей имеется также большой набор менее специфичных протеолитических ферментов (пепсин, эластаза, субтилизин, папаин, проназа и др.). Эти ферменты используются в основном при дополнительной фрагментации пептидов. Их субстратная специфичность определяется природой аминокислотных остатков, не только образующих гидролизуемую связь, но и более удаленных по цепи.
Химические методы.
1) среди химических методов фрагментации белков наиболее специфичным и чаще всего применяемым является расщепление бромцианом по остаткам метионина (рис 7).
Реакция с бромцианом проходит с образованием промежуточного циансульфониевого производного метионина, спонтанно превращающегося в кислых условиях в иминолактон гомосерина, который, в свою очередь, быстро гидролизуется с разрывом иминной связи. Получающийся на С-конце пептидов лактон гомосерина далее частично гидролизуется до гомосерина (HSer), в результате чего каждый пептидный фрагмент, за исключением С-концевого, существует в двух формах – гомосериновой и гомосеринлактоновой;
Рис. 7. Расщепление полипептидной цепи бромцианом
2) большое число методов предложено для расщепления белка по карбонильной группе остатка триптофана. Одним из используемых для этой цели реагентов является N-бромсукцинимид;
3) реакция тиолдисульфидного обмена. В качестве реагентов используют восстановленный глутатион, 2-меркаптоэтанол, дитиотреитол.
5. Определение последовательности пептидных фрагментов.На этой стадии устанавливается аминокислотная последовательность в каждом из пептидных фрагментов, полученных на предыдущей стадии. Для этой цели обычно используют химический метод, разработанный Пером Эдманом. Расщепление по Эдману сводится к тому, что метится и отщепляется только N-концевой остаток пептида, а все остальные пептидные связи не затрагиваются. После идентификации отщепленного N-концевого остатка метка вводится в следующий, ставший теперь N-концевым, остаток, который точно так же отщепляется, проходя через ту же серию реакций. Так, отщепляя остаток за остатком, можно определить всю аминокислотную последовательность пептида, используя для этой цели всего одну пробу. В методе Эдмана вначале пептид взаимодействует с фенилизотиоционатом, который присоединяется к свободной α-аминогруппе N-концевого остатка. Обработка пептида холодной разбовленной кислотой приводит к отщеплению N-концевого остатка в виде фенилтиогидантоинового производного, которое можно идентифицировать хроматографическими методами. Остальная часть пептидной цени после удаления N-концевого остатка оказывается неповрежденной. Операция повторяется столько раз, сколько остатков содержит пептид. Таким способом можно легко определить аминокислотную последовательность пептидов, содержащих 10 - 20 аминокислотных остатков. Определение аминокислотной последовательности проводится для всех фрагментов, образовавшихся при расщеплении. После этого возникает следующая проблема – определить, в каком порядке располагались фрагменты в первоначальной полипептидной цепи.
Автоматическое определение аминокислотной последовательности. Крупным достижением в области структурных исследований белков явилось создание в 1967 г. П. Эдманом и Дж. Бэггом секвенатора – прибора, который с высокой эффективностью осуществляет последовательное автоматическое отщепление N-концевых аминокислотных остатков по методу Эдмана. В современных секвенаторах реализованы различные методы определения аминокислотной последовательности.
6. Расщепление исходной полипептидной цепи еще одним способом.Чтобы установить порядок расположения образовавшихся пептидных фрагментов, берут новую порцию препарата исходного полипептида и расщепляют его на более мелкие фрагменты каким-либо другим способом, при помощи которого расщепляются пептидные связи, устойчивые к действию предыдущего реагента. Каждый из полученных коротких пептидов подвергается последовательному расщеплению по методу Эдмана (так же, как на предыдущей стадии), и таким путем устанавливают их аминокислотную последовательность.
7. Установление первичной структуры полипептида с учетом перекрывающихся последовательностей фрагментов обоих расщеплений.Аминокислотные последовательности в пептидных фрагментах, полученных двумя способами, сравнивают, чтобы во втором наборе найти пептиды, в которых последовательности отдельных участков совпадали бы с последовательностями тех или иных участков пептидов первого набора. Пептиды из второго набора с перекрывающимися участками позволяют соединить в правильном порядке пептидные фрагменты, полученные в результате первого расщепления исходной полипептидной цепи.
Иногда второго расщепления полипептида на фрагменты оказывается недостаточно, для того чтобы найти перекрывающиеся участки для всех пептидов, полученных после первого расщепления. В этом случае применяется третий, а иногда и четвертый способ расщепления, чтобы получить набор пептидов, обеспечивающих полное перекрывание всех участков и установление полной последовательности аминокислот в исходной полипептидной цепи.
Тема 3. Структурная организация белков и пептидов. Методы выделения
Аминокислотные остатки в пептидной цепи белков не чередуются случайным образом, а расположены в определенном порядке. Линейная последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой белка. Она определяет другие уровни организации белков – вторичную, третичную и четвертичную структуры.
Последовательность аминокислот в первичной структуре белка является специфической для данного белка, отличающей его от любого другого индивидуального белка. Замена даже одной аминокислоты на другую может привести к полной утрате биологической активности белка.
Первичная структура белка генетически детерминирована и воспроизводится в ходе транскрипции и трансляции. Первичная структура стабилизируется ковалентными связями – пептидной, а в некоторых белках и дисульфидной. Последняя образуется при окислении остатков цистеина между разными участками одной и той же полипептидной цепи.
Вторичная структура белка – это пространственная структура, образующаяся в результате взаимодействий между функциональными группами пептидного остова.
Пептидная цепь содержит множество СО- и NH-групп пептидных связей, каждая из которых потенциально способна участвовать в образовании водородных связей. Существуют два главных типа структур, которые позволяют это осуществить: α-спираль, в которую цепь свертывается, как шнур от телефонной трубки, и складчатая β-структура, в которой бок о бок уложены вытянутые участки одной или нескольких цепей. Обе эти структуры весьма стабильны.
α-спираль характеризуется предельно плотной упаковкой скрученной полипептидной цепи, на каждый виток правозакрученной спирали приходится 3,6 аминокислотных остатка, радикалы которых направлены всегда наружу и немного назад, т. е. в начало полипептидной цепи.
β-складчатость – это слоистая структура, образуемая водородными связями между линейно расположенными пептидными фрагментами. Обе цепи могут быть независимыми или принадлежать одной молекуле полипептида. Если цепи ориентированы в одном направлении, то такая β-структура называется параллельной. В случае противоположного направления цепей, т. е. когда N-конец одной цепи совпадает с С-концом другой цепи, β-структура называется антипараллельной(рис.7). Энергетически более предпочтительна антипараллельная β-складчатость с почти линейными водородными мостиками.
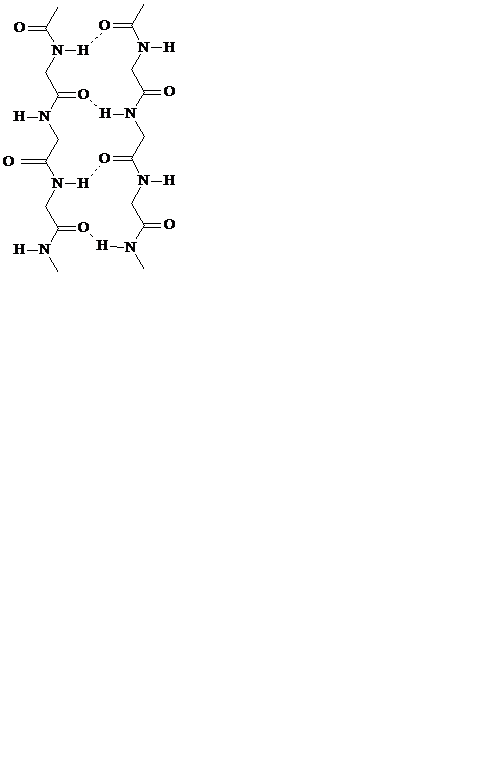
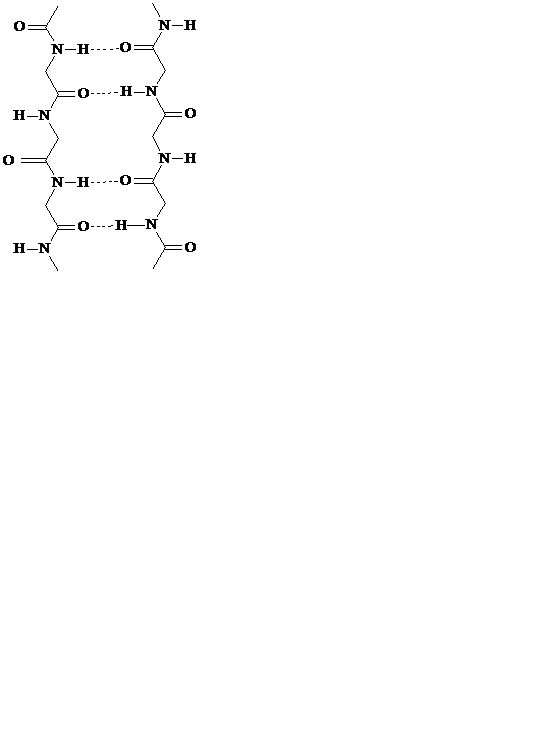
параллельная β-складчатость антипараллельная β-складчатость
Рис. 7. Примеры вторичной структуры белков
В отличие от α-спирали, насыщенной водородными связями, каждый участок цепи β-складчатости открыт для образования дополнительных водородных связей. Боковые радикалы аминокислот ориентированы почти перпендикулярно плоскости листа попеременно вверх и вниз.
Третичная структура белка – это пространственное расположение молекулы белка, стабилизируемое связями между боковыми радикалами аминокислот.
Начиная с третичной структуры белок способен выполнять свойственные ему биологические функции. В основе функционирования белков лежит то, что при укладке третичной структуры на поверхности белка образуются участки, которые могут присоединять к себе другие молекулы, называемые лигандами. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда. Комплементарность – это пространственное и химическое соответствие взаимодействующих поверхностей. Для большей части белков третичная структура – максимальный уровень укладки.
Четвертичная структурахарактерна для белков, состоящих из двух и более полипептидных цепей, связанных между собой исключительно нековалентными связями, в основном водородными и электростатическими. Чаще всего белки содержат две или четыре субъединицы, более четырех обычно содержат регуляторные белки.
Приметры структурной организации белков представлены на рис. 8.
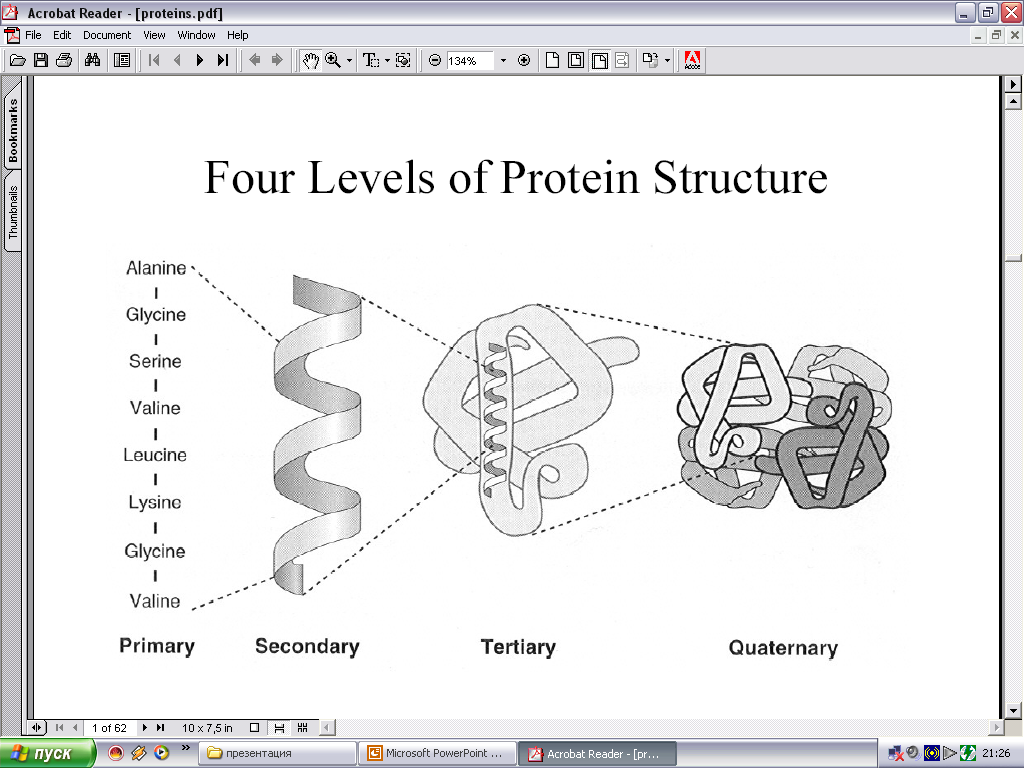
Рис. 8. Структурная организация белковой молекулы
Белки, имеющие четвертичную структуру, часто называют олигомерными. Различают гомомерные и гетеромерные белки. К гомомерным относятся белки, у которых все субъединицы имеют одинаковое строение, например, фермент каталаза состоит их четырех абсолютно одинаковых субъединиц. Гетеромерные белки имеют разные субъединицы, например, фермент РНК-полимераза состоит из пяти разных по строению субъединиц, выполняющих разные функции.
Методы выделения белков:
• метод мембранной фильтрации;
• осаждение белков растворами солей или органических растворителей;
• гель-хроматография;
• ультроцентрифугирование;
• электрофорез.
Индивидуальные белки различаются по физико-химическим свойствам:
– молекулярной массе (набору аминокислот, первичной структуре);
– форме молекул (третичной структуре);
– суммарному заряду, величина которого зависит от соотношения анионных и катионных групп аминокислот;
– соотношению полярных и неполярных радикалов аминокислот;
– степени устойчивости к воздействию различных денатурирующих агентов.
При выделении индивидуальных белков обычно сталкиваются со следующими трудностями:
1) низкое содержание белка в исходном материале (часто менее 0,1% от сухой массы);
2) лабильность белков, что не позволяет применять традиционные методы органической химии (нагревание, перегонка, кристаллизация);
3) связь белков со структурными элементами клеток или наличие их в белково-липидных, белково-углеводных и других комплексах биологических жидкостей;
4) наличие близких физико-химических свойств у разделяемых белков.
Последовательность операций по выделению и очистке индивидуальных белков следующая:
• измельчение биологического материала до гомогенного состояния (гомогенизация);
• перевод белков в растворенное состояние (солюбилизация, экстракция);
• фракционирование белков и получение обогащенной фракции;
• выделение индивидуального белка из обогащенной фракции;
• определение гомогенности выделенного белка.
Гомогенизация биологического материала. Большинство белков, в том числе и ферментов, локализовано внутри клеток. Поэтому перед выделением белков из биологических объектов (органов и тканей животных, клеток микроорганизмов и растений) исследуемый материал тщательно измельчают до гомогенного состояния, т. е. подвергают дезинтеграции вплоть до разрушения клеточной структуры с целью высвобождения клеточного содержимого. Эту процедуру называют гомогенизацией. Для разрушения клеток применяют ряд физических методов: гомогенизацию с использованием механических гомогенизаторов различных конструкций, ультразвуковую дезинтеграцию, замораживание-оттаивание и др. Наиболее простым методом является гомогенизация путем растирания клеток с окисью алюминия или абразивным порошком в ступке при помощи пестика.
Солюбилизация и/или экстракция белков. Гомогенизацию биологического материала обычно сочетают с одновременной солюбилизацией или экстракцией белков из гомогенатов с целью перевода белков в растворенное состояние. В качестве экстрагентов используют 8 - 10%-ные растворы солей (NaCl, KCl), водные растворы глицерина, слабые растворы сахарозы (особенно для солюбилизации мембранных белков), различные буферные растворы, а также органические растворители.
На растворимость белков при их солюбилизации или экстракции большое влияние оказывает рН среды, поэтому в белковой химии широко применяют буферные растворы с близкими к нейтральным значениями рН.
Не все белки способны существовать в солюбилизированном состоянии, будучи изолированы от их нормального клеточного окружения. Это относится к белкам, структурно связанным с нерастворимыми компонентами клетки, такими как плазматическая мембрана, митохондрии, хлоропласты, ядерные мембраны и др. Поэтому успех выделения и очистки таких белков зависит от того, насколько полно их можно отделить от других соединений, входящих в состав клеточных структур.
Большинство мембраносвязанных белков можно экстрагировать из мембран в присутствии детергентов, разрушающих гидрофобные взаимодействия между белками и липидами или между белковыми молекулами в составе комплексов белков с молекулами липидов или с другими белками и в конечном счете разрушающих липидный бислой.
После солюбилизации или экстракции белков полученный экстракт осветляют путем осаждения обломков клеток центрифугированием. Размер частиц является определяющим фактором при выборе скорости и продолжительности центрифугирования.
Фракционирование белков и получение обогащенной фракции. Методы фракционирования белков основаны на их различиях по растворимости в воде, изменению гидродинамического радиуса, подвижности в зависимости от молекулярной массы и степени ионизации белковой молекулы. К ним относятся такие методы, как высаливание, осаждение органическими растворителями и изоэлектрическое осаждение. Как указывалось выше, белковая молекула в растворе удерживается двумя факторами – зарядом и гидратной оболочкой. При устранении этих факторов устойчивости белки осаждаются. Методы высаливания, осаждения белков органическими растворителями и изоэлектрического осаждения являются способами обратимого осаждения белков, при котором белковые молекулы не подвергаются денатурации и их осадки могут быть снова растворены с сохранением своих нативных свойств.
Однако существуют способы необратимого осаждения белков, когда происходит глубокая денатурация белка, при которой нековалентные связи в белковой молекуле разрываются, и денатурированный белок не способен восстановить свои первоначальные свойства. К ним относятся денатурация под действием температуры и путем изменения рН.
Обязательной стадией, предшествующей выделению индивидуального белка из обогащенной фракции, является освобождение белковых растворов от низкомолекулярных соединений (сульфата аммония, органических растворителей). Для этого используют методы диализа и гель-фильтрации.
Диализомназывается процесс разделения высокомолекулярных и низкомолекулярных веществ с помощью полупроницаемых мембран. При диализе применяют полупроницаемые мембраны (целлофан), диаметр пор которых варьируется в широких пределах. Этот метод основан на неспособности белков проходить через полупроницаемую мембрану, которая легко пропускает низкомолекулярные вещества. Диффузия последних через мембраны обеспечивается разностью концентраций подлежащего удалению вещества в исследуемом растворе и чистом растворителе, находящихся по разные стороны мембраны.
Белковый раствор помещают в целлофановый мешочек, который погружают в чистый растворитель (воду, физиологический или буферный раствор). Низкомолекулярные вещества будут выходить из мешочка в растворитель до тех пор, пока их концентрации по обе стороны мембраны не станут равными. Для ускорения диффузии рекомендуется регулярно менять растворитель.
Устройство для диализа представлено на рис. 9.
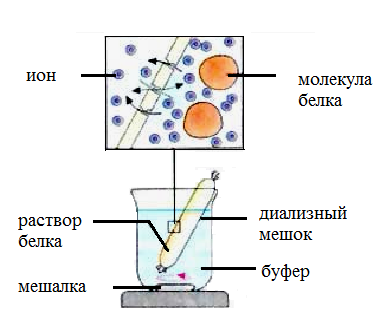
Рис. 9. Устройство для диализа
Выделение индивидуального белка из обогащенной фракции. Методы выделения индивидуального белка из смеси белков с близкими физико-химическими свойствами основаны на различиях белков: по молекулярной массе (методы ультрацентрифугирования, ультрафильтрации и гель-фильтрации), заряду (ионообменная хроматография), степени адсорбции белков и их растворимости в соответствующем растворителе (адсорбционная хроматография), способности белков к специфическим взаимодействиям с аффинным лигандом (аффинная хроматография).
Ультрацентрифугирование – это высокоскоростное центрифугирова-ние. Разделение веществ с помощью центрифугирования основано на разном поведении частиц в возрастающем центробежном поле. Частицы, имеющие разную плотность, форму или молекулярную массу, осаждаются с разной скоростью. Скорость седиментации частиц зависит от центробежного ускорения g.
Суспензию белков в центрифужной пробирке помещают в ротор ультрацентрифуги. Ультрацентрифугирование позволяет получить в центрифужных пробирках, вращающихся со скоростью до 85 000 об/мин, центробежное ускорение 30 000-50 000 g. При этом скорость осаждения белков пропорциональна их молекулярной массе.
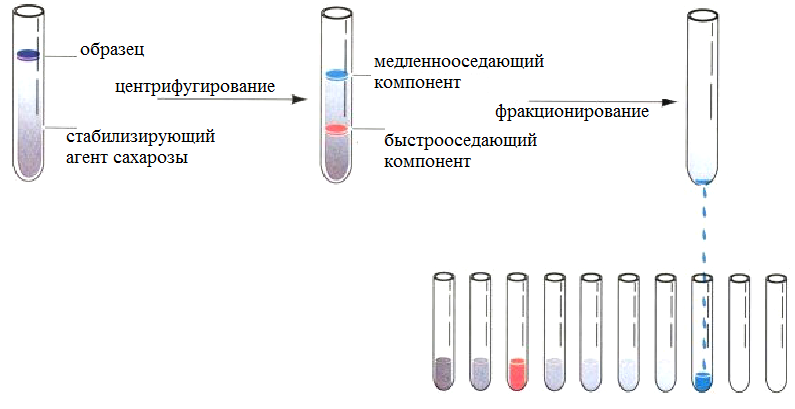
Ультрацентрифуги снабжены холодильной установкой для предотвращения перегрева ротора вследствие трения его о воздух. Центрифужные пробирки и их содержимое должны быть тщательно уравновешены. Уравновешенные пробирки следует располагать в роторе одну против другой. Схема ультацентрифугирования образцов предсталена на рис. 10.
Рис.10. Схема ультацентрифугирования образцов
Гель-фильтрация(гель-хроматография) представляет собой метод разделения веществ при помощи гелей, основанный на различиях в размере молекул. Является вариантом жидкостно-жидкостной хроматографии, когда и подвижной, и неподвижной фазами служат разные жидкости. Но в отличие от нее в гель-фильтрации подвижной и неподвижной фазами служит одна и та же жидкость. При этом та часть жидкости, которая протекает вдоль слоя гранул геля, служит подвижной фазой, а другая часть той же жидкости, проникающая в поры гранул геля, - неподвижной. Гель-фильтрация осуществляется с помощью молекулярных сит – инертных гидратированных материалов, представляющих собой пористые гранулы. Их получают на основе декстрана (сефадекса – бактериального полисахарида), агарозы (из некоторых морских водорослей), акриламидных гелей (акрилекс) или полиоксиэтилена (Toyopearl). Гель-фильтрацию проводят на колонках, заполненных гранулами набухшего геля. Неподвижная фаза представлена жидкостью, находящейся внутри пористых гранул, - точно такой же, как и жидкость подвижной фазы, протекающей между ними. Благодаря адгезии с поверхностью пространственной сетки полимера, образующего гранулы, жидкость внутри них остается неподвижной и не увлекается потоком подвижной фазы.
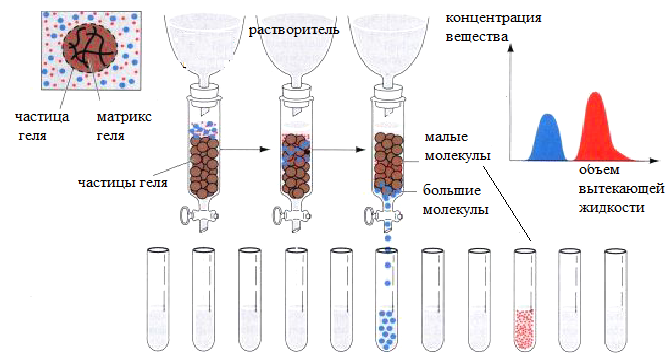
В процессе элюирования молекулы, размер которых превышает размер пор гранул (высокомолекулярные соединения), не проникают в гранулы геля и движутся с высокой скоростью вместе с растворителем только в пространстве между гранулами и первыми выходят из колонки. Молекулы, размер которых меньше размера пор гранул (низкомолекулярные соединения), диффундируют в гранулы и обратно, поэтому их вымывание растворителем (элюирование) из колонки замедляется. Поскольку степень диффузии в гранулы геля зависит от размеров молекул, вещества элюируются с колонки в порядке уменьшения их молекулярной массы. Чем меньше молекулярная масса вещества, тем больший объем элюента требуется для вымывания его из колонки. Схема гель-фильтрации представлена на рис. 11.
Рис. 11. Принцип гель-фильтрации
Распределение вещества по колонке, заполненной гранулами геля, зависит от общего объема растворителя внутри и снаружи гранул геля. Это распределение определяется коэффициентом распределения Kav, который зависит от размера молекул вещества.
Коэффициент распределения Kav (available – доступный) характеризует движение хроматографической зоны вещества вдоль колонки при гель-фильтрации и определяет долю пор гранул геля, которую может занимать данный белок. Kav определяется соотношением:
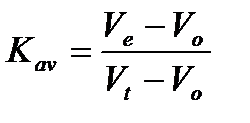 ,
,
где Ve – объем элюирования данного белка, мл; Vo – свободный объем колонки (объем жидкости между гранулам геля), мл; Vt – объем пустой колонки, мл.
Как видно из соотношения, Kav прямо пропорционален объему элюирования данного белка. Для крупных молекул, двигающихся по колонке в свободном объеме и отсутствующих в растворителе внутри гранул геля, Kav = 0 (Ve = Vo). Для мелких молекул, равномерно распределяющихся в растворителе внутри и снаружи гранул геля и требующих большого объема элюирования, Kav = 1. Молекулы средних размеров частично проникают в гранулы геля и для них 0 < Kav < 1. Они движутся вдоль колонки быстрее, чем мелкие молекулы, но медленнее, чем крупные, и для них оказывается доступной только часть объема неподвижной фазы. Следовательно, скорости перемещения отдельных белков по колонке обратно пропорциональны их коэффициентам распределения.
При определении молекулярной массы исследуемого белка предварительно проводят калибровку колонки, пропуская через нее белки с известной молекулярной массой (белки-маркеры) в тех же условиях, и определяют объемы элюирования для каждого из них. На основании этого строят калибровочный график зависимости молекулярной массы (в логарифмической шкале) белков-маркеров от объема элюирования или связанных с ним параметров, например коэффициента распределения белка между подвижной и неподвижной фазами Kav. Этот параметр в отличие от объема элюирования более стабилен и не зависит от объема колонки.
Определение гомогенности выделенного белка. Для характеристики гомогенности выделенного белка используют метод электрофореза. Электрофорез – метод, в основе которого лежит перемещение белковых молекул в электрическом поле.
Молекула белка в растворе при любом значении рН, отличающемся от изоэлектрической точки данного белка, имеет определенный суммарный заряд, который обусловлен наличием функциональных групп боковых цепей аминокислотных остатков, способных к электролитической диссоциации. Кроме того, молекулы белков с близкими по величине зарядами, но различающимися молекулярными массами отличаются друг от друга отношением массы к заряду. Под действием внешнего электрического поля заряженные молекулы белка перемещаются к противоположно заряженному полюсу (катоду или аноду) в зависимости от знака их суммарного заряда. Такое явление носит название электрофореза. Скорость движения катионов к катоду и анионов к аноду зависит от соотношения между движущей силой электрического поля, действующей на заряженные ионы, и замедляющими движение ионов силами взаимодействия между молекулами и окружающей средой, в основном силами трения и электростатическими силами.
Мерой электрофоретической подвижности белков является скорость их движения, см/с, при напряженности электрического поля 1 В/см. Знак величины электрофоретической подвижности совпадает со знаком суммарного заряда белка.
Электрофоретическая подвижность заряженных молекул зависит от их заряда, молекулярной массы (размера) и формы. Эта величина возрастает с увеличением суммарного заряда молекулы, который зависит от рН среды. Чем крупнее молекулы, тем меньше их подвижность. Это связано с возрастанием сил трения и электростатических взаимодействий крупных молекул с окружающей средой по сравнению с молекулами меньших размеров. Молекулы одинакового размера, но различной формы, например фибриллярные и глобулярные белки, также обладают разной подвижностью, что обусловлено различиями в силе трения и электростатических взаимодействиях.
Тема 4. Химический синтез и химическая модификация белков и пептидов
Пептидный синтез – это построение пептидной цепи путем соединения аминокислот с помощью химических методов. Обычно речь идет о получении пептидов, содержащих до 40 - 45 аминокислот, таким способом можно осуществить синтез и небольших белков.
В зависимости от используемых методических приемов и характера синтезируемого конечного продукта различают следующие типы пептидного синтеза:
1) классический пептидный синтез в растворе, подразделяемый на ступенчатый синтез линейных пептидов, осуществляемый последовательным присоединением аминокислот от С-конца к N-концу цепи, и на блочный синтез линейных пептидов, когда построение цепи ведется из предварительно синтезированных фрагментов;
2) синтез пептидов на полимерном носителе, при этом растущая полипептидная цепь ковалентно присоединена к нерастворимому или растворимому полимеру и отделение ее от полимера осуществляется на завершающей стадии синтеза. При использовании нерастворимого носителя принято говорить о твердофазном синтезе, существующем в настоящее время в полностью автоматизированном варианте. Созданные для этих целей приборы получили название синтезаторов. В некоторых случаях оказывается целесообразным использовать жидкофазный синтез на основе растворимых полимеров;
3) синтез гомо- и гетерополиаминокислот, построенных из повторяющихся остатков одной-двух аминокислот путем полимеризации или сополимеризации производных аминокислот (N-карбоксиангидридов и т. п.);
4) ферментативный пептидный синтез, т. е. синтез пептидов с помощью ферментов. Хотя идея такого синтеза весьма привлекательна и многие ферменты способны катализировать образование пептидной связи (реакции, обратной протеолизу), существенных результатов пока этим методом получить не удалось;
5) полусинтез пептидов, заключающийся в использовании методов пептидного синтеза для модификации природных пептидов. Обычным приемом является отщепление в молекуле природного пептида или белка небольшого фрагмента, а затем введение новой аминокислотной последовательности;
6) синтез циклических пептидов, осуществляемый замыканием линейного пептида в цикл соответствующей величины различными способами;
7) синтез гетеродетных пептидов, построенных с участием как амидных связей, так и связей другого типа – сложноэфирных, тиоэфирных, дисульфидных.
Пептидный синтез включает следующие последовательные стадии:
· защита карбоксигруппы аминокомпоненты;
· защита аминогруппы карбоксикомпоненты;
· защита карбокси- и аминогрупп боковых цепей;
· активация карбоксигрупппы карбоксикомпоненты;
· синтез, образование пептидной связи;
· удаление (снятие) защитных групп;
· выделение пептида.
Дата добавления: 2015-12-22; просмотров: 5673;
