КАК ПОДТОЛКНУТЬ РЕАКЦИЮ
Триумфальное вторжение термодинамики в химию в 70‑х и 80‑х годах XIX века, описанное в двух предыдущих главах, проходило не всегда гладко.
Я уже говорил, и еще не раз повторюсь, что реакции соединения водорода с кислородом (как и углерода с кислородом) сопутствует сильное снижение теплового содержания и свободной энергии; эта реакция является спонтанной. Однако я уже упоминал, хотя и не заостряя на этом внимания, что для того, чтобы смесь водорода с кислородом воспламенилась, ее надо поджечь, то есть, чтобы началось это, предположительно, спонтанное соединение, реакцию надо подтолкнуть. В отношении реакции соединения углерода с кислородом это положение еще более справедливо. Ни одному хозяину загородного дома не приходит в голову волноваться, что уголь в его подвале вдруг начнет самостоятельно вступать в реакцию с атмосферным кислородом, пока не окажется в камине. И даже в камине изначально разжечь огонь не так‑то просто.
Почему так происходит? Если графики изменения свободной энергии, которые я приводил в предыдущей главе, хоть в какой‑то степени отражают реальность, то, по идее, реакция водорода с кислородом должна начаться немедленно, как только они вступают в соприкосновение. Если провести аналогию с механикой, то шар, будучи положенным на верхнюю точку наклонной плоскости, должен сразу же покатиться вниз, не нуждаясь в дополнительном толчке. Почему же тогда спонтанной химической реакции нужен толчок в тепловом виде? Что не так с принципами динамической термодинамики?
Один из ответов на этот вопрос заключается в том, что термодинамика может указать направление, в котором пойдет та или иная химическая реакция, но не ее скорость. Иными словами, водород и кислород, содержащиеся в воздухе, на самом деле все же соединяются, и уголь в подвале тоже вступает в соединение с атмосферным кислородом. Однако и тот и другой процессы происходят настолько медленно, что не влекут за собой никаких заметных внешних изменений даже за очень долгий период времени.
Это звучит как принципиально непроверяемая гипотеза, теоретическая отговорка, но, к счастью, имеются и подтверждающие эту теорию факты. Бумага, состоящая из сложных молекул, в состав которых входят атомы углерода, водорода и кислорода, вступает с кислородом в реакцию, при которой происходит снижение уровня свободной энергии. В случае, когда она горит, испуская тепло и свет, это очевидно, и понятно, что реакция эта спонтанна. Однако без предварительного поджигания бумага, кажется, в соединение с кислородом не вступает – по крайней мере, мы этого не видим. Но действительно ли не вступает? Может быть, стоит приглядеться повнимательнее, и мы сможем обнаружить эту реакцию?
Страницы любой книги со временем желтеют и крошатся. Края страниц, которые больше всего контактируют с воздухом, выглядят желтее и более хрупкими, чем внутренняя их часть. В целом бумага выглядит слегка опаленной. Она и является опаленной – все десятилетия неторопливого соединения с кислородом она очень медленно «горит».
Или вот еще более наглядный пример. Маслянистые вещества, молекулы которых состоят но большей части из углерода и водорода, вступают в соединение с кислородом в ходе реакции, которая приводит к снижению свободной энергии и, разумеется, к производству тепла. Без поджигания эта реакция происходит слишком медленно, чтобы быть замеченной.
Однако сами по себе маслянистые вещества плохо проводят тепло. Если хранить кучу промасленных тряпок в плохо проветриваемом помещении, то тепло, вырабатывающееся с микроскопической скоростью в результате вялотекущих реакций соединения масла и кислорода, не удаляется ни с потоком воздуха, ни через теплопроводность среды. Оно потихоньку, очень медленно, начинает накапливаться. По мере его накопления и подъема температуры возрастает и скорость, с которой проходит реакция. В результате этого тепло начинает накапливаться уже быстрее, температура повышается тоже быстрее, и в конце концов тряпки действительно загораются. Склад охватывает пожар, с ним вместе может сгореть и дом, а пожарные впоследствии скажут – «самовозгорание» и прочтут очередную лекцию о правилах пожарной безопасности при хранении горючих материалов.
Так что, похоже, спонтанные реакции действительно спонтанны. Необходимость объяснять их очевидное «нежелание» начинаться не свидетельствует о некоей принципиальной погрешности термодинамики как таковой, а лишь является проявлением принципа, который станет нам ясен после более тщательного изучения скоростей прохождения реакций (эта область называется «химической кинетикой»). Почему реакция происходит просто незаметно при одних условиях и со взрывообразной скоростью при других?
Первый закон, открытый в области химической кинетики, гласит, что чем выше температура, тем быстрее проходят все химические реакции. Это знакомо каждому на основе личного опыта, и даже в доисторическую эпоху люди знали, что чем жарче огонь, тем быстрее могут выполняться работы по приготовлению пищи, металлургии, изготовлению стекла и так далее. В области менее высоких температур можно указать, что, например, фруктовый сок гораздо быстрее забродит в теплой комнате, чем в снежном сугробе. Однако от «общих знаний» еще далеко до формулировки принципа на основе точных измерений при контролируемых условиях – а ведь только последнее что‑то значит в науке.
В 80‑х годах XIX века разные химики проводили эксперименты по осуществлению различных химических реакций при различных температурах и измеряли точное время реакции. Оказалось, что повышение температуры на 10° приводит к ускорению реакции приблизительно вдвое.
В рамках кинетической теории это звучит разумно. Химическая реакция между двумя веществами не сможет толком происходить, если молекулы этих веществ не будут сталкиваться. По мере повышения температуры движение молекул ускоряется (см. главу 6), и каждую секунду происходит большее количество столкновений, поэтому и вся реакция в целом проистекает быстрее.
Но подождите‑ка! Мы знаем, что средняя скорость движения молекул возрастает пропорционально квадратному корню абсолютной температуры. Скажем, повышение ее с 20 °С до 30 °С по абсолютной шкале будет означать лишь повышение с 293 °К до 303 °К, то есть всего на несколько процентов'. А если скорость движения молекул повышается так мизерно, почему вдруг скорость реакции должна при этом удвоиться?
Кроме того, возникает и другой вопрос. Если медленно нагревать смесь водорода и кислорода, то практически ничего не изменится, пока температуpa смеси не достигнет 600 °С. А тогда мы вдруг становимся свидетелями взрывообразной реакции!
На первый взгляд странно. Если скорость реакции при повышении температуры на 10° увеличивается примерно вдвое, то логично предположить, что по мере нагревания водород с кислородом будут вступать в соединение с равномерно увеличивающейся скоростью. Да, при столь высокой температуре она вполне может достигать наблюдаемой скорости, но и на подходе к ней реакция ведь тоже должна протекать, причем все быстрее? А вместо этого скорость реакции скачкообразно переходит от состояния «слишком медленная, чтобы измерить» к состоянию «слишком быстрая, чтобы измерить». Почему так?
Давайте еще раз взглянем на составляющие химической реакции – это можно сделать на примере все той же реакции соединения водорода и кислорода в смеси двух газов.
До сих пор, говоря о соединении водорода с кислородом, я не затрагивал особых подробностей. Я только сказал, что на входе мы имеем смесь газообразных водорода и кислорода с одним содержанием свободной энергии, а на выходе получаем воду с другим, значительно более низким содержанием. Этих сведений до сих пор было достаточно, но теперь надо разобраться и в самом процессе реакции. Понятно ведь, что молекулы водорода и кислорода не превращаются в молекулы воды по мановению волшебной палочки. Разумеется, это процесс, состоящий из нескольких этапов, каждый из которых требует определенного времени.
Представим себе, что исходный водород – это газ, состоящий из молекул, каждая из которых представляет собой два атома водорода, соединенных химической связью. Такую молекулу можно обозначить как НН. Точно таким же образом и кислород состоит из молекул, каждая из которых представляет собой два атома, удерживаемые воедино такой же химической связью, – обозначим их как ОО. А получаемая в итоге вода, как показывает практика, состоит из молекул, где один атом кислорода находится между двумя атомами водорода (НОН).
Но для того чтобы поместить атом кислорода между двумя атомами водорода, необходимо сначала, чтобы связь этих двух атомов между собой распалась. И для того, чтобы этот единственный атом кислорода смог встроиться в молекулу воды, он тоже должен сначала оторваться от своего собрата по молекуле кислорода.
Соответственно, прежде, чем речь зайдет об образовании воды, должны произойти следующие реакции:
Н2 → 2Н,
O2 → 2O.
Но при подобном разложении молекул на свободные атомы, как уже указывалось в главе 7, уровень свободной энергии заметным образом возрастает.
Если посмотреть на соединение водорода и кислорода с этой точки зрения, то станет ясно, что на самом деле речь идет о двух различных реакциях. Первая из них – это превращение молекул водорода и кислорода в свободные атомы этих же элементов, а вторая – соединение этих свободных атомов в молекулы воды. При этом изменение уровня свободной энергии происходит так, как изображено на рис. 15.
Если посмотреть на рис. 15 на уровень свободной энергии смеси молекулярного кислорода и молекулярного водорода (А) и сравнить его с уровнем свободной энергии воды (В), то кажется, что этот уровень должен в ходе реакции равномерно снижаться. Однако если принять во внимание наличие промежуточной стадии смеси атомного водорода с атомным кислородом, то станет очевидно, что на этой стадии мы будем иметь уровень свободной энергии значительно более высокий (X), чем и в начальной (А), и в конечной (В) точках. Неудивительно, что заставить водород и кислород соединиться – непростая задача. Используя аналогии из мира механики, можно сказать, что это то же самое, что заставить шар скатиться вниз из точки А в точку В не по ровной наклонной плоскости, а минуя на своем пути гору, вершина которой находится выше исходной точки.
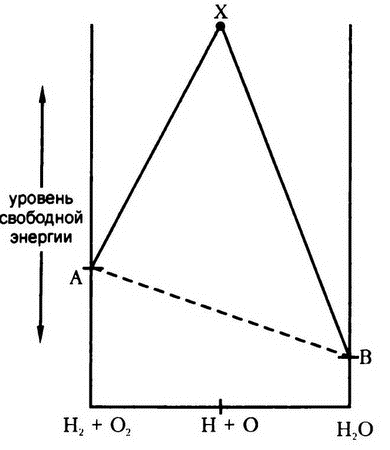
Рис. 15. Соединение водорода с кислородом: две стадии
Тогда возникает следующий вопрос. Почему же тогда водород с кислородом вообще вступают в реакцию? В главе 7 я упоминал, что даже при температуре 3500 °С менее половины молекул водорода и кислорода распадаются на атомы – а смесь газов почему‑то вступает во взрывообразную реакцию уже при 600 °С.
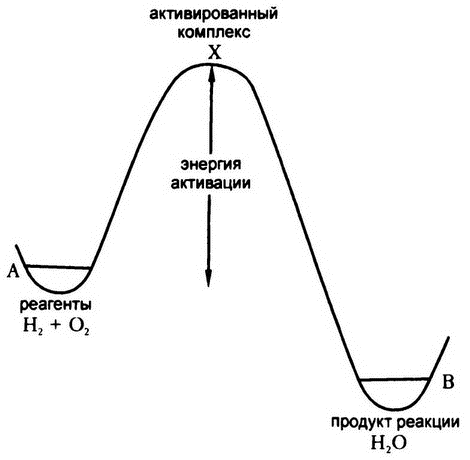
Рис. 16. Энергия активации
Ответ прост: а нам и не надо, чтобы вообще все молекулы водорода и кислорода в смеси распались на атомы. Для запуска процесса реакции достаточно образования лишь небольшого количества свободных атомов обоих веществ.
На самом деле на графике не будет наблюдаться острого пика, поскольку точка X будет достигнута лишь в том случае, если смесь полностью будет состоять из отдельных атомов водорода и кислорода. В реальности при обычных условиях молекулярные водород и кислород в процессе образования воды никогда не проходят через такое состояние. Даже в самом приближенном к идеалу случае лишь малая часть системы состоит из свободных атомов, поэтому этот промежуточный пиковый уровень свободной энергии на самом деле проходит куда более плавно. На графике (рис. 16) ему будет соответствовать скорее не горный пик, а покатый бугорок. Но если вернуться к нашей аналогии, то для катящегося шара и покатый бугорок – достаточно серьезная преграда. Шар придется хорошенько толкнуть, чтобы он закатился на бугорок, прежде чем покатиться вниз самостоятельно уже до самого конца. То же самое относится и к химической реакции.
В 1889 году шведский химик Сванте Август Аррениус вывел общую математическую формулу для описания подобных процессов, и оказалось, что подобный «бугорок» наблюдается при описании не только реакции соединения водорода с кислородом, но и вообще всех химических реакций. Энергию, которую необходимо привнести в систему для того, чтобы общего уровня свободной энергии оказалось достаточно для поднятия реакции «на вершину», по достижении которой далее она будет протекать уже спонтанно, сейчас принято называть «энергией активации».
Самый простой способ привнести в систему дополнительную энергию для запуска реакции – это нагреть реагирующие вещества. Если смесь водорода и кислорода нагреть до соответствующей температуры, она взрывается; если бумагу или промасленные тряпки нагреть до соответствующей температуры, они загораются. С этого момента реакция живет собственной жизнью и протекает спонтанно, не требуя более никакого приложения внешних усилий.
Из наших рассуждений может показаться, что химические реакции происходят по принципу «все или ничего», то есть до тех пор, пока энергии системы недостаточно для преодоления пика, реакция вообще не будет идти, а потом, по мере добавления необходимого количества тепла, внезапно начинается реакция. Это вполне логичное предположение, которое можно сделать исходя из того, что смесь водорода с кислородом при одной температуре пребывает в стабильном состоянии, а при другой – внезапно взрывается, а бумага и промасленная ветошь при одной температуре спокойно лежат себе, а при чуть более высокой – вдруг вспыхивают ярким пламенем.
Но это упрощенная точка зрения. Я уже говорил о том, что на самом деле и бумага, и промасленная ветошь все‑таки вступают в реакцию соединения с кислородом при комнатной температуре, просто очень медленно, и что так же ведут себя, по‑видимому, и водород с кислородом. А ведь при комнатной температуре энергетическое содержание системы гораздо ниже, чем требуется для достижения энергии активации. Почему же в этих случаях тем не менее происходит соединение?
Давайте еще раз рассмотрим смесь водорода с кислородом, четко обозначив при этом температуру равную комнатной – скажем, около 25 °С.
Формулы Максвелла–Больцмана (которые я уже упоминал в главе 6) можно использовать для расчета наиболее вероятной скорости и, соответственно, наиболее вероятной кинетической энергии молекул газа при заданной температуре. Произведя этот расчет, мы удостоверимся, что энергии имеется гораздо меньше, чем требуется для разрыва связей между атомами в молекулах водорода или кислорода. Две молекулы, имеющие среднюю для температуры 25 °С энергию, после столкновения просто разлетятся в стороны. Какое‑то количество энергии может перейти от одной из них к другой, но обе останутся целыми.
Однако нельзя забывать, что формулы Максвелла–Больцмана позволяют узнать лишь наиболее вероятную энергию молекул – они не могут универсальным образом описывать энергию каждой из них. При любой температуре разброс энергетического содержания между молекулами одного и того же вещества огромен. Энергия большинства молекул близка к средней, но некоторое меньшинство может обладать энергией гораздо больше средней. И в любом множестве молекул всегда найдется немного таких, которым посчастливилось набрать достаточно энергии для самопроизвольного расщепления на атомы. Энергия, имеющаяся у этих молекул, явно не меньше энергии активации. Атомы, высвобождающиеся из этих молекул, вполне могут принимать участие в реакциях как друг с другом, так и, что более вероятно, с еще целыми молекулами для образования воды.
Поэтому даже при комнатной температуре имеется некоторое количество молекул водорода и кислорода, проходящих порог энергии активации и предоставляющих в итоге свободные атомы для образования молекул воды. Процент таких молекул настолько мал, что скорость образования воды оказывается неизмеримо более медленной.
Однако по мере повышения абсолютной температуры среднее энергетическое содержание молекул пропорционально возрастает. Повышение температуры с 20 °С до 30 °С, как я уже говорил, в процентном соотношении выражается в крайне незначительном увеличении средней скорости молекул, но при этом количество молекул, обладающих энергией больше пороговой, увеличивается вдвое, а то и втрое (рис. 17). Можно провести такую аналогию: если лето выдается жарким, то, подсчитав среднесуточную температуру, мы обнаружим, что она всего на 1 °С выше, чем обычно, но при этом жарких дней, то есть таких, когда температура достигала бы 32 °С, по подсчетам окажется в два‑три раза больше.
Скорость реакции зависит не от среднего уровня энергии молекул, а от количества молекул, обладающих энергией не меньшей, чем энергия активации. Поэтому она и удваивается с повышением температуры на каждые 10 градусов.
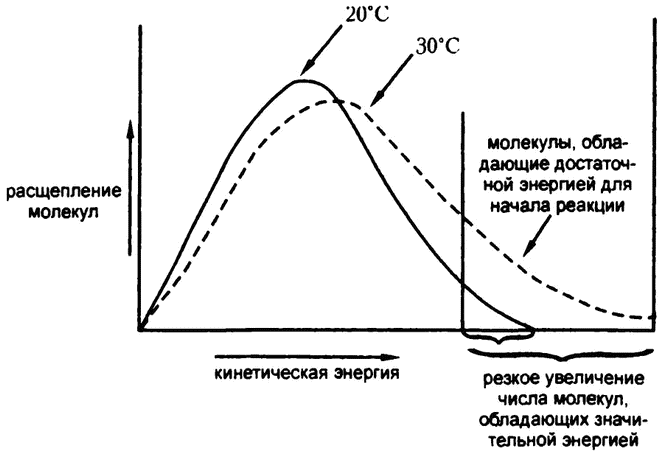
Рис. 17. Температура и скорость реакции
Если говорить конкретно о реакции соединения водорода с кислородом, то при комнатной температуре скорость реакции настолько мизерна, что ее можно очень долго удваивать путем повышения температуры без того, чтобы она достигла сколько‑нибудь заметного уровня. Однако далеко не для всех реакций энергия активации столь велика. Для многих реакций уже при комнатной температуре энергия значительной части молекул участвующих в них веществ окажется достаточной для того, чтобы преодолеть этот довольно невысокий порог, и реакция протекает с вполне измеримой скоростью. Именно на материале таких реакций с низким порогом химики 1880‑х годов получили те данные, которые были им необходимы для измерения возрастания скорости реакции по мере увеличения температуры.
Что ж, допустим, что такое объяснение может оказаться удовлетворительным ответом на вопрос о «слишком медленных» реакциях, но что же сказать в таком случае о реакциях взрывообразных? Чем обусловлен внезапный перескок от реакции «слишком медленной для измерения» к реакции «слишком быстрой для измерения»?
Загадочным такое положение дел будет казаться лишь до тех пор, пока мы не обратим внимание на тот факт, что тепло может поступать в систему не только извне. Образование молекул воды из свободных атомов – реакция экзотермическая, при ней тоже выделяется тепло. Правда, вырабатывается его немного, температура в результате выделения тепла повышается незначительно, к тому же смесь газов быстро избавляется от излишков тепла через излучение, и общая температура системы остается стабильной.
Однако если систему начать подогревать снаружи, то ее температура станет возрастать, количество соединений – увеличиваться, а с ними вместе и объем вырабатываемого при соединениях тепла. В определенный момент количество вырабатываемого за секунду тепла превысит возможности газа по излучению тепла за ту же секунду, и излишек вырабатываемого при реакции тепла будет теперь оставаться в той же системе, повышая тем самым температуру системы еще больше. Это, в свою очередь, приведет к дальнейшему ускорению реакции, и получится замкнутый круг – чем выше температура, тем интенсивнее реакция, а чем интенсивнее идет реакция, тем выше поднимается температура.
То есть стоит один раз нарушить равновесие, и система уже сама начнет уходить от него все дальше. До определенного порогового уровня смесь водорода с кислородом кажется спокойной; по его достижении, когда излучение уже не справляется с теплоотводом и равновесие оказывается нарушенным, темпы реакции внезапно ускоряются настолько, что экспериментатор даже не успевает отключить внешний источник тепла.
По тому же принципу, только в меньшем масштабе, запускается и процесс горения бумаги. Предположим, что к уголку бумаги поднесли спичку. На этом уголке бумага получила энергию активации, и реакция горения оказалась запущенной, молекулы, из которых состоит бумага, принялись активно соединяться с кислородом, производя при этом тепло. Этого тепла оказывается вполне достаточно, чтобы придать энергию активации соседним молекулам бумаги, которые, в свою очередь, сгорая, тоже вырабатывают тепло, и так далее. Спичка давно уже догорела, но ее пламя к этому моменту уже не нужно. Бумага продолжает гореть уже самостоятельно и будет гореть, пока не закончится. Все прекрасно знают, что один‑единственный непогашенный окурок может предоставить изначальное количество энергии достаточное, чтобы спалить много гектаров леса.
Энергию активации той или иной реакции участвующие в ней вещества могут получить не только посредством притока в систему тепла. Вот пример: смесь водорода с хлором, будучи нагретой, взорвется еще охотнее, чем смесь водорода с кислородом, но при комнатной температуре она является вполне инертной, но только… в темноте! Если же на смесь водорода с хлором попадут лучи света, особенно яркого – например, дневного солнечного света или вспышки магниевой лампы, – то она взорвется и при комнатной температуре.
Такое действие света на смесь водорода с хлором первым подметил в 1801 году английский химик Уильям Крукшенк, и разрозненные наблюдения по поводу этого феномена отмечались на протяжении всего XIX века. Однако для полного его понимания необходимо было сначала получить правильное представление о природе света как такового, чего у физиков XIX века еще не было. Тут необходимо сделать небольшое отступление.
Современный подход к изучению света был заложен еще Исааком Ньютоном в 1660‑х годах. Ньютон показал, что солнечный свет можно разложить на разноцветные полоски (получившие название «спектр») с помощью треугольной призмы. Ньютон придерживался мнения о том, что свет – это поток бесконечно малых частиц, с огромной скоростью разлетающихся во все стороны прочь от своего источника. (Впервые скорость света более‑менее точно установил в 1671 году датский астроном Оле Рёмер. Сейчас известно, что она равняется 300 000 километров в секунду.)
Современник Ньютона, датский астроном Кристиан Гюйгенс выдвинул другую точку зрения, что свет – это волновое движение.
В XVIII веке большей популярностью обладала ньютоновская «корпускулярная» теория. Однако ряд экспериментов, проведенных в начале XIX века, позволил сделать четкий вывод о том, что свет все же состоит из волн, и, таким образом, прочно утвердилась «волновая» теория.
Длина каждой отдельной волны света крайне мала и меняется от одного цвета к другому. Точную «длину волны» можно высчитывать разными способами, и все они сходятся в том, что длина волны красного света лежит приблизительно около значения в 0,0000007 метра.
Понятно, что метр – слишком большая величина для измерения длины световых волн. Для этого используются единицы микрон (одна миллионная, 0,000001, метра) и миллимикрон (одна тысячная микрона, или одна миллиардная метра, 0,000000001). Шведский астроном Андерс Йонас Ангстрем, занимавшиися изучением света в середине XIX века, использовал единицу в одну десятую миллимикрона, или одну десятимиллиардную (0,0000000001) метра. Эта единица получила в его честь название «ангстрем», что записывается как Å, и, таким образом, длина волны красного света равняется примерно 7000 Å (рис. 18).
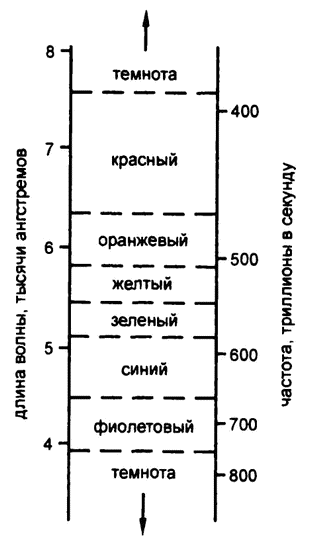
Рис. 18. Спектр видимого света
Длина волны света постоянно колеблется, и цвет ее неуловимо меняет оттенки. При длине волны 6000 Å свет четко оранжевый, при около 5700 Å – уже желтый, при 5300 Å – зеленый, при 4800 Å – синий, при 4200 Å – фиолетовый. Конечно, значения, которые здесь приведены, – средние. Все цвета плавно и незаметно переходят друг в друга, а крайние цвета спектра – в темноту, красный – где‑то после 7600 Å, а фиолетовый – после 4000 Å.
Кроме длины волны, не менее важен такой параметр, как «частота», то есть количество волн, попадающих в глаз (или в прибор) в секунду. За секунду свет проходит 300 000 километров, или около 3 000 000 000 000 000 000 ангстрем. Соответственно количество волн самой большой длины (красных), находящихся на этом участке, равняется 3 000 000 000 000 000 000 / 7600, то есть около 400 000 000 000 000. Значит, за секунду на глаз попадает около четырех триллионов волн красного света – такова его частота.
Понятно, что чем меньше длина волны, тем большее количество волн попадает в этот отрезок. То есть чем короче волна, тем выше ее частота. Частота волны фиолетового спектра, самой короткой из видимых световых волн, равна примерно 730 000 000 000 000, то есть почти в два раза выше, чем частота волны красного света.
Приблизительно в 1860 году Максвелл принялся за изучение электрических и магнитных сил, которые проявляют свое действие на некотором расстоянии от магнитного или электрического заряда. Его выводы показали, что электричество и магнетизм неразрывно связаны и создают в пространстве единое электромагнитное поле. Более того, он продемонстрировал и то, что любой колеблющийся электрический заряд излучает энергию («электромагнитное излучение») в волновой форме с частотой равной частоте своих колебаний. Эта энергия движется в пространстве со скоростью света.
Для Максвелла сходство между этой теоретически выведенной скоростью электромагнитного излучения и уже известной скоростью света оказалось слишком разительным, чтобы рассматривать его как случайное совпадение. Он решил, что свет – это одна из разновидностей электромагнитного излучения.
Конечно, возникает вопрос – каким же должен быть заряд, чтобы создавать колебания частотой в сотни триллионов, и на это Максвеллу ответить было нечего. Ответить на подобный вопрос смогли лишь в 90‑х годах XIX века, когда было открыто внутреннее строение атома. Именно тогда голландские физики Хендрик Антон Лоренц и Питер Зееман смогли продемонстрировать, что генераторами колебания служат несущие электрический заряд электроны, вращающиеся по внешним орбитам атомов. Именно изменения уровня энергии этих электронов и запускают световые волны.
Далее. Максвеллу показалось логичным, что заряды могут колебаться с любой частотой, а следовательно, и электромагнитные колебания могут быть любой частоты. Отсюда следовал вывод о существовании излучений с меньшей частотой и большей длиной волны, чем у красного света, и, наоборот, с большей частотой и меньшей длиной волны, чем у фиолетового.
Сейчас уже действительно открыты и инфракрасный, и ультрафиолетовый спектры излучения. Глаз их не воспринимает, так что свет этих спектров для нас невидим, но в физическом отношении эти излучения вполне реальны. Примерно в 1800 году английский астроном немецкого происхождения Уильям Гершель поместил градусник под облучение невидимым глазу светом частотой чуть меньше красного, и градусник стал нагреваться даже быстрее, чем при облучении видимым светом, из чего стало ясно, что излучение содержит энергию.
Примерно в то же время немецкий физик Иоганн Вильгельм Риттер обнаружил, что воздействие синего и фиолетового света приводит к распаду нитрата серебра на металлическое серебро и вещество становится из белого черным; но, кроме того, оказалось, что невидимые лучи той части спектра, которая находится сразу за фиолетовой, приводят к тому же результату еще быстрее! Так было доказано содержание энергии и в ультрафиолетовой части спектра.
Однако и инфракрасное и ультрафиолетовое излучения лежат все же достаточно близко к видимой части спектра, а по теории Максвелла предполагалось существование излучения и в удаленных от нее частях. При его жизни существование таких видов излучения экспериментально установлено не было.
Максвелл, умерший в 1878 году в возрасте всего сорока восьми лет, не дожил до дня подтверждения своей теории на практике. Однако уже через восемь лет, в 1886 году, немецкий физик Генрих Рудольф Герц построил электрическую цепь, в которой электрический ток вызывал колебания с крайне низкой частотой, что, по теории Максвелла, должно было привести к образованию излучения с такой же низкой частотой и соответственно большой длиной волны. И Герцу действительно удалось зафиксировать такое излучение – нам оно известно под именем радиоволн.
Частота радиоволн – от 1 000 000 и ниже. Частота коротких радиоволн доходит до 10 000 000 000 (десяти миллиардов). Радиоволны постепенно переходят в микроволны, те – в волны инфракрасного спектра, а те, в свою очередь, – в волны видимой части спектра. Все переходы происходят плавно и незаметно, разрывов, то есть таких значений частоты, для которых не существовало бы волны, в этой цепочке нет.
Что же мы можем сказать про вторую половину спектра излучения? В 1895 году немецкий физик Вильгельм Конрад Рентген открыл новый вид излучения. Он называл его «лучами X», а нам оно известно под названием «рентгеновского излучения», по имени первооткрывателя. Частота этого излучения оказалась гораздо выше, чем частота излучения ультрафиолетового, порядка миллионов триллионов. Как выяснилось позже, источник этого излучения запускался изменением энергетического уровня электронов, вращающихся на внутренних орбитах атома. А год спустя обнаружилось, что элемент уран испускает неизвестное до тех пор излучение, оказавшееся тоже разновидностью электромагнитного излучения с частотой еще выше, чем у рентгеновского, – порядка миллиардов триллионов. Это излучение получило название «гамма‑лучей». Его источником оказалось изменение энергетического уровня заряженных частиц самого ядра атома.
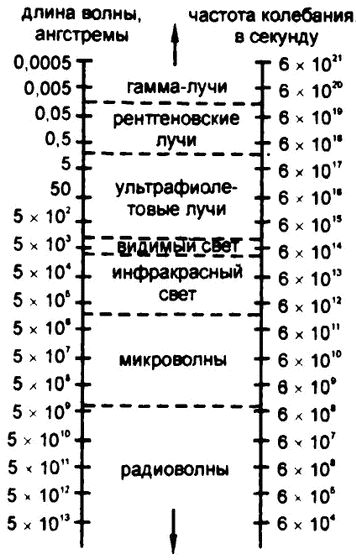
Рис. 19. Электромагнитный спектр
В этой части спектра мы видим ту же картину, которая описывалась выше для «низкочастотного» излучения: гамма‑лучи плавно переходят в рентгеновское излучение, рентгеновское – в ультрафиолетовое, а ультрафиолетовое – в видимую часть спектра. Полностью весь электромагнитный спектр (рис. 19) содержит около 60 октав (октава – это отрезок, на протяжении от начала до конца которого частота удваивается). Из них видимая часть спектра – это всего лишь одна октава. К 1900 году теория Максвелла подтвердилась полностью.
Свет – это форма энергии, но, как стало ясно с наступлением XIX века, энергетическое содержание света различных участков спектра не одинаково. Привести к распаду серебросодержащих соединений с образованием металлического серебра может только действие «высокочастотного» синего и фиолетового света. Сколько ни облучай нитрат серебра «низкочастотным» красным светом, ничего не произойдет.
Этот и множество других примеров ясно показывают, что энергетическое содержание высокочастотных световых волн выше, чем низкочастотных. Ультрафиолетовое излучение было обнаружено только благодаря тому, что еще эффективнее, чем любой свет видимой части спектра, разлагало серебросодержащие элементы. Кроме того, ультрафиолетовые лучи могут обжечь кожу. Рентгеновские лучи проникают в вещество глубже, а гамма‑лучи – еще глубже, и оба этих вида излучения вызывают в организме реакции (очень вредоносные), требующие приложения большого количества энергии.
Тот факт, что излучение с высокими частотами несет больше энергии, подтверждается и свойствами нагретых предметов. Часть энергии, приобретаемой ими с теплом, отдается наружу посредством излучения. Чем выше поднимается температура, тем выше частота испускаемого излучения. Таким образом, нагреваемый кусок металла начинает испускать излучение (и поднесенная к нему рука будет чувствовать тепло или даже жар), оставаясь при этом абсолютно невидимым в темноте. Испускаемое им излучение лежит в инфракрасной части спектра. По мере повышения температуры он начинает излучать уже и в видимой части, и мы замечаем исходящее от него тускловатое красное свечение. Для того чтобы «раскалиться докрасна», металлу необходимо нагреться примерно до 650 °С.
При еще более высоких температурах частота излучения продолжает возрастать, так что при температуре в 2000 °С металл, миновав стадию ярко‑красного, станет уже желтым. Солнце, температура на поверхности которого равна 5700 °С, «раскалено добела» и испускает в достаточно большом количестве ультрафиолетовые лучи. Некоторые звезды (правда, их немного среди общего числа) излучают в основном в синей и ультрафиолетовой частях спектра. Солнечная корона, температура которой более миллиона градусов, испускает даже рентгеновские лучи.
Интерес к подробностям излучения тел при различной температуре к концу XIX века становился все больше. Для упрощения было введено представление о существовании тела, которое поглощает все попадающие на него лучи, какую бы частоту они ни имели. Такой предмет не отражал бы никакого излучения и представлял бы собой, таким образом, идеально «черное тело». Если такое черное тело нагреть, оно стало бы с одинаковой легкостью испускать излучение всех частот. (Тело, не являющееся «черным», то есть поглощающее излучение лишь определенных частот, именно на этих частотах и будет излучать, если его нагреть.)
Но если черное тело при нагревании действительно будет с одинаковой легкостью излучать на всех частотах, то возникает парадокс, нуждающийся в объяснении. Высокочастотных видов излучения существует гораздо больше, чем низкочастотных (так же, как чисел более триллиона существует гораздо больше, чем чисел менее триллиона). Поэтому если свет может с равной вероятностью «выбирать» среди всех доступных частот, то практически все излучение должно происходить в высокочастотном спектре, а на долю немногочисленных низкочастотных значений должно приходиться очень мало. Однако при нагревании предметов, приближенных к идеальному «черному телу», такого не происходило. Даже при сравнительно высоких температурах большая часть излучения оказывалась лежащей в видимой и более низкочастотных частях спектра. Для получения высокочастотного излучения в более‑менее значительном объеме требовалось нагреть тело до весьма значительных температур.
Объяснения этому явлению не существовало вплоть до 1900 года, когда немецкому физику Максу Карлу Планку пришла в голову идея. А что, если излучение, как и материя, не является непрерывной и однородной субстанцией? Что, если излучение, как и материя, состоит из крошечных неделимых единиц? Для объяснения того факта, что высокочастотное излучение содержит больше энергии, чем низкочастотное, только и остается предположить, что оно состоит из единиц большего объема.
Планк назвал эти единицы энергии «квантами», от латинского «quantum» – «сколько», и предположил, что энергетическое содержание одного кванта пропорционально частоте излучения. Обозначив энергию как е, а частоту заданного излучения как ν (греческая буква «ню»), мы получим математическую формулу гипотезы Планка в виде
е = hν,
коэффициент пропорциональности которой h известен нам сейчас как «постоянная Планка».
Соответственно, не следует предполагать, что при нагревании предмета, будь это даже идеально черное тело, он будет с одинаковой вероятностью излучать на всех частотах. Частота гамма‑лучей в миллиард раз больше частоты инфракрасных лучей, значит, на образование кванта гамма‑излучения требуется в миллиард раз больше энергии, чем на образование кванта инфракрасного излучения. При низких температурах, когда энергетическое содержание предмета невелико, в нем могут образовываться вообще одни только кванты инфракрасного света. По мере роста температуры, а следовательно, и доступной для формирования квантов энергии в предмете начинают образовываться все более и более крупные кванты все более и более высокочастотного излучения. Вообще, только с использованием квантовой теории оказалось возможным точное описание свойств испускаемого черным телом излучения – ничто другое не позволяло добиться такого результата.
Теория эта оказалась настолько революционной, что в течение некоторого периода лишь немногие физики решились принять ее на вооружение. А затем в 1905 году Альберт Эйнштейн с помощью квантовой теории сумел объяснить механизм, путем которого некоторые металлы под воздействием света начинают испускать электроны.
Еще в конце XIX века было отмечено, что под лучами света некоторые металлы испускают электроны. Энергия испускаемых электронов зависела при этом не от силы света, а от его частоты. К примеру, красный свет, не важно, сколь сильный, не приводил к испусканию электронов вообще. Облучение желтым светом вызывало испускание лишь небольшого количества электронов с малым содержанием энергии. Если желтый свет был ярче и сильнее, электронов испускалось чуть больше, но их энергетическое содержание по‑прежнему оставалось небольшим. А вот облучение синим светом уже приводило к испусканию достаточно энергичных электронов. Если синий свет был очень слабым, то и электронов испускалось мало, но энергетическое содержание их было при этом все таким же высоким.
Эйнштейн указал, что такое положение дел становится вполне логичным, если предположить, что энергия может поглощаться только целыми квантами. Энергии маленького кванта красного света не хватает на то, чтобы вытолкнуть электрон, и, сколь сильным ни делай красный свет, испускания электронов не добьешься, потому что перед поглощением каждого следующего кванта атом всегда успевает избавиться от предыдущего. Чуть более крупные кванты желтого света при поглощении могут выбить электрон, обладающий слабой энергией, а еще более крупные кванты синего света – электрон с еще большим энергетическим содержанием.
И только тогда ученые наконец признали и приняли квантовую теорию Планка.
* * *
Вернемся же к нашей смеси водорода с хлором, чтобы посмотреть в свете свежеобретенного знания, что же делает с ней свет. Если смесь газов просто нагревать с помощью горячей плиты или даже пламени горелки, то излучение, с помощью которого в газ поступает тепло, будет в основном инфракрасным – в случае с горелкой лишь небольшая часть его будет находиться в видимой части спектра. Поэтому кванты его будут невелики. Расщепление молекул начнется лишь тогда, когда они наберут достаточно этих квантов для приобретения определенного уровня кинетической энергии.
А кванты сравнительно высокочастотных фиолетовых и ультрафиолетовых лучей, содержащихся в солнечном свете или магниевой вспышке, гораздо крупнее. Молекула хлора, два атома которой связаны слабее, чем в аналогичных молекулах водорода или кислорода, поглотив такой квант, сразу же набирает достаточно энергии для распада. Если обозначить квант за hν, то мы можем записать это так:
hν + Cl2 → Сl + Сl.
Каждый высвобожденный таким образом атом хлора может тут же вступить в реакцию с молекулой водорода для образования хлороводорода.
Но если бы это было все, то действием каждого кванта становилось бы образование двух молекул хлороводорода и общее количество квантов, необходимое для превращения смеси двух газов в хлороводород, равнялось бы количеству имеющихся в смеси молекул хлора.
На самом же деле излучения требуется гораздо меньше. Тщательное изменение количества поставляемой энергии и образуемого хлороводорода показало, что подача одного кванта энергии может привести к образованию от 10 000 до 1 000 000 молекул хлороводорода.
Поскольку энергии одного кванта для выполнения такой задачи явно недостаточно, то остается сделать вывод, что здесь не все так просто. Общепринятое сейчас объяснение этого факта впервые выдвинул специалист в области физической химии немец Вальтер Герман Нернст. Он предположил, что расщепление молекулы хлора квантом с высоким энергетическим содержанием – это лишь первый шаг. Каждый полученный таким образом атом хлора далее вступает в реакцию с молекулой водорода, в результате чего получается не только молекула хлороводорода, но и свободный атом водорода:
Сl + Н2 → HCl + Н.
Этот свободный атом водорода, в свою очередь, вступает в реакцию с молекулой хлора, в результате которой образуется опять один свободный атом хлора:
Н + Cl2 → HCl + Сl.
Этот атом хлора опять вступает в реакцию с молекулой водорода, полученный в ее результате атом водорода – в реакцию с молекулой хлора и так далее; и на каждом повторении этого цикла будет образовываться молекула хлороводорода.
Задача полученного системой кванта энергии – лишь запустить эту цепную реакцию.
Возникает вопрос: почему же тогда цепная реакция не продолжается до тех пор, пока не обработает все до единой молекулы водорода и хлора и не превратит в хлороводород всю смесь без остатка? Дело в том, что цепная реакция не бессмертна. Рано или поздно очередная итерация реакции совершится не с положенной по счету молекулой водорода или хлора, а с какой‑нибудь примесью – скажем, водой или кислородом. Необходимый для продолжения цепной реакции свободный атом хлора или водорода в этом случае образован не будет, и цепочка прервется.
Даже при полном отсутствии в реагирующих газах каких‑либо примесей (а очистить смесь до такого состояния, чтобы цепная реакция продлилась достаточно долго, – весьма сложная задача!) все равно остается вероятность того, что высвобожденный атом вступит в реакцию, скажем, с молекулой вещества, из которого состоит стенка камеры, или с другим таким же свободным атомом, объединившись с ним обратно в такую же молекулу, из которой они изначально распались. То есть даже при идеальных условиях цепная реакция не будет длиться вечно.
Понятно, что смесь газов, в которой вероятность длительного существования цепной реакции мала, останется в целом инертной при любом световом облучении. К примеру, на смесь водорода с кислородом световое облучение никакого заметного эффекта не оказывает. Даже если молекула газообразного кислорода и получит достаточно большой квант энергии, чтобы распасться, то получившиеся в результате свободные атомы кислорода присоединятся каждый к одной молекуле водорода, и на том все и кончится:
О + Н2 → H2O.
В подробности природы света и его воздействия на химические реакции я углубился лишь потому, что ближе к концу книги эти свойства света приобретут для нас решающее значение. Однако сейчас путь, которым мы терпеливо продвигаемся, уводит нас в сторону от этого предмета – навстречу другим, не менее интересным.
Глава 12.
Дата добавления: 2016-01-26; просмотров: 899;
