Элемент – Атомное число
Водород (Н) – 1
Гелий (Не) – 2
Углерод (С) – 6
Азот (N) – 7
Кислород (О) – 8
Фтор (F) – 9
Натрий (Na) – 11
Магний (Mg) – 12
Алюминий (Al) – 13
Фосфор (Р) – 15
Сера (S) – 16
Хлор (Cl) – 17
Калий (К) – 19
Кальций (Са) – 20
Хром (Cr) – 24
Марганец (Mn) – 25
Железо (Fe) – 26
Кобальт (Со) – 27
Никель (Ni) – 28
Медь (Си) – 29
Цинк(Zn) – 30
Серебро (Ag) – 47
Олово(Sn) – 50
Йод (I) – 53
Вольфрам (W) – 74
Платина (Pt) – 78
Золото (Au) – 79
Ртуть (Hg) – 80
Свинец (Pb) – 82
Радий (Ra) – 88
Торий (Th) – 90
Уран (U) – 92
Плутоний (Pu) – 94
Лоуренсий (Lw) – 103
На электрическую нейтральность атома эти изменения могут влиять, а могут и не влиять. К примеру, два атома, столкнувшись, могут поделиться друг с другом электронами вполне стабильным образом (подробнее об этом чуть позже). Это «предоставление» электронов одним атомом другому сохраняется только до тех пор, пока атомы сохраняют контакт между собой. Для того чтобы разъединить атомы, необходимо теперь будет разорвать их стабильную связь, а на это потребуется значительное количество энергии. Без получения этой энергии атомы, имеющие общие электроны, будут неопределенно долго оставаться вместе, и именно это и есть основа тех химических связей, о которых я говорил в предыдущих главах. В молекулах водорода, кислорода, воды, углекислоты, йодоводорода и многих других соединений атомы удерживаются вместе с помощью «общих» электронов.
При подобного рода перераспределении электронов атомы продолжают оставаться электрически нейтральными.
Однако бывает и так, что определенные электроны в атомах некоторых элементов держатся крайне слабо. К примеру, в атоме натрия самый удаленный электрон не слишком‑то прочно привязан к своему атому. Поэтому при соседстве с атомом хлора (который все собственные электроны удерживает очень крепко) самый удаленный атом натрия не то что становится «общим», а вообще переходит из атома натрия в атом хлора.
После такого перехода в атоме натрия остается всего 10 электронов, то есть на один электрон меньше, чем требуется, чтобы нейтрализовать положительный заряд 11 протонов ядра. Атом натрия теряет электрическую нейтральность. Теперь он несет общий заряд значением в +1, это заряд протона, потерявшего уравновешивающий его электрон. С другой стороны, у атома хлора теперь 18 электронов, то есть на один электрон больше, чем требуется для нейтрализации 17 протонов ядра. Поэтому его общий заряд теперь равняется заряду этого лишнего электрона, то есть составляет ‑1.
Такие атомы, несущие электрический заряд по причине избытка или нехватки электронов, называют «ионами». Естественно, ионы делят на положительные и отрицательные. Ионы обозначают приставляя к обычному символу элемента маленький плюс или минус, отражающий заряд иона. То есть ион натрия обозначается как N+, ион хлора – как Сl‑.
Некоторые атомы могут терять в ходе химической реакции по два или даже три электрона, а могут и вести себя по‑разному в разных условиях – при одной реакции терять два электрона, а при другой – три. Бывает даже так, что группа атомов, удерживаемая воедино с помощью обычных связей из «общих» электронов, теряет или приобретает электроны. Атомы остаются соединенными, но все вместе приобретают электрический заряд и становятся «сложными ионами». Мы не будем вдаваться в пущие подробности; однако на всякий случай приводим здесь список самых распространенных ионов (табл. 3).
Таблица 3.
ИОНЫ
Положительные
Название … Обозначение
Ион водорода … Н+
Ион натрия … Na+
Ион калия … К+
Ион магния … Mg2+
Ион кальция … Са2+
Ион цинка … Zn2+
Одновалентный ион меди … Cu+
Двухвалентный ион меди … Cu2+
Двухвалентный ион железа … Fe2+
Двухвалентный ион железа … Fe3+
Ион аммония … NH4+
Отрицательные
Ион фтора … F‑
Ион хлора … Сl‑
Ион йода … I‑
Ион серы … S2‑
Карбонат‑ион … СО32‑
Нитрат‑ион … NO3‑
Сульфат‑ион … SO42‑
Фосфат‑ион … PO43‑
Примечание. Когда атом или группа атомов теряют или приобретают более одного электрона, то этот факт отмечают приписывая перед плюсом или минусом соответствующий индекс.
Закон о том, что противоположно заряженные частицы притягивают друг друга, распространяется и на ионы. Поскольку ионы натрия и хлора формируются путем перехода электрона от атома натрия к атому хлора, то ионы остаются вместе, связанные силой притяжения между положительным и отрицательным зарядами двух ионов. В итоге получается соединение хлорид натрия – привычная нам поваренная соль.
Такие вещества, как хлорид натрия, удерживаемые воедино ионными связями, не состоят из молекул в том же понимании, что и углекислота или вода.
В кристалле поваренной соли любой отдельный ион натрия не является прочно соединенным с каким‑то конкретным ионом хлора в единую двухатомную частицу. Нагляднее всего это видно на примере растворения поваренной соли. Ионы натрия и хлора свободно перемещаются в растворе. Точнее, существует всеобщее притяжение между положительными и отрицательными зарядами, но любой отдельный ион натрия может передвигаться, не таща за собой какой‑то конкретный ион хлора. На самом деле под воздействием электрического тока оба набора ионов можно заставить двигаться в противоположных направлениях.
Некоторые химические реакции лучше всего рассматривать именно в свете такой вот ионной независимости; тогда проще всего описывать их, сосредоточившись на одном из ионов и упуская из виду второй.
К примеру, возьмем цинк (Zn) и медный купорос, молекула которого состоит из одного атома меди (Cu), одного атома серы (S) и четырех атомов кислорода и обозначается CuSO4. Если в раствор медного купороса добавить металлический цинк, то произойдет спонтанная реакция, в ходе которой цинк войдет в состав раствора, который станет теперь раствором сульфата цинка (ZnSO4), а медь выйдет из состава раствора и выпадет в осадок в виде знакомого нам красноватого металла.
Записанное обычным образом выражение для этой реакции будет выглядеть так:
Zn + CuSO4 → ZnSO4 + Cu.
При этом создается впечатление, что сульфатная группа (SO4) отделяется от меди и прикрепляется к цинку. На самом же деле сульфатная группа ничего подобного не совершает. Изо всех компонентов системы она играет самую пассивную роль. Взглянем на происходящее, исходя из ионной картины.
Медный купорос удерживают воедино ионные связи (по крайней мере, частично), и в растворе он существует не в виде отдельных молекул, а в виде смеси ионов меди (Cu2+) и сульфат‑ионов (SO2). В ходе реакции атом цинка (его можно записать как Zn0, чтобы лишний раз подчеркнуть его нейтральность в металлической форме) теряет два электрона и становится ионом цинка (Zn2+), и эти два электрона приобретает ион меди, становясь, таким образом, нейтральным атомом меди (Cu0) и оседая в этом виде.
Выражение можно записать так:
Zn0 + Cu2+ → Zn2+ + Cu0.
Эта реакция подразумевает изменение в природе ионной связи. Изначально мы имеем ионную связь между ионом меди и сульфат‑ионом, а в итоге – между ионом цинка и сульфат‑ионом. Изменения ионных связей подразумевают и изменение уровня свободной энергии, как и любые другие изменения химических связей. В этом случае реакция проходит спонтанно в направлении, указанном в вышеприведенной формуле, так что мы можем быть уверены в том, что при переходе от металлического цинка и иона меди к иону цинка и металлической меди уровень свободной энергии снижается.
Теперь давайте предположим, что два реагента разделены. В одной камере находится полоска цинка, погруженная в раствор сульфата цинка, в другом – полоска меди, погруженная в раствор медного купороса. Между двумя камерами – пористая перегородка, сквозь которую ионы могут проникать в обе стороны, но, при обычных условиях, очень медленно. В такой системе сами по себе обсуждаемые реакции не будут проходить в каком бы то ни было значительном объеме.
А происходит в ней следующее: атомы цинка в полоске цинка начинают терять электроны и превращаться в ионы цинка. Ионов меди, которые могли бы перехватить эти электроны, поблизости нет, так что в растворе происходит накопление «свободных электронов». Этот процесс не заходит слишком далеко, поскольку срабатывает следующий механизм: все отрывающиеся электроны, обладая одинаковым зарядом, стараются оттолкнуться друг от друга как можно дальше, создавая, таким образом, в растворе нечто вроде «электронного давления». Любому электрону, который хочет в этих условиях оторваться от атома цинка, приходится теперь преодолевать это давление, которое с отрывом каждого нового свободного электрона становится все сильнее, и так продолжается, пока электроны не перестают отрываться вообще. На этом этапе количество накопившихся в растворе свободных электронов относительно мало. То же самое происходит и в «медной» камере, поскольку атом меди тоже имеет склонность терять электроны. И все же в «цинковой» камере электронное давление выше, поскольку склонность атома цинка к потере электронов сильнее, в ней накапливается больше свободных электронов.
Теперь предположим, что полоска цинка соединена с полоской меди металлической проволокой. Тогда мы станем наблюдателями нового для нас и крайне интересного процесса. Обычные атомы по проволоке перемещаться не могут – этому мешают атомы, уже находящиеся в ней. А вот электрон – гораздо меньше и легче, чем атом. Его масса в 1837 раз меньше массы самого легкого атома (имеется в виду конечно же водород). Поэтому электрон может скользить между атомами, из которых состоит металлическая проволока. Способность электрона проходить сквозь вещество зависит от электронного строения самих атомов этого вещества. Электронная структура многих веществ – серы, стекла, резины, например, – не позволяет электронам свободно проходить сквозь них.
Электронное давление в обеих камерах становится движущей силой, запускающей перемещение этих микрочастиц по проволоке. Поскольку в «цинковой» камере электронное давление выше, то электроны будут вылетать из «цинковой» камеры активнее, чем из «медной». Таким образом, общее движение электронов будет происходить в направлений из точки с большим электронным давлением в точку с меньшим электронным давлением, по тому же принципу, по которому камень катится вниз (из точки с высоким уровнем потенциальной энергии – в точку с более низким), а тепло переходит от горячих предметов к холодным (из области с высокой температурой – в область с низкой). Эта разность электронных давлений, служащая движущей силой электронного потока, называется «электрическим потенциалом», или «электродвижущей силой».
По мере того как электроны покидают «цинковую» камеру, электронное давление в ней понижается и находящиеся в ней атомы цинка начинают активнее избавляться от электронов. Эти освобождающиеся электроны тоже покидают камеру, и атомы цинка продолжают испускать электроны в прежнем темпе. Так продолжается неопределенно долго, и этот непрерывный поток электронов и есть знакомый нам электрический ток.
По мере того как электроны перетекают из «цинковой» камеры в «медную», их подхватывают ионы меди, окружающие медную полоску, превращаясь, таким образом, в нейтральные атомы меди. Дальше по мере притока электронов атомы цинка на одном конце проволоки превращаются в ионы и переходят из твердого состояния в раствор, а ионы меди на другом конце превращаются в атомы меди и выпадают из раствора в осадок. Общее количество положительных ионов в обеих камерах не изменяется, как и общий размер положительного заряда. Точнее, положительный заряд собирается в той части раствора, которая окружает цинк, и исчезает из той части, которая окружает медь; однако отрицательно заряженный сульфат‑ион может перемещаться сквозь пористую перегородку из «медной» камеры в «цинковую» и поддерживает, таким образом, электрическое равновесие.
Поток электронов – это вид энергии, и его можно использовать для выполнения работы. Электрическая энергия возникает за счет снижения химической энергии, которое происходит в процессе превращения ионов меди и цинка в ионы цинка и медь.
Такое устройство, переводящее свободную энергию химической реакции в электрическую энергию, называют химической батареей, или электрической батареей, или электрохимической батареей, элементом питания или даже «гальваническим элементом», или «вольтовой цепью» (рис. 14), по имени Алессандро Вольта, итальянского ученого, который впервые изготовил химическую батарею в 1800 году. Описанная нами конкретная схема с использованием меди и цинка называется «элементом Даниеля» по имени разработавшего ее в 1836 году английского химика Джона Фредерика Даниеля.
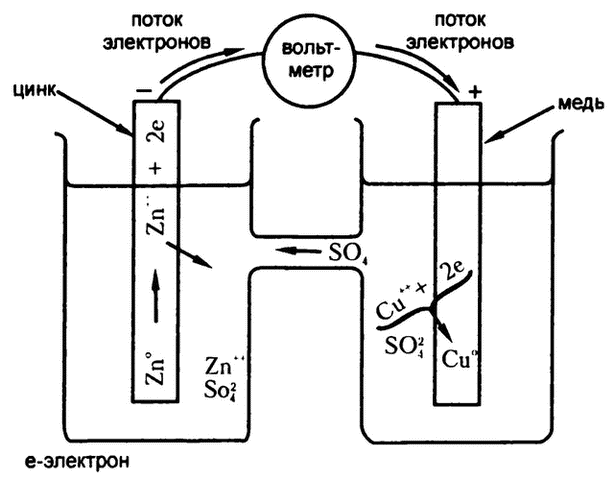
Рис. 14. Поток электронов в гальваническом элементе
Обратите внимание – эти батареи уже изготавливали и использовали за столетие до того, как были открыты электроны! Однако именно с 1890‑х годов отсчитывается невероятный рост применения потока электронов благодаря работе физиков, трудившихся в области электроники. Мораль тут такова: чтобы использовать некое явление – совершенно не обязательно его понимать, но если все же его удастся понять, то польза от него возрастет многократно!
Чем больше снижается уровень свободной энергии, задействованной в химической реакции, запускающей поток электронов, тем больше движущий электроны электрический потенциал. Электрический потенциал легко измерить; единицей измерения его служит «вольт», а прибор, которым его измеряют, называется «вольтметр» – опять же в честь Вольта. Математические выкладки Гиббса показали, что из этого потенциала можно высчитать уменьшение свободной энергии. Таким образом, Гиббс увязал с термодинамикой, которая изначально разрабатывалась в общем‑то для тепловых машин, не только химическую, но и электрическую энергию.
Некоторые очень важные химические реакции остаются, таким образом, за пределами возможностей прямого изучения. Реакция соединения углерода и кислорода в углекислоту имеет точку равновесия настолько близкую уже к самой углекислоте, что снижение уровня свободной энергии, связанное с ней, подсчитать, исходя из точки равновесия, невозможно. Невозможно создать и химическую батарею на основе реакции соединения углерода и кислорода. Это была бы «топливная батарея», которая позволила бы производить дешевое электричество и представляла бы собой очень ценное и полезное устройство, если бы только ее возможно было создать.
К счастью, здесь можно воспользоваться эквивалентом закона Гесса. Как вы помните, закон Гесса позволяет обращаться с химическими выражениями так, как будто это выражения математические, и это распространяется на значения ΔН (см. главу 8). То же самое справедливо и для ΔF. Манипулируя выражениями, для которых можно измерить изменения уровня свободной энергии напрямую, можно вывести из них и значения для тех реакций, для которых напрямую их измерить нельзя.
Таким образом, можно сказать с полной уверенностью, насколько в науке вообще можно что‑то говорить с полной уверенностью, что
Н2 + 1/2О2 → Н2О
ΔF = ‑54,6 ккал,
СН4 + 2O2 → CO2 + 2H2O
ΔF = ‑195,6 ккал
и так далее для множества других реакций.
Глава 11.
Дата добавления: 2016-01-26; просмотров: 944;
