Скорость реакции слева направо ~ [А][В].
Известно, что если некая величина, х, прямо пропорциональна другой величине, у> то пропорциональность можно перевести в равенство, если умножить х на некое третье число, k, именуемое в таком случае коэффициентом. Иными словами, если х ~ у, то x = ky.
Итак, получаем:
скорость реакции слева направо = k [А][В].
Конкретное значение k для той или иной реакции можно установить только в ходе эксперимента.
Но сейчас нам и не нужно конкретное значение. Достаточно просто знать, что k – это фиксированная величина.
Теперь давайте перейдем к реакции справа налево, то есть к обратной реакции слева направо, когда соединение С и D приводит к образованию А и В.
Вся вышеприведенная логика относится и к реакции справа налево, поэтому понятно, что ее скорость зависит от концентрации С и D:
скорость реакции справа налево = k’ [C][D],
где k’ – другой коэффициент, скорее всего не равный первому и поэтому отмеченный штрихом.
По достижении химического равновесия скорость реакций в обоих направлениях одинакова (первым это установил английский химик Александр Уильям Уильямсон в 1850 году), что можно описать так:
k [А][В] = k’ [C][D],
соответственно, применив математические преобразования, получим
[C][D]/ [А][В] = k’/k.
Поскольку и k/k' – константы, то и отношение одного к другому тоже будет константой, назовем ее К. Следовательно,
[C][D]/ [А][В] = K,
где K – «постоянная равновесия», значение которой четко описывает те концентрации веществ, при которых скорость противоположно направленных реакций будет одинакова.
Допустим, к примеру, что к смеси, пребывающей в состоянии химического равновесия, добавляют некоторое количество С. В таком случае произведение [C][D], являющееся числителем дроби, увеличится. Чтобы К осталось постоянным, необходимо увеличить также и знаменатель дроби, [А][В]. Как это может произойти? Только одним образом – часть С и D должны вступить в соединение и образовать А и В. То есть [C][D] несколько уменьшится, а [А][В] – несколько увеличится, так что соотношение их снова приобретет значение К, при котором опять будет достигнуто химическое равновесие. То же самое произойдет и в том случае, если в исходную смесь добавить D, а не С.
Можете сами проверить, что случится, если в исходную смесь добавить А или В (или и то и другое) или, наоборот, из исходной смеси удалить любое из веществ.
Я подскажу. Неизменным свойством обратимых реакций является следующее: реакции типа
A + B ↔ C + D
начинают осуществляться в направлении слева направо при добавлении к изначальной смеси А или В или устранении из нее С или D и справа налево при добавлении С или D или устранении А или В.
(В 1901 году американский химик Гилберт Ньютон Льюис внес изменения в формулировку этого закона, получившего название «закон действия масс», указав, что на направление осуществления обратимой реакции влияет не концентрация веществ, а фактор, который ученый назвал «активностью» этих веществ. Это родственный концентрации фактор, часто практически равный ей, особенно когда концентрация невысока. Но нас это уточнение волновать не будет.)
Тот факт, что обратимая реакция именно таким образом реагирует на изменения концентраций участвующих в ней веществ, французский химик Анри Луи Ле Шателье в 1888 году положил в основу более общего закона, сформулировав его так: «В любой системе, находящейся в состоянии равновесия, любые изменения условий приводят к сдвигу положения равновесия в направлении частичного аннулирования произведенных изменений».
Этот закон называют принципом Ле Шателье.
Иными словами, если в набор веществ, участвующих в описанной нами обратимой реакции, добавляется А или В, то равновесие сдвигается в том направлении, в котором используется именно добавленное вещество. В более общем выражении, если смесь реагирующих веществ нагревать, то и равновесие будет сдвигаться в том направлении, в котором часть тепла поглощается, то есть в эндотермическом. Точно таким же образом, если смесь остудить, то равновесие сдвинется в направлении экзотермической реакции. Таким образом, можно сразу сказать, что нагрев системы, состоящей из йода, водорода и йодоводорода, приведет к смещению равновесия в сторону формирования большего количества йодоводорода, а остывание системы – в противоположном направлении. Аналогичным образом увеличение давления в системе приведет к сдвигу равновесия в том направлении, результатом которого станет уменьшение объема.
На самом деле вполне возможно рассматривать принцип Ле Шателье как универсальный, распространяющийся даже на поведение людей. Среднестатистический человек всегда поддерживает некое равновесие между доходами и расходами таким образом, чтобы ни накопления, ни долги не разрастались до слишком больших объемов. Если ему увеличивают зарплату или богатый дядюшка оставляет ему наследство, то уровень жизни этого человека, как правило, увеличивается настолько, чтобы компенсировать полученное увеличение дохода. Если же, наоборот, зарплату человеку урезают или он остается без работы, то он начинает экономить, урезать расходы, таким образом частично компенсируя этим уменьшение дохода.
* * *
После всеобщего утверждения закона действия масс все еще оставалась потребность в том, чтобы связать его с законами термодинамики, что показало бы, что химическая энергия подчиняется всем тем же законам, что и любая другая.
Еще в 1869 году немецкий химик Аугуст Фридрих Хорстманн использовал законы термодинамики для разложения вещества под названием «хлорид аммония», более известного нам как нашатырный спирт, а в течение 70‑х и 80‑х годов XIX века ряд других химиков тоже работали над этой проблемой.
Самых важных результатов смог добиться американский химик‑теоретик Джозайя Уиллард Гиббс. Работая в Йельском университете, в 1876 и 1878 годах он опубликовал доклады в «Протоколах Коннектикутской академии наук», где подробно излагались законы термодинамики применительно к химическим реакциям. Он продемонстрировал, что закон действия масс – это неизбежное следствие из законов термодинамики. Его исследование оказалось столь совершенным, что ни о какой «термохимии» с тех пор и речи быть не могло, осталась только «химическая термодинамика».
К несчастью для Гиббса, в его дни весь мир импортировал науку из Европы и американских ученых ценили мало. Американские научные журналы никто не принимал всерьез, и работа Гиббса попала в поле зрения европейских ученых лишь два десятилетия спустя.
Наконец, в 1890‑х годах Ле Шателье сам перевел труды Гиббса на французский язык, а немецкий специалист по физической химии Вильгельм Оствальд – на немецкий. И лишь тогда Гиббсу воздали должное. К тому времени Гельмгольц, первооткрыватель первого закона термодинамики, и датский физик Якоб Хендрик Вант‑Гофф уже и сами независимым образом открыли принципы химической термодинамики, но первооткрывателем в итоге все же был признан Гиббс. В 1901 году Гиббс получил официальное европейское признание своих заслуг и был награжден медалью Коплея – самой почетной международной наградой Лондонского королевского общества, – и хорошо, что успел, потому что дожил он лишь до 1903 года.
По сути, все рассуждения Гиббса вертелись вокруг того факта, что при любой спонтанной химической реакции энтропия должна возрастать, как и при любых других энергетических изменениях. Поскольку общее количество задействованной энергии изменяться не может, а возрастание энтропии – это способ измерить энергию, которую невозможно перевести в работу, то, следовательно, количество энергии, которую можно перевести в работу, должно снижаться.
Количество энергии доступной для перевода в полезную работу в ходе химической реакции может быть различным, в зависимости от того, проходит ли реакция при постоянном давлении или при постоянном объеме. Как я объяснял в предыдущей главе, системы с постоянным давлением дают нам более приближенную к реальности картину. Количество энергии, доступной для перевода в работу в ходе химической реакции, называли в честь Гиббса «энергией Гиббса». В начале 1920‑х годов Льюис назвал эту энергию «свободной энергией», – и это название тоже было принято, так что теперь используются оба названия, и обозначение этой энергии тоже может быть одним из двух: иногда ее обозначают F (по первой букве от англ. free – свободная), а иногда – G (по первой букве фамилии Гиббса). Сейчас «свободная энергия» является все же более распространенным названием, так что я в дальнейшем буду использовать обозначение F.
Гиббс показал, что в любой реакции, проходящей при неизменной температуре (Е), соблюдается простое отношение между изменениями теплового содержания (ΔР), изменениями свободной энергии (ΔF) и изменениями энтропии (ΔS). Это отношение таково:
ΔH = ΔF + TΔS.
В термодинамике всегда используются значения температуры по абсолютной шкале (см. главу 4), в которой нет отрицательных величин. Поэтому Т – всегда положительное число. Из второго закона термодинамики нам известно, что при любой спонтанной реакции энтропия возрастает, так что значение изменений в энтропии (ΔS) тоже должно быть положительным. А поскольку произведение двух положительных чисел тоже всегда положительно, то мы знаем, что значение TΔS всегда положительно.
С другой стороны, по мысли Гиббса, свободная энергия всегда уменьшается при любой спонтанной химической реакции, так что изменение свободной энергии (ΔF) всегда должно быть отрицательно.
Получается, что значение ΔН – это сумма отрицательного и положительного чисел. Но термодинамика, хоть и указывает нам, что одно из слагаемых – положительно, а второе – отрицательно, не позволяет выяснить, какое из них больше по модулю. Если модуль отрицательного ΔF больше, чем положительного TΔS, то мы получаем экзотермическую реакцию, если меньше – то эндотермическую.
В любом случае, какой бы реакция ни была – эндотермической или экзотермической, энтропия возрастает, количество свободной энергии снижается и реакция происходит спонтанно.
Соответственно надо обращать внимание не на то, выделяется или поглощается в ходе реакции тепло, а на то, какие изменения происходят со свободной энергией. Реакция всегда будет проходить в направлении, способствующем снижению уровня свободной энергии, по тому же закону, по которому тепло перетекает от горячего предмета к холодному, а шар – скатывается вниз.
Далее, Гиббс показал, что количество свободной энергии, присутствующей в любом химическом веществе, изменяется в зависимости от концентрации этого вещества. Меняя концентрацию вещества, возможно влиять на изменение свободной энергии таким образом, чтобы оно становилось отрицательным для одного направления реакции, хотя до этого оно было отрицательным же для противоположного. Именно поэтому на ход обратимой реакции можно влиять, добавляя в систему тот или иной компонент или удаляя его.
Это похоже на ситуацию с шаром, лежащим на гладкой ровной поверхности, которую можно слегка покачивать то в одну сторону, то в другую. Шар сам будет катиться в нужном направлении.
Гиббс составил выражение для расчета величины, в которой учитывались и свободная энергия, и концентрация, и назвал эту величину «химическим потенциалом». Ученый определил, что каждая реакция проходит в сторону уменьшения химического потенциала.
Глава 10.
ЭЛЕКТРИЧЕСКИЙ ПУТЬ
При оценке действия изменений свободной энергии на химические системы ход химической реакции проще рассматривать по аналогии с движением в гравитационном поле. Это вполне разумное решение, поскольку на всем протяжении предыдущей главы мы доказывали, что химические реакции производятся под воздействием химического потенциала, так же как падающие тела движутся под воздействием гравитационного потенциала. А движение падающих тел нам настолько хорошо знакомо по бытовому опыту, что для нас вполне естественно визуализировать все по аналогии с ним.
Рассмотрим, к примеру, соединение водорода и кислорода, при котором формируется вода. Смесь водорода и кислорода содержит в себе определенное количество свободной энергии на моль смеси («молярная свободная энергия»), и вода тоже. Судя по тому факту, что водород с кислородом стремительно бросаются соединяться, стоит их лишь чуть‑чуть подтолкнуть, – уровень свободной энергии смеси водорода и кислорода выше, чем образуемой при их соединении воды. Это можно представить в виде схемы (не претендуя при этом на использование каких‑либо реальных цифр) – рис. 12. Точка А представляет собой уровень свободной энергии чистой смеси водорода и кислорода, а точка В (размещенная на оси ниже, чем точка А) представляет собой уровень свободной энергии чистой воды, образовавшейся при их соединении.
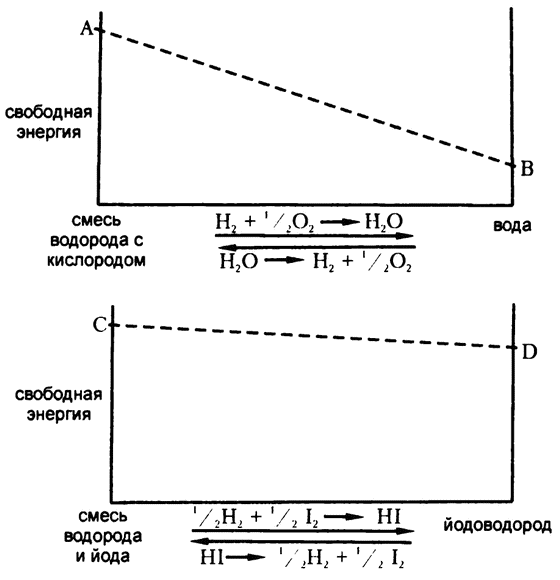
Рис. 12. Изменения свободной энергии при образовании воды (вверху) и йодоводорода (внизу)
По мере того как водород и кислород соединяются для образования воды, все большее количество молекул этих веществ в нашей воображаемой замкнутой системе уступает место молекулам воды. Постепенно смесь с высоким содержанием свободной энергии вытесняется веществом с более низким ее содержанием, так что общая свободная энергия системы постепенно снижается.
Самый простой способ продемонстрировать это – провести на диаграмме прямую линию от точки А до точки В. Таким образом мы получаем картинку наклонной плоскости, и общий жизненный опыт с легкостью подсказывает нам единственное направление, по которому будет осуществляться спонтанное движение по такой плоскости. Соединение водорода с кислородом для образования воды можно рассматривать как «скатывание вниз» по наклонной плоскости начиная с точки с высоким уровнем свободной энергии. Обратная же реакция – расщепление воды – отражает требующее усилий движение вверх по наклонной.
Точнее, нарисованный мной график в виде прямой линии был бы полностью справедливым только в том случае, если бы молярная свободная энергия водорода и кислорода не менялась вместе с концентрацией. Однако на самом деле уровень молярной свободной энергии по мере концентрации незначительно, но меняется, так что изображенная выше прямая линия в действительности не является совсем прямой. В данном конкретном примере отличие от прямой достаточно мало, чтобы им можно было пренебречь, но в тех случаях, где общая свободная энергия системы значительно меньше, чем у системы, состоящей из смеси водорода с кислородом, упомянутый параметр приобретает действительно важное значение.
Возьмем для примера реакцию соединения водорода и йода в йодоводород. В данном случае уровень свободной энергии, используемой в реакции, сравнительно невелик. Визуально это можно изобразить, как в нижней половине рис. 12, отметив значение уровня свободной энергии С смеси чистого водорода с чистым йодом лишь немного выше уровня свободной энергии D чистого йодоводорода, образуемого в ходе полного соединения водорода и йода.
Первое, что хочется сделать в подобной ситуации, – это снова провести прямую линию от одной точки до другой, так чтобы получилась еще одна наклонная плоскость, угол наклона которой был бы меньше, чем предыдущей, но в остальном аналогичная первой. Тогда реакция снова «катилась бы под уклон» – от смеси водорода и йода до йодоводорода, и образовавшийся в ее ходе йодоводород так и оставался бы неразлагаемым «у подножия», пока с помощью приложения некоторого усилия его не подняли бы «вверх». По такой логике смесь водорода и йода отличалась бы от смеси водорода и кислорода лишь скоростью и силой реакции, но не общим рисунком ее хода.
Но мы знаем, что на самом деле это не так. Водород и йод вступают в соединение не в полном объеме, а значит – не «скатываются вниз до конца». Более того, и чистый йодоводород до некоторого уровня будет сам по себе распадаться, что соответствовало бы по нашей схеме «движению вверх». Значит, график с прямой линией был бы неправильным.
Ответ кроется в том факте, что молярная свободная энергия снижается вместе с концентрацией вещества. Если концентрация смеси водорода и йода уменьшится на 10 процентов за счет образования йодоводорода, то уровень свободной энергии смеси снижается сильнее чем на 10 процентов. Это значит, что график изменения уровня свободной энергии, начинаясь от точки С, будет опускаться сильнее, чем прямая линия.
То же самое справедливо и в отношении йодоводорода. При разложении части его уровень свободной энергии оставшейся части окажется меньше, чем можно было бы ожидать. Поэтому от точки D график изменения уровня свободной энергии тоже будет опускаться вниз.
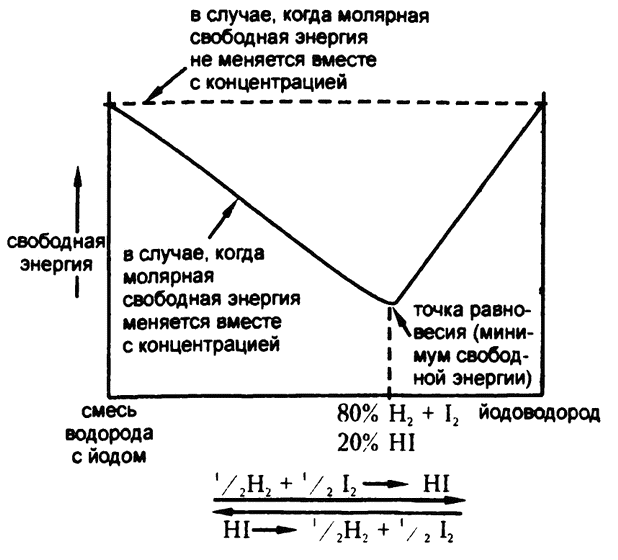
Рис. 13. Изменения уровня свободной энергии
Так что график будет напоминать не наклонную доску, а скорее подвесной гамак и на протяжении большей его части уровень свободной энергии будет меньше, чем на любой из крайних точек.
Этот факт надо подчеркнуть особо. Из‑за зависимости молярной свободной энергии от концентрации свободная энергия заданной реакции не достигает минимума ни в одной из крайних точек, в которых реакция была бы завершена либо в одну, либо в другую сторону. Вместо этого минимум достигается в некоторой средней точке, в которой снижение концентрации всех составляющих приводит к максимальному снижению общей свободной энергии.
Следовательно, реакция, приведя к минимальному уровню свободной энергии, оказывается в положении равновесия. Более того, реакция останавливается в одной и той же точке с минимумом свободной энергии, независимо от того, с чего она начинается – со смеси йода с водородом или с чистого йодоводорода.
Поэтому для полноты аналогии с движением под влиянием силы тяжести надо представить себе не одну, а две наклонные плоскости, или, более образно – два горных склона, между которыми находится долина. Если шар отпустить с вершины С, он скатится в ту же самую нижнюю точку долины, что и в случае, если его отпустить с вершины D.
Чем меньше разность уровней свободной энергии между двумя крайними точками графика, тем ближе будет точка равновесия находиться к его середине. Чем выше разность уровней энергии между двумя крайними точками, тем ближе точка равновесия сдвигается в сторону той крайней точки, свободная энергия которой меньше.
В случае соединения водорода с кислородом точка равновесия сдвигается так далеко в сторону воды, что практически неотличима от точки, обозначающей чистую воду. В этой точке равновесия уровень свободной энергии будет, конечно, ниже, чем в точке чистой воды, но настолько неощутимо ниже, что эту разницу практически невозможно измерить (можно только высчитать из сведений о свободной энергии).
Это значит, что в замкнутой системе водород и кислород никогда не соединятся в воду полностью – всегда будет оставаться неизмеримо малое количество свободного водорода и кислорода, не вступивших в реакцию. Более того, если изначально мы имеем чистый водяной пар, то при тех же условиях (температуре и давлении) неизмеримо малое количество этой воды будет разлагаться на водород и кислород.
С точки зрения термодинамики получается, что все реакции обратимы. Однако с практической точки зрения можно продолжать расценивать в качестве необратимых те реакции, в которых точка равновесия неотличимо близка к одной из крайних точек.
Поскольку положение равновесия напрямую зависит от изменений уровня свободной энергии при переходе от одной стороны химического выражения к другой, то это изменение можно очень просто вычислить, исходя из постоянной равновесия. Проблема только в том, что саму постоянную равновесия определить бывает очень сложно, особенно в отношении реакций, которые принято считать необратимыми. Поэтому ученые долго искали другие способы подсчета изменений уровня свободной энергии – и находили. Один из таких способов заслуживает особого рассмотрения, поскольку это поможет осветить важные положения химии. В этом способе используется электричество.
Однако, перед тем как приступить непосредственно к описанию этой методики, нам надо чуть глубже взглянуть на атом. До сих пор, описывая кинетическую теорию газов, я рассматривал атомы как крошечные бильярдные шары. Однако на самом деле они представляют собой гораздо большее. Атомы сами по себе состоят из еще меньших частиц. Это открытие, совершенное в 1890‑х годах, произвело поистине революцию в науке.
Эти элементарные частицы принадлежат к трем основным категориям: протоны, нейтроны и электроны. Протоны и нейтроны относительно массивны и плотно сгруппированы в единое тело (так называемое «ядро атома»), находящееся в самом центре атома. Они в обычных химических реакциях не участвуют.
Все остальное пространство атома, за исключением ядра, занимают электроны, представляющие собой очень легкие частицы. Количество электронов в каждом атоме равно количеству протонов в ядре этого атома, и число это свое у каждого химического элемента. Его так и называют – «атомное число». Самый простой атом – атом водорода – содержит всего один протон и один электрон, атомы остальных элементов содержат больше. У некоторых сложных атомов, искусственно создаваемых в последние годы в лабораториях ученых, атомное число превышает сотню. В таблице 2 приведены атомные числа некоторых наиболее распространенных элементов.
Каждый электрон имеет свой «электрический заряд»[4], так же как и каждый протон. У нейтронов электрического заряда нет, и поэтому хотя их значение и крайне велико, но нас в ходе дальнейшего рассмотрения они интересовать не будут. Величина заряда электрона и протона одна и та же, но природа этих зарядов различна. Один протон будет отталкивать другой протон и, наоборот, притягивать электрон. Точно так же и электрон будет отталкивать другой электрон и притягивать протон.
Совершенно произвольно было решено назвать электрический заряд электрона отрицательным, а протона – положительным. Поэтому заряд одного электрона обозначается как ‑1, а заряд одного протона – как +1. Кроме того, установлен закон, что одинаковые заряды отталкиваются, а противоположные – притягиваются.
В обычном атоме, как я уже сказал, количество протонов ядра (атомное число) в точности уравновешивается количеством удаленных от ядра электронов, так что атом в целом ведет себя как лишенный заряда, или «электрически нейтральный». Однако в отличие от протонов, хорошо укрытых в ядре от воздействия межатомных и межмолекулярных столкновений, легкие электроны, существующие на «внешних рубежах» атома, чувствуют эти события на себе в полной мере. И при химических реакциях неизбежно осуществляется некоторое перераспределение электронов между участвующими в реакции атомами. На самом деле именно наличие перераспределения электронов отличает химические реакции от изменений иного рода.
Таблица 2.
АТОМНЫЕ ЧИСЛА
Дата добавления: 2016-01-26; просмотров: 892;
