Элемент …… Обозначение … Атомный вес
Водород …… Н … 1,00797
Углерод …… С … 12,01115
Азот …… N … 14,0067
Кислород …… О … 15,9994
Натрий …… Na … 22,9898
Магний …… Mg … 24,312
Фосфор …… Р … 30,9738
Сера …… S … 32,064
Хлор …… Cl … 35,453
Калий …… K … 39,102
Железо …… Fe … 55,847
Йод …… I … 126,9044
при написании своих работ на указание названий элементов. Когда же речь заходит об обозначении молекул, состоящих из различных сочетаний атомов, экономия становится просто невероятной. Здесь использование символики перестает уже быть вопросом одной лишь экономии сил и времени, а становится важной составляющей ясности подхода; вы и сами поймете это по ходу книги.
Возьмем, к примеру, кислород. В нормальных условиях это газ, состоящий из молекул, каждая из которых состоит, в свою очередь, из 2 атомов кислорода. Следовательно, если мы просто говорим «кислород», то непонятно, что именно мы имеем в виду: атомы или молекулы. Можно, конечно, вносить ясность путем добавления уточняющих определений – говорить «атомный кислород» или «молекулярный кислород», но опять же, мало того что мы при этом чрезмерно усложняем речевой оборот, так к тому же цель еще и остается при этом не полностью достигнутой. Ведь есть еще, например, такая форма молекулярного кислорода, как озон, в котором молекула состоит не из двух, а из трех атомов.
Для упрощения и конкретизации вопроса нужно всего лишь дописать к символу – обозначению элемента циферку, и мы получаем химическую формулу вещества, которая сама по себе говорит нам о строении молекулы. Таким образом, просто О обозначает атомный кислород (совсем уж дотошные педанты могут записывать его как О2 но по умолчанию и так принято считать, что если символ написан без дополнительных цифровых обозначений, то подразумевается «1»).
Молекулярный кислород обычного типа пишется O2, а озон – О3.
Точно так же азот, водород и хлор – все они в обычном виде тоже представляют собой газы, состоящие из двухатомных молекул, и записываются так: N2, H2 и Cl2.
Не всегда предмет состоит из молекул четко определяемого состава. Например, кусок углеродного материала (например, угля) состоит из множества атомов углерода, объединенных между собой очень сложными химическими связями. В принципе кусок угля можно рассматривать как единую огромную молекулу. Однако для простоты химические элементы в твердом состоянии обозначает просто как атомы, игнорируя при этом реальные связи между этими атомами. Поэтому углерод в его твердом естественном состоянии обозначается просто как С.
Буквенно‑цифровую систему можно использовать и в том случае, если молекула состоит из атомов нескольких разновидностей (такие вещества называют «сложными»). Так, например, формула сложного вещества хлороводорода (это газ, состоящий из двухатомных молекул, один из атомов которой – водород, а второй – хлор) записывается так: НСl.
Молекула воды, состоящая из 2 атомов водорода и 1 атома кислорода, записывается как Н2O (эту формулу знают все, даже те, кто не имеет ничего общего с химией), а формула углекислоты, состоящей из 1 атома углерода и 2 – водорода, обозначается как СO2.
Каждая молекула имеет свой молекулярный вес, равный сумме атомных весов всех составляющих ее атомов. Молекулярный вес молекулы кислорода, O2, равняется 16 + 16, то есть 32. Молекулярный вес углекислоты – 12 + 16 + 16 то есть 44, и так далее.
Формулы можно использовать для описания химических реакций более быстрым и точным образом, чем в словесном рассказе. Например: уголь, представляющий собой практически чистый углерод, при горении вступает в соединение с содержащимся в воздухе кислородом, в результате чего получается углекислота. Химическая реакция в данном случае записывается так:
С + O2 → СO2.
Это можно перевести как «углерод плюс кислород равно углекислота», и является прекрасным примером химического выражения.
Таким же образом, водород вступает в соединение с кислородом, в результате чего получается вода. Это можно записать таким образом:
Н2 + O2 → Н2O.
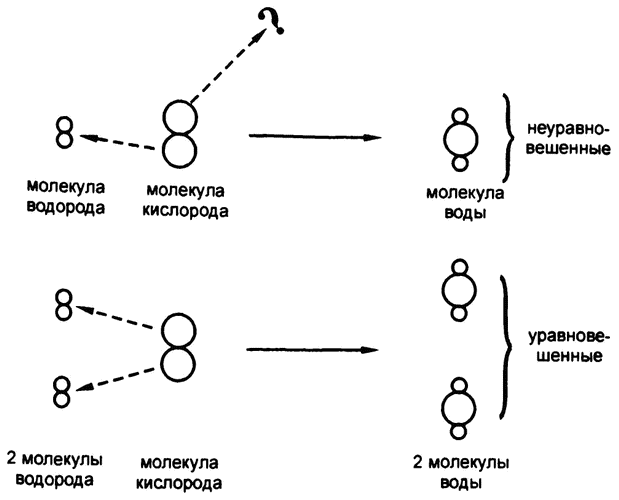
Рис. 7. Уравновешенные химические выражения
Но химиков такая запись не может полностью удовлетворить, и вот почему.
В первой из двух вышеприведенных реакций, где речь шла о сочетании углерода и кислорода, видно, что ни один атом не «остался без дела», все они закономерно перешли из левой части уравнения в правую. У нас изначально имеется 1 атом углерода (представляющий собой уголь) и 2 атома кислорода (представляющие собой молекулу кислорода), а в результате мы получаем 1 молекулу углекислоты, в которой содержатся и тот самый атом углерода, и те самые 2 атома кислорода.
Но вот во втором выражении, где речь идет о соединении водорода и кислорода, дело обстоит иначе. Здесь у нас с самого начала имеется 2 атома водорода (представляющие собой молекулу водорода) и 2 атома кислорода (представляющие собой молекулу кислорода), но в результате мы получаем молекулу воды, включающую в себя оба атома водорода, но при этом лишь один из двух атомов кислорода. Такая «неуравновешенная» запись процесса может ввести в заблуждение, поскольку позволяет предположить, что 1 атом кислорода просто исчез, чего на самом деле, понятно, случиться не могло. Более того, для того, чтобы использовать такие выражения для количественного расчета, они должны быть уравновешенными (рис. 7).
Для того чтобы уравновесить выражение, надо указать соответствующее количество для каждого участвующего в реакции элемента. Вот как выглядит уравновешенное выражение для соединения водорода и кислорода:
2Н2 + O2 → 2Н2O.
В этом случае мы изначально берем 4 атома водорода и 2 атома кислорода и в результате имеем те же 4 атома водорода и 2 атома кислорода. Все сходится!
Конечно, можно написать
4Н2 + 2O2 → 4Н2O
или
12Н2 + 602→ 12Н2O
и, таким образом, тоже уравновесить выражение, но принято все же использовать наименьшую цифру из возможных.
Впрочем, если и принято использовать только целые числа в химических выражениях, то это правило не является универсальным. Когда речь идет о вырабатываемой в ходе химической реакции энергии (а именно об этом я и собираюсь рассказывать), часто удобнее бывает обозначать единый атом кислорода как 1/2O2. Это не совсем хорошо, поскольку может навести на мысль о том, что «полумолекулы» существуют на самом деле, а это не так. Однако с таким отображением удобнее вести энергетические расчеты, так что выражение для соединения водорода и кислорода можно записать и так:
H2 + 1/2O2 → H2O.
В этом выражении мы изначально имеем 2 атома водорода и 1 атом кислорода (полмолекулы), а в результате получаем 2 атома водорода и 1 атом кислорода, так что выражение получается сбалансированным.
Можно привести пример подобного выражения и без участия кислорода. Водород и хлор вместе могут образовывать хлороводород, а натрий и хлор – хлорид натрия (это привычная нам поваренная соль). Эти процессы описываются такими выражениями:
Н2 + Cl2 → 2НСl,
2Na + Cl2 → 2NaCl.
Очевидно, что использование целых чисел – простейший способ записать выражения в уравновешенном виде.
Итак, ход химических реакций благодаря применению специальных обозначений стал нам понятнее, и теперь мы можем, как я уже говорил, использовать эти выражения для различного рода вычислений.
Возьмем, к примеру, выражение, представляющее соединение водорода и хлора:
Н2 + Cl2 → 2НСl.
Оно показывает, что в ходе химической реакции одна молекула водорода реагирует с 1 молекулой хлора для создания 2 молекул хлороводорода. В реакцию вступают равные количества молекул водорода и хлора – один к одному, два к двум, десять к десяти, миллиард к миллиарду. Однако это не значит, что и массы вступающих в реакцию газов будут одинаковы, поскольку одна молекула хлора гораздо тяжелее, чем одна молекула водорода; соответственно и масса участвующего в реакции хлора будет больше, чем реакция участвующего в ней же водорода.
Поскольку атомный вес водорода равен 1, а хлора – 351/2, то молекулярный вес Н2 равен 1 + 1, то есть 2, а молекулярный вес Cl2 равен 351/2 + 351/2, то есть 71. Вне зависимости от того, сколько пар молекул – по одной молекуле хлора и водорода – вступают в реакцию, отношение их масс всегда будет составлять 2:71. Так, две унции водорода вступят в реакцию с 71 унцией хлора; два фунта водорода – с 71 фунтом хлора; две тонны водорода – с 71 тонной хлора и так далее.
Удобнее всего, конечно, рассматривать, как и принято в химической науке, 2 грамма водорода и 71 грамм хлора.
Еще до того, как были установлены подробности касательно атомного строения молекул, химики уже выяснили путем точных измерений, что 2 грамма водорода вступают в реакцию с 71 граммом хлора. И только после того, как в результате долгих наблюдений они поняли, что хлор с водородом соединяются 1:1, был сделан вывод о том, что молекула хлора в 351/2 раза тяжелее молекулы водорода и что атом хлора в 35У2 раза тяжелее атома водорода. Именно отношение весов в сочетаниях и позволило впервые установить значения атомных весов различных химических элементов.
Впоследствии оказалось, что количество молекул водорода в 2 граммах этого вещества равняется примерно 6O2 000 000 000 000 000 000 000.
Это огромное число принято называть «числом Авогадро», поскольку установлено оно было в ходе исследований, которые проводил итальянский химик Амадео Авогадро примерно в 1810 году. Число Авогадро обычно обозначают N, и, поскольку это гораздо проще, чем писать его целиком, именно так я и буду его в дальнейшем приводить.
Таким образом, можно сказать, что N молекул Н2 весят 2 грамма. Поскольку отдельная молекула Cl2 в 351/2 раза массивнее, чем отдельная молекула Н2, то N молекул Cl2 тоже должны весить в 351/2раза больше, чем N молекул Н2. Поэтому вес N молекул Cl2 должен составлять 2 х 351/2, то есть 71 грамм.
Подобные рассуждения справедливы для любых молекул. Вес N молекул любого вещества относится к весу N молекул водорода как вес одной молекулы этого вещества к весу N молекул водорода.
Число N было выбрано по той причине, что вес N молекул водорода равняется молекулярному весу водорода в граммах. То есть молекулярный вес водорода – 2, а вес N молекул водорода – 2 грамма. И, согласно описанным в предыдущем абзаце пропорциям, N молекул любого вещества будут иметь вес равный молекулярному весу этого вещества, выраженному в граммах. Как уже быkо установлено, N молекул Cl2 весит 71 грамм, а молекулярный вес хлора – 71.
Поскольку молекулярный вес воды, H2O, равен 1 + 1 + 16, то есть 18, то мы сразу же можем сказать, что N молекул воды будут весить 18 граммов, а N молекул углекислоты (молекулярный вес которой – 44) будут весить 44 грамма.
Вес равный молекулярному весу вещества, только в граммах, называют «грамм‑молекулярным», или «молярным», а количество вещества в таком случае получило название «моль». Так что N молекул любого вещества – это 1 моль этого вещества. Один моль водорода весит 2 грамма, 1 моль воды – 18 граммов, 1 моль углекислоты – 44 грамма и так далее. Веса во всех этих случаях различны, но количество вещества определяется не весом, а количеством молекул.
Естественно, все вышеизложенное справедливо и для отдельных атомов. Так, N атомов углерода (С) весят 12 граммов, а N атомов серы (S) весят 32 грамма. Атомный вес, выраженный в граммах, правильнее было бы называть «грамм‑атомным» весом. Однако простоты ради я буду использовать термин «моль» применительно и к грамм‑молекулярному, и к грамм‑атомному весу.
Таким образом, химические выражения могут трактоваться двояко. Они описывают как поведение одного атома или одной молекулы, так и поведение N атомов или молекул. К примеру, выражение
2Н2 + O2 → 2H2O
можно читать как «две молекулы водорода плюс одна молекула кислорода переходят в две молекулы воды», а можно как «два моля водорода плюс один моль кислорода переходят в два моля воды». Поскольку молекулярные веса водорода, кислорода и воды составляют 2,32 и 18, то 1 моль каждого из них весит соответственно 2 грамма, 32 грамма и 18 граммов. Так что вышеприведенное выражение можно прочесть и так: «4 грамма водорода плюс 32 грамма кислорода переходят в 36 граммов воды».
Как видно, закон сохранения материи при этом не нарушается. Изначально мы имеем 36 граммов водорода и кислорода, а в итоге – 36 граммов воды. Это справедливо только тогда, когда выражение записано в уравновешенной форме.
Еще раз: видя перед собой выражение типа
С + O2 → CO2,
мы можем прочесть его трояко:
а) «один атом углерода плюс одна молекула кислорода переходят в одну молекулу углекислоты»;
б) «один моль углерода плюс один моль кислорода переходят в один моль углекислоты»;
в) «12 граммов углерода плюс 32 грамма кислорода переходят в 44 грамма углекислоты».
Вот мы и освоили язык химических формул в том объеме, который будет необходим нам для рассуждений об изменении энергетического содержания веществ в ходе химических реакций аналогичных (хочется верить) тем, что происходят в организме человека.
Глава 8.
Дата добавления: 2016-01-26; просмотров: 1235;
