НАПРАВЛЕНИЕ РЕАКЦИИ
Закон Гесса является выражением первого закона термодинамики применительно к химическим реакциям, и теперь мы переходим к дальнейшему. Несколько глав назад мы сделали попытку определить жизнь через энтропию, а также предположили, что жизнь как процесс в чем‑то сродни горению и, следовательно, должна потреблять химическую энергию. Теперь мы попытаемся установить, как же действует второй закон термодинамики применительно к химическим реакциям.
В отношении механической энергии мы уже знаем, что второй закон термодинамики требует, чтобы предметы спонтанно перемещались из положения с большей потенциальной энергией (в данном случае она называется «гравитационным потенциалом») к положению с меньшей, и не наоборот. Вода течет по склону горы вниз, а не вверх. В отношении тепловой энергии второй закон термодинамики требует, чтобы тепло спонтанно переходило только от горячих тел (обладающих большей температурой – «тепловым потенциалом») к холодным, а не наоборот. Продолжая аналогию, можно предположить, что и химические реакции будут проходить таким образом, чтобы вещество переходило из состояния с большим «химическим потенциалом» в состояние с меньшим, и не наоборот.
Соответственно возникает вопрос: что же это за химический потенциал и как его измерить?
Бертло, которого я упоминал в предыдущей главе, как автора множества экспериментов по измерению теплоты реакции, считал, что ответ может крыться в самих этих измерениях. Он высказывал мнение, что спонтанными можно считать те реакции, которые характеризуются снижением химической энергии и соответственно выделением тепла, то есть те, ΔН которых отрицательна. С другой стороны, реакции, при которых химическая энергия увеличивается, так что тепло извлекается из окружающей среды (иными словами, ΔН которых имеет положительное значение), не будут протекать спонтанно.
Бертло назвал реакции первого типа (с выделением тепла в окружающую среду) «экзотермическими» (от греческого «тепло наружу»), а реакции второго типа (с поглощением тепла из окружающей среды) – «эндотермическими» (что означает «тепло внутрь»). По мнению Бертло, спонтанными могут быть только экзотермические реакции.
Существует множество примеров, которые подтверждают это правило. Например, смесь водорода с кислородом, если ее поджечь, возгорится мгновенно и даже взрывообразно, соединяясь в воду, – это экзотермическая реакция. С другой стороны, вода может вечно находиться в стабильном состоянии, не выказывая ни малейшего желания разлагаться на водород и кислород, – если бы этот процесс начался, он был бы эндотермическим. Точнее, если воду как следует нагреть, она начнет разлагаться, но ведь и вода может течь вверх, если ее качать насосом.
Тут можно возразить, что смесь водорода с кислородом тоже может вечно находиться в стабильном состоянии, совершенно не собираясь вступать в реакцию, пока в систему, опять же, не добавят избыточное тепло. Однако есть принципиальная разница. После того как некоторое количество избыточного тепла подожжет смесь водорода с кислородом, дальше реакция продолжается сама сколь угодно долго. Если же, с другой стороны, добавление дополнительного тепла, или электрического тока, запускает реакцию разложения воды на водород и кислород, то прекращение подачи тепла или электричества тут же приведет к остановке реакции на любом этапе.
Короче говоря, экзотермическая реакция соединения водорода и кислорода в принципе может продолжаться спонтанно, а эндотермическая реакция разложения воды – не может.
Однако, к огорчению Бертло, это правило оказалось недостаточно всеобъемлющим. Все экзотермические реакции действительно происходят спонтанно, а все эндотермические, как правило, не происходят спонтанно. Однако все же есть несколько реакций, которые являются эндотермическими и при этом все же происходят спонтанно. Лучшим примером такого рода реакций является растворение некоторых веществ в воде. Если аммиачную селитру высыпать в воду, то она спонтанно растворится, хотя АН этого процесса и будет положительна. При этом происходит набор химической энергии, а тепловая – извлекается из воды, которая становится ледяной на ощупь. И не важно, скольким количеством примеров подтверждается теория Бертло, для того, чтобы опровергнуть ее, достаточно и единственного исключения.
Однако на самом деле ущербность теории Бертло доказывается не только фактом наличия нескольких опровергающих ее исключений. Против нее имеются и некоторые более тонкие возражения, подводящие нас к идее «химического равновесия».
Реакции, которые вызывают наибольший интерес термохимиков – реакции горения, – кажутся однонаправленными. То есть углерод и кислород соединяются навсегда для образования углекислоты, водород и кислород – для образования воды, соединения, имеющие в своем составе и углерод, и водород, соединяются навсегда с кислородом для образования углекислоты и воды. Более того, никогда вода в сколь‑либо заметных количествах не разлагается на водород и кислород, а углекислота – на углерод и кислород. И вода никогда не соединяется с углекислотой для образования этилена или других углеводородов. Такие однонаправленные реакции также называют необратимыми.
Однако положение дел обстоит таким образом далеко не со всеми химическими реакциями. Например, посмотрим на одну из реакций с участием водорода и йода. При обычной температуре йод представляет собой синевато‑серое твердое вещество, но плавное нагревание его приводит к появлению фиолетового газа, а при температуре выше 184 °С он существует исключительно в виде газа. В газообразном состоянии йод состоит из двухатомных молекул (I2).
Если же смешать йод с водородом при температуре, скажем, 445 °С, будет образовываться соединение йодоводород (HI):
H2 + I2 → 2HI.
Однако в соединение вступают не весь йод и не весь водород. Сколько бы времени ни протекала реакция, все равно часть йода и часть водорода не будут в ней участвовать.
Если же, наоборот, произвести некоторое количество чистого йодоводорода и нагреть его до тех же 445 °С, то он начнет разлагаться на йод и водород:
2HI → Н2 + I2.
И опять же, независимо от того, сколько времени протекает реакция, распадется не весь йодоводород. На самом деле, что бы мы ни взяли изначально – смесь ли йода и водорода или йодоводород, в итоге мы получим одно и то же соотношение: около 80% йода и водорода будут находиться в соединенном виде HI; около 20% – в разрозненном. Такие реакции, способные протекать в обоих направлениях, называют обратимыми.
Очевидно, происходит следующее: водород и йод, будучи смешанными при высокой температуре, быстро соединяются, образуя йодоводород. Образуемый йодоводород имеет тенденцию к распаду при такой температуре, но так много йода и водорода задействовано в процессе соединения, а йодоводорода еще так мало, что наблюдателю заметен только эффект соединения, и количество йодоводорода в эксперименте только увеличивается.
Однако по мере увеличения количества йодоводорода все больше и больше соединившихся молекул начинает распадаться, а одновременно с этим количество все еще продолжающих объединяться молекул водорода и йода сокращается, и скорость образования йодоводорода снижается. По мере того как скорость распада йодоводорода возрастает, а скорость образования – снижается, должен наступить момент, когда эти два процесса уравновесят друг друга. Эксперимент показывает, что этот момент наступает при соотношении йодоводорода к смеси йода и водорода 80: 20. Дальше никаких изменений мы уже не увидим, и не потому, что все процессы на этом останавливаются, а потому, что одновременно происходят два противоположно направленных и взаимно уравновешивающих друг друга процесса.
Теперь предположим, что изначально у нас имеется не смесь, а чистый йодоводород (рис. 11). Некоторые его молекулы начинают распадаться сразу же. По мере накопления водорода и йода в общем объеме в этих газах начинают проявляться тенденции к воссоединению, сила которых возрастает по мере накопления самих газов. И наоборот, по мере того, как количество молекул йодоводорода в общем объеме снижается, скорость распада оставшихся молекул также уменьшается. И опять же, как показывают наблюдения, в итоге наступает некий момент равновесия.
Когда два противоположно направленных процесса уравновешивают друг друга, это называется «состоянием химического равновесия». Само слово «равновесие» рисует в воображении картинку некоего замершего под действием разносторонне направленных сил положения дел. Это – статическое равновесие, но химическое равновесие – совсем не такое. Оба противоположно направленных процесса происходят со всей доступной им скоростью, но при этом аннулируют эффект друг друга. Это – динамическое равновесие.
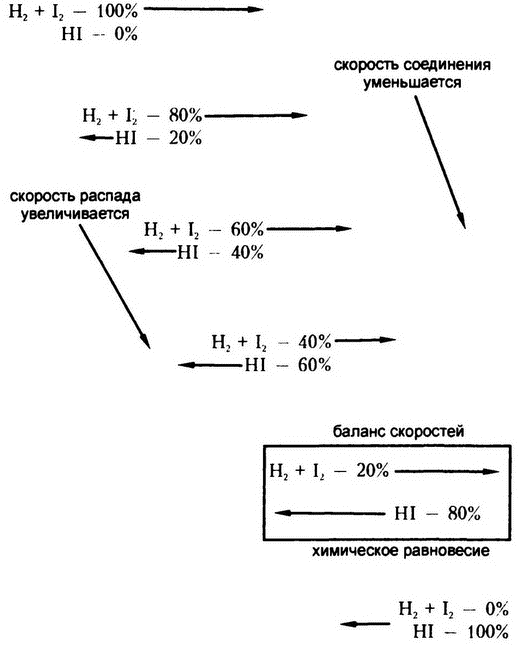
Рис. 11. Отношения между скоростью реакции и химическим равновесием
Ситуация химического равновесия, такого как в нашем примере с водородом и йодом, обычно обозначается таким образом: двумя противоположно направленными стрелочками:
Н2 + I2 ↔ 2HI.
Таким же образом можно записать и любое количество других реакций.
Ключевой момент здесь следующий: каждой реакции, при определенных условиях, присуща своя ΔН. Обратной реакции, при тех же условиях, присуща та же самая ΔН, но с обратным знаком. Об этом свидетельствует закон Лавуазье–Лапласа и, что еще важнее, первый закон термодинамики.
Следовательно, в любой обратимой реакции, если реакция в одну сторону является экзотермической, то реакция в противоположную сторону должна быть эндотермической. Применительно к водороду, йоду и йодоводороду распад йодоводорода на водород и йод – экзотермическая реакция с ΔН ‑6 килокалорий. Соответственно соединение водорода и йода – реакция эндотермическая, с ΔН +6 килокалорий.
Если бы теория Бертло, согласно которой спонтанными могут быть только экзотермические реакции, была верна, то йодоводород сам по себе мог бы только распадаться и не соединяться обратно. Однако наблюдения показывают совсем иную картину. Йодоводород на самом деле соединяется, причем с большим размахом, чем распадается.
Если бы Бертло был прав, такого понятия, как обратимая реакция, вообще не существовало бы – все реакции были бы однонаправленными. Поскольку наблюдения прямо опровергают это предположение, то все идеи Бертло были очень быстро преданы забвению. Вообще непонятно, почему Бертло сам не увидел очевидного и не удержался от публичного высказывания своих предположений, – но легко быть крепким задним умом.
* * *
Итак, мы продолжаем пребывать в поисках химического потенциала. Итак, один фактор, вроде бы имеющий влияние на направление, принимаемое обратимой реакцией, – это процентное соотношение соединений в общем объеме. Если количественно преобладают водород и йод, то всеохватывающее значение примет тенденция к соединению. Систему можно сбить с положения устоявшегося химического равновесия, если просто добавить в нее либо йодоводород либо смесь водорода и йода.
Первым, кто четко сформулировал это наблюдение, был французский химик Клод Луи Бертолле в 1803 году (не путать с Бертло, которого я упоминал в предыдущей части – тот жил на полвека раньше!).
Примерно с полвека теория Бертолле о влиянии массы на направление реакции не находила общего признания химиков, хотя один за другим они пробовали ее на зуб. Наконец, в 1863 году норвежские химики Като Максимилиан Гульдберг и Петер Вааге тщательно разработали этот вопрос и сформулировали правило, которое мы сейчас называем «законом сохранения массы». К сожалению, они опубликовали свою работу на норвежском языке, и ведущие немецкие и французские ученые смогли прочитать ее только пятнадцать лет спустя.
Яснее всего продемонстрировать важность этого закона можно, если представить себе обратимую реакцию в общем случае, без указания конкретных реагирующих веществ. Ее можно записать так:
А + В ↔ С + D.
Предположим, реакция осуществляется слева направо, тогда А и В переходят в С и D. Но для этого надо, чтобы эти два вещества встретились. Чем их больше в общем объеме, тем легче им встретиться и тем быстрее протекает этот процесс. Важно не общее количество, а количество в определенном объеме, то есть концентрация вещества. Можно провести такую аналогию: для юной леди, стремящейся выйти замуж, гораздо больше вариантов для выбора можно найти в сельском штате Невада, чем в массачусетском городке Холиоке, но вот беда – все кандидатуры в Неваде разбросаны по территории штата, и получается, что в Холиоке концентрация выше, а значит – выше и шансы подобрать себе подходящий вариант.
Если концентрация А удваивается, то вместе с ней удваивается и частота встреч молекул А и В, а соответственно – скорость их реакции между собой. Аналогичным будет результат удваивания и концентрации В. Если одновременно удвоится концентрация и А и В, то частота встреч молекул этих двух веществ, а значит, и скорость реакции возрастет вчетверо. Соответственно скорость реакции соединения этих веществ равна произведению концентрации одного на концентрацию второго. Для обозначения концентрации некоего вещества принято изображать его заключенным в квадратные скобки, и мы можем сказать, что
Дата добавления: 2016-01-26; просмотров: 2751;
