ИЗМЕРЯЕМОЕ ДВИЖЕНИЕ 3 страница
Допустим, например, что в машине Уатта используется пар, нагретый до 100 °С (373 °К), а температура конденсируемой воды – 5 °С (278 °К). Тогда по формуле Карно получаем:
(373 – 278)/373 = 0,255.
Лишь примерно четверть, и не больше, производимой тепловой энергии может быть преобразована в работу, как бы идеально ни работала машина. Повысить эффективность помогло бы использование раскаленного пара (чтобы Т2 была побольше) или жидкости, имеющей более высокую температуру кипения и более низкую температуру плавления, чем вода. Пробовали и то и другое, но даже современные паровые машины не имеют эффективности выше, чем 0,25.
* * *
Формула Карно не только указала путь к тому, как можно увеличить эффективность паровой машины, но и привела к открытию одного крайне важного обобщения.
Если формула Карно верна, то получается, что машина, в которой горячая и холодная камера имеют одну и ту же температуру, никакой работы произвести не способна. Ведь в таком случае Т2 будет равна Т1 соответственно, формула Карно приобретет вид:
(T2 – T1)/ T2 = 0/ T2 = 0.
Например, представим себе энергию, содержащуюся в океанской воде, пусть даже в ледяной. Когда эта вода замерзает, каждый грамм ее отдает 80 калорий тепла (как показал в свое время Блэк, измеряя латентное тепло). Почему бы тогда, скажем, океанскому лайнеру не собирать это тепло и не использовать для работы своих двигателей? Вода возле лайнера остужалась бы, возможно, вплоть до замерзания, но общий объем воды в океанах, а значит и содержащегося в ней тепла, настолько огромен, что для обеспечения работы всех океанских лайнеров (да и вообще всех механизмов) в мире потребовалась бы крайне незначительная ее доля. К тому же и эту потерю быстро возмещало бы солнечное тепло.
Такое предположение никоим образом не нарушает первого закона термодинамики. Энергия в данной схеме не берется из ниоткуда – она просто переводится из одной формы (из тепла, содержащегося в океанской воде) в другую (кинетическую энергию вращающихся винтов), а переход энергии из одной формы в другую в первом законе термодинамики оговорен отдельно.
Однако ни одна схема такого рода не оказалась работоспособной. Так и не удалось разработать ни одного способа использовать тепловую энергию какого‑либо вещества, температура которого была бы равномерной. Иными словами, общий опыт всего человечества свидетельствует о том, что формула Карно справедлива для любых условий, которые когда‑либо были испытаны. Для того чтобы тепло можно было преобразовать в работу, где‑то в системе должна существовать разность температур.
Лорд Кельвин объяснял это так: «Трансформация, в результате которой должно быть преобразовано в работу тепло, извлеченное из источника, имеющего однородную равномерно распределенную температуру, – невозможна».
Это – одна из формулировок утверждения, получившего название «второй закон термодинамики».
Этот второй закон не кажется таким очевидно неизбежным, как первый. С некоторым сожалением мы чувствуем себя вынужденными признать, что энергию нельзя создавать из ничего (первый закон), но почему же мы не можем использовать ту энергию, которая у нас есть? Пусть мы не можем получить выгоду, но можно же хотя бы остаться при своих?
Давайте рассмотрим этот момент на примере энергии движения, с которой мы имеем дело ежедневно. Должно быть, второй закон термодинамики станет несколько нагляднее, если рассмотреть его по аналогии с падающими телами.
Достигая земли, падающее тело может совершать работу. Оно может убить человека, расколоть орех или просто пробить дырку в земле, но в любом случае – это очевидная работа. Достигнув же поверхности, тело больше никакой работы совершать не способно, по крайней мере до тех пор, пока продолжает лежать неподвижно. Соответственно своей способностью совершить ту работу, которую оно совершило, это тело обязано тому факту, что оно переместилось из точки с большим потенциалом энергии (к примеру – с вершины километровой скалы) в точку с меньшим потенциалом (к подножию той же скалы).
Но и покоящееся на поверхности земли тело тоже обладает некоей энергией. Если под ним выкопать шахту в километр глубиной и сбросить его в эту шахту, то тело вновь сможет проделать работу, такую же как и когда падало со скалы. Это происходит потому, что вновь создана разность потенциалов.
То же самое происходит и в отношении тепла. Тепло, содержащееся в океанской воде, нельзя перевести в работу без помощи камеры, содержащей нечто более холодное или более теплое, чем океанская вода. Если выразиться логичнее, то можно сказать, что работу совершает не камень, а падение камня, не тепло, а тепловой поток.
Далее, как каждому известно на собственном опыте, падающие тела двигаются только в одном направлении – вниз. Если бы тело могло падать в обоих направлениях, то один и тот же предмет мог бы совершать бесконечную работу, просто двигаясь туда‑сюда – то с вершины скалы в долину, то из долины на вершину скалы. Однако на самом деле предметы падают только из точки с высоким потенциалом энергии в точку с низким.
То же самое происходит и с другими формами энергии, и в частности с теплом. В 1850 году немецкий физик Рудольф Юлиус Эмануэль Клаузиус дал однозначную формулировку этого процесса, сказав, что при любом спонтанном процессе (то есть таком, который происходит сам по себе, без внешнего вмешательства) тепло всегда переходит от более горячего тела к более холодному и никогда – от более холодного к более горячему.
На самом деле мы все это прекрасно знаем и принимаем как должное, что чайник с водой над горящим газом в итоге закипит, а теплая вода – всегда растопит лед. То есть тот факт, что тепло будет переходить от более горячего тела к более холодному, а не наоборот, нам хорошо известен.
То же самое утверждение и является само собой разумеющимся для формулы Карно, поскольку если бы тепло не перетекало от более горячего тела к более холодному, то оно могло бы перетекать и внутри равномерно нагретого резервуара с водой от одной его части к другой, и из этого перетекания можно было бы получать работу. Таким образом, утверждение Клаузиуса – это одна из формулировок правила Карно–Кельвина о невозможности получения работы из равномерно нагретой системы, то есть одна из формулировок второго закона термодинамики.
Клаузиус не только сформулировал это утверждение по поводу тепловых потоков (суть которого известна нам по бытовому опыту и без каких‑либо научных формулировок), но и увидел в нем повод для масштабного обобщения, которое можно распространить на все процессы, в которых используется энергия, при любых условиях и в любом месте Вселенной. По этой причине именно ему приписывают честь «открытия» второго закона термодинамики.
Это подводит нас к интересному моменту. Любой тепловой машине для преобразования тепла в работу требуется некоторое время. Ни одна из них не способна производить работу мгновенно. За время работы тепло перетекает из горячей камеры в окружающую среду (которая, как правило, сама по себе холоднее, чем горячая камера) и никогда – наоборот. Таким образом', горячая камера охлаждается, а холодная камера нагревается. Разность температур становится со временем все меньше и производит все меньше работы по сравнению с изначальной разностью температур[2].
Можно придумать тепловую машину, в которой и горячая и холодная камеры имели бы более высокую температуру, чем окружающая среда, но в этом случае горячая камера теряла бы тепло быстрее, чем холодная. Если же, наоборот, температура обеих камер будет ниже температуры окружающей среды, то горячая камера будет нагреваться медленнее холодной. И в том и в другом случае разность температур будет уменьшаться. На самом деле в любой системе, переводящей в любой форме энергию в работу, со временем разность потенциалов уменьшается, или, иначе говоря, часть потенциально выполнимой разностью потенциалов энергии работы остается невыполненной на практике из‑за необходимости преодолевать трение или иные формы сопротивления естественному потоку энергии.
Клаузиус еще в 1875 году изобрел параметр, включающий в себя и неизбежно теряемую энергию, и абсолютную температуру, – параметр этот получил название «энтропия системы».
Можно, конечно, представлять себе совершенные тепловые машины, настолько хорошо изолированные, что тепло не будет ни перетекать в них извне, ни тратиться на нагревание окружающей среды, машины, в которых будут отсутствовать потери на трение, и так далее. При таких условиях выполняться будет вся работа, на которую способна заданная разность температур. Энергия будет тратиться полностью, без потерь. Однако в реальности и трение, и теплообмен с внешней средой всегда имеют место, а значит – и энергопотери, причем их объем будет увеличиваться со временем (рис. 4).
В свете теории Клаузиуса можно сказать: при любом спонтанном процессе энтропия либо остается неизменной (в идеальном случае), либо возрастает (в реальных случаях).
Однако забудем об идеале – приходится признать, что в реальном мире вокруг нас энтропия всегда увеличивается.
Поскольку все это – неизбежные последствия однонаправленности тепловых потоков, то существует еще один способ выражения второго закона термодинамики.
Строго говоря, отдавая должное законам термодинамики, мы всегда должны помнить о том, что эти законы применимы только к замкнутым системам – то есть к тем частям Вселенной, которые можно рассматривать как не испытывающие никакого влияния извне со стороны других ее частей. Если же рассматривать открытые системы, то часто может казаться, что законы термодинамики нарушаются.
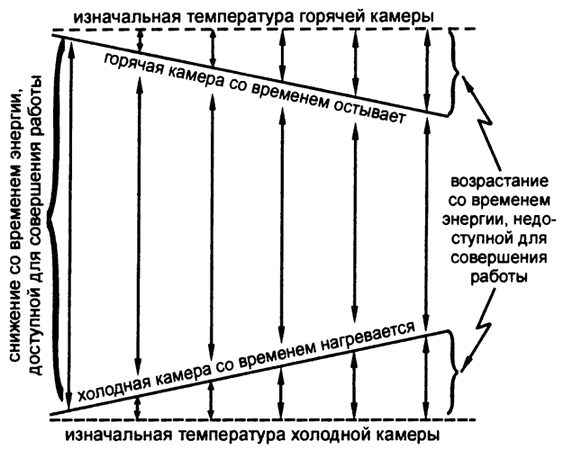
Рис. 4. Изменение количества доступной энергии со временем
Например, предположим, что вы ведете наблюдения за котелком с водой, стоящим на плите. Вы видите, что энергетическое содержание воды в котелке постепенно возрастает, пока вода не начнет кипеть и пока, наконец, вся не выкипит. Если рассматривать один лишь котелок с водой, вне его связей с плитой, то может показаться, что энергия, дерзко нарушая первый закон термодинамики, появилась из ниоткуда. Однако вы прекрасно понимаете, что это не так, поскольку под котелком находится горячая плита или газовый рожок. Если принять во внимание, что система складывается из обеих этих частей, то вопрос о том, почему на закипающий котелок не действует первый закон термодинамики, снимается сам собой.
Что касается второго закона термодинамики в отношении открытых систем, то представьте себе – тело действительно может подниматься с земли на высоту, а тепло – перетекать от более холодных тел к более горячим. В быту вы часто являетесь свидетелем подобных «феноменов», и если сосредоточить внимание только на поднимающемся теле или только на тепловом потоке, то вполне возможно сделать вывод о нарушении второго закона термодинамики.
Однако рассматривать систему надо в целом. Тело может подниматься с земли на крышу дома только тогда, когда оно находится, скажем, в лифте, движимом электрическим мотором. Тепло утекает из холодной камеры холодильника в более теплую окружающую среду тоже благодаря электрическому двигателю. Если включить в расчет двигатель и поток энергии внутри его, то вы увидите, что имеется и поток энергии в «правильном» направлении, причем превышающий по объему поток в «неправильном», действие которого мы видим как подъем тела или охлаждение камеры.
Другими словами, локальное уменьшение энтропии (являющееся результатом потока энергии в направлении, противоположном указанному вторым законом термодинамики) в одной из частей системы всегда более чем уравновешивается возрастанием энтропии в другой части системы. Если брать в расчет всю систему целиком, то общие изменения всегда происходят в направлении увеличения энтропии.
На самом деле, если мы имеем дело не с воображаемыми системами, существующими только в умах физиков‑теоретиков, а с реальностью, то представить себе действительно замкнутую систему очень сложно. Внешняя среда всегда оказывает некоторое действие, которое необходимо учитывать.
Все вышеописанное справедливо и в отношении человеческого организма. Если его вдруг сделать замкнутой системой, лишенной энергообмена с окружающей средой, то он умрет в течение нескольких минут (ведь воздух – тоже часть окружающей среды). Направление естественных изменений в человеческом организме, сопровождающихся, как уже было сказано, возрастанием энтропии, ведет к смерти. Мы, конечно, живем, не умирая, иногда по целой сотне лет, но это происходит только потому, что наш организм является не замкнутой системой, а частью большей системы, в которую входят и воздух, которым мы дышим, и пища, которую мы едим. Сложность общего взаимодействия всех форм жизни и всей неодушевленной окружающей среды на планете, на которой мы живем, не позволяет считать замкнутой системой что‑либо меньшее, чем всю Землю в целом.
Но и этого мало. Если бы Земля была замкнутой системой, то жизнь на ней очень быстро закончилась бы, поскольку поверхность планеты остыла бы, океаны – замерзли и так далее. Это тоже естественные изменения, соответствующие возрастанию энтропии. Этого не происходит только благодаря тому, что Земля является частью более крупной системы, в которую входит еще и Солнце, тепло которого и не дает Земле замерзнуть.
Даже Солнечная система не является полностью замкнутой. На нее действует сила притяжения со стороны других тел Галактики и много других не так ярко выраженных сил. Каждая часть Вселенной тем или иным образом влияет на остальные, и логично предположить, что на свете существует только одна действительно замкнутая система – это сама Вселенная. Если же рассматривать любую ее часть, то появляется вероятность того, что в этой отдельно взятой части энтропия может уменьшаться – за счет еще большего ее увеличения во всей остальной Вселенной.
Ясно, что если общее количество тепла во Вселенной ограниченно, а энтропия продолжает возрастать, то в конце концов она достигнет максимума, то есть такого состояния, что никакой разности температур не будет вообще. Вся энергия во Вселенной станет недоступной для совершения работы – все спонтанные процессы прекратятся и какие‑либо изменения перестанут происходить вообще. Эта картина получила название «тепловая смерть Вселенной», и теория о тепловой смерти приобрела большую популярность во второй половине XIX века.
Теперь давайте вернемся к началу нашего повествования и посмотрим, можно ли выразить в терминах термодинамики то различие между живой и неживой материей, которое я высказал в первой главе. Я сказал, что живые существа могут совершать усилия, а неживые – нет.
Понятно, что «совершение усилия» подразумевает локальное уменьшение энтропии. Для того чтобы опустить висящий в воздухе камень вниз, усилия не требуется – его достаточно отпустить, и он упадет. А вот для того, чтобы поднять его вверх, усилие необходимо.
Сам по себе камень может двигаться только вниз, в том направлении, где усилия не нужно. Он не может совершить усилие, чтобы подняться наверх. С точки зрения термодинамики это будет звучать так: камень сам по себе может быть подвержен только увеличению энтропии, но не ее уменьшению.
Живой же организм способен совершать усилия по уменьшению энтропии по крайней мере на одном участке системы, частью которой он является (разумеется, за счет еще большего ее увеличения в других частях системы). Даже простейшие живые существа способны создавать локальное уменьшение энтропии, когда они прыгают, летят, лезут, идут, ползут или плывут вверх, против силы притяжения. Даже не сдвигающиеся с места организмы, например устрицы, тоже могут производить локальное уменьшение энтропии различными другими способами.
Удовлетворимся ли мы заявлением, что различие между живыми и неживыми организмами заключается в том, что живые организмы могут производить локальное уменьшение энтропии, а неживые – нет?
Что ж, выдвинув это утверждение, мы явно встали на верный путь, но, к сожалению, такого определения пока недостаточно. Солнечное тепло тоже может вызывать локальное уменьшение энтропии, когда выпаривает воду из океана, то есть поднимает в воздух огромные массы водяного пара. Силы, задействованные в геологических процессах, происходящих в земной коре, способны воздвигать горы в несколько миль высотой, что тоже подразумевает масштабное уменьшение энтропии. Однако ни Солнце, ни Земля не являются живыми ни в одном из смыслов, которые вкладывает в это понятие человек.
Надо еще поработать над нашим определением. Итак, продолжим.
Глава 6.
ДВИЖУЩИЕСЯ ЧАСТИЦЫ
Еще со времен Джоуля, Кельвина, Майера, Гельмгольца и Клаузиуса, со времен открытия двух великих законов термодинамики, точного представления о том, что же такое тепло, не существовало. По крайней мере, такого, которое удовлетворило бы работающих с теплом ученых.
Это совершенно не означает, что законы термодинамики неполноценны, – они основаны на наблюдениях и не зависят от природы тепла. Однако с практической точки зрения этот факт осложнял применение законов термодинамики к каким‑либо иным энергетическим устройствам, кроме тепловых машин, – к тем, где отсутствует тепловой поток.
Например, человеческий организм – главный предмет рассмотрения данной книги – определенно работает, и при этом температура его (37 °С) однородна и постоянна.
Разве это не является нарушением второго закона термодинамики? Мы уверены, что не является, но для того, чтобы четко понимать, почему именно не является, надо понять новую концепцию тепла как такового, выдвинутую впервые около 1800 года, а окончательно принятую научным сообществом только в 1860 году.
Начнем с того, что среди прочих над природой тепла размышляли и такие ученые, как Галилей и Ньютон. Они (и не только они) представляли себе тепло как движение мельчайших частиц материи. Для них это было вполне естественное предположение, поскольку эти великие ученые, исследуя в первую очередь законы движения и представляя тепло одной из форм движения, стремились вписать его в рамки своих грандиозных обобщений.
Однако в XVIII веке принято было представлять тепло как невесомый нематериальный ток. Такую точку зрения впервые выдвинул голландский физик Герман Бургаве примерно в 1700 году. В общем‑то никаких объективных причин считать, что тепло представляет собой движение или вибрации, либо предполагать, что в горячих телах это движение или эти вибрации происходят быстрее, чем в холодных, не было. Разговоры о том, что, мол, существуют некие микрочастицы, слишком маленькие для того, чтобы их можно было увидеть, и вибрирующие слишком быстро и малоамплитудно для того, чтобы это можно было заметить, дети «эпохи рассудка» могли воспринимать только как заумную фантасмагорию.
Точнее говоря, в 1738 году профессор‑математик из Санкт‑Петербурга, столицы России, которого звали Даниил Бернулли, показал, что если представить газы состоящими из крошечных частиц, то из этого можно сделать вывод, что за давление газа отвечает движение этих частиц. Более того, предложенная им математическая модель, при которой скорость этих частиц возрастает по мере повышения температуры, в точности описывала реальные данные наблюдений. Однако его современники сочли эту теорию не более чем забавной спекуляцией. Большинство ученых предпочли принять на вооружение теорию теплорода – невесомого флюида, содержащегося в веществах, поскольку уже тогда было известно (по крайней мере, в представлении общественности) немало подобных флюидов в других областях: свет, электричество, магнетизм и т. п. Все были уверены в существовании такого явления, как «флогистон», – считалось, что его испускает в воздух любое вещество, сгорая или ржавея. Почему бы теплу не быть чем‑то подобным? Так и сочли, и флюид тепла получил название «теплород».
Представление об одном из таких флюидов было торжественно похоронено в 1770‑х годах, когда Лавуазье опроверг гипотезу о существовании флогистона, заменив ее тем представлением о природе горения и ржавления, которое мы разделяем и сейчас. Он показал, что при этих процессах не теряется или приобретается флогистон, а происходят химические реакции с содержащимся в воздухе кислородом. Однако существование теплорода тот же Лавуазье подтвердил, подкрепив эту теорию собственным авторитетом величайшего химика своего времени. Благодаря его заступничеству теория теплорода продержалась еще полвека, несмотря на лавинообразный рост фактов, свидетельствующих против нее.
Первые эксперименты, результаты которых однозначно указывали на ошибочность поддерживаемой Лавуазье теории теплорода, провел эмигрант из Америки Бенджамин Томпсон. Томпсон был тори и бежал из Америки во время Войны за независимость. Впоследствии, в 1791 году, курфюрст Баварский пожалует ему графский титул, и новоиспеченный граф вскоре женится, как ни забавно, на вдове самого Лавуазье. В историю он попал под именем графа Рамфорда.
В 1798 году граф Рамфорд наблюдал за высверливанием пушечного жерла в одной из оружейных мастерских курфюрста. В процессе погружения сверла в металлический цилиндр выделялось очень много тепла. Чтобы избежать перегрева, отверстие, в котором работало сверло, заливали водой и постоянно подливали ее по мере выкипания.
Сторонники теории теплорода не могли отрицать, что при такого рода трении вырабатывается тепло, и объясняли это так: металлический предмет всегда содержит тепло, а когда сверло вскрывает поверхность предмета, тепло выходит наружу. Рамфорд отметил в связи с этим два факта. Во‑первых, количество содержащегося в металле тепла кажется бесконечным – сколько его ни сверли, тепло не перестает вырабатываться. А во‑вторых, даже сточившееся сверло, уже практически не углубляющееся в металл, все равно производит не меньше тепла – а строго говоря, даже больше.
Рамфорду пришло в голову лишь одно вразумительное объяснение, почему при сверлении вырабатывается тепло – потому что в него переходит производимая работа. Рамфорд даже придумал единицу измерения механического эквивалента тепла на полвека раньше Джоуля, но выбранное им значение было слишком уж велико. Граф решил, что работа и тепло – тесно взаимосвязанные явления, и, поскольку работа, за которой он наблюдал, представляла собой механическое движение, Рамфорд заключил, что тепло тоже должно представлять собой одну из форм механического движения.
Через год, в 1799 году, близкий по сути эксперимент провел английский химик Гемфри Дэви. Он взял два куска льда и стал тереть их друг о друга с помощью механического устройства при температуре чуть ниже точки замерзания воды. Согласно господствовавшей на тот момент теории теплорода, при такой температуре лед просто не мог содержать в себе достаточно теплорода, чтобы растаять. Однако в процессе трения лед все же начинал таять. Дэви, как и граф Рамфорд, сделал вывод, что энергия движения переводится в тепло, а значит, тепло – это одна из форм движения.
Несмотря на это, теория теплорода господствовала в умах еще несколько десятков лет.
Поколебать ее господство удалось не путем изучения тепла как такового, а путем изучения материи. XVII и XVIII века стали периодом постепенного накопления знаний о свойствах газов. В четвертой главе уже упоминалось о законах Бойля и Шарля. Все эти знания просто взывали к тому, чтобы свести их в единую теорию вроде той, которую безуспешно пытался продвинуть Бернулли.
И вот в 1803 году английский химик Джон Дальтон продвинулся еще дальше. Он предположил, что не только газы, но и вообще любое вещество состоит из крошечных частиц, слишком маленьких, чтобы их можно было увидеть, неделимых и неразрушимых. Он назвал такие частицы «атомами». Этот термин происходит из древнегреческой философии, поскольку еще среди древних греков были философы, которые придерживались сходных взглядов. Однако греки в свое время не увидели в этих теориях ничего, кроме пустых рассуждений, и отвергли их. А Джон Дальтон – и это принципиальная разница! – положил в основу своих выводов строгие экспериментальные данные.
Несмотря на это, теория Дальтона не сразу овладела умами химиков – скорее всего, из‑за того, что уложить в голове представление о существовании каких‑то частиц, слишком малых для того, чтобы быть заметными в принципе, очень сложно. Но мало‑помалу стало выясняться, что эта теория в силах дать ответ на многие вопросы. В ее рамках описывались не только свойства газов (как в теории Бернулли), но и многие свойства химических реакций твердых и жидких веществ. Все реакции обретали единую логику, если рассматривать их как взаимодействие различного рода атомов, связанных в определенные группы (позже их назовут «молекулами»), которые распадаются, чтобы дать возможность образовавшим их атомам связаться уже по‑другому. Сами по себе атомы так и продолжали оставаться невидимыми, но преимущества, которые несла с собой теория атомов в отношении понимания свойств вещества, понемногу заставляли ученых ее принять.
Датировать завершение этого процесса можно 1858 годом, когда итальянский химик Станислао Канниццаро опубликовал трактат, где химические явления объяснялись через теорию атомов. Приводимые им объяснения были столь четкими и ясными, что непонимания не осталось уже ни у кого. Два года спустя на конференции химиков в Карлсруэ (Германия) Канниццаро активно отстоял эту теорию, убедив присутствующих как фактическими свидетельствами, так и силой собственного авторитета. С этого момента теория атомов стала единственной господствующей и продолжает оставаться таковой по сей день, хотя на сегодня об атомах известно уже, что они сами по себе гораздо сложнее тех неделимых маленьких шаров, лишенных собственных свойств, какими описывали их Дальтон и Канниццаро.
Взирая на материю, и в первую очередь на газы, как на совокупность одиночных атомов или, чаще, групп атомов, именуемых молекулами, логично было вернуться к давнишним рассуждениям Бернулли о том, как свойства газов можно объяснить через движение составляющих их частиц. Были проведены дополнительные эксперименты, результаты которых интерпретировались уже в свете теории атомов.
К примеру, Джоуль, проводя в 1840‑х годах свои эксперименты по превращению всеми возможными способами работы в тепло, исследовал расширение газов такими способами, при которых работа не была задействована. Расширяясь, газы не толкали никаких поршней и не приводили в движение никаких предметов. Они просто расширялись в пустоту. Когда это происходило, Джоуль замерял температуру газов и сперва не обнаруживал ни ее повышения, ни понижения, как и ожидалось от процесса, в котором не задействована работа.
Однако в 1852 году, работая вместе с Томсоном (который позже станет лордом Кельвином), он установил, что на самом деле в таких случаях все же происходит небольшое понижение температуры. Это явление до сих пор называют «эффектом Джоуля–Томсона». Понижение температуры свидетельствует о том, что расширение газа на самом деле не является процессом, где не задействовано никакой работы. Молекулы газа испытывают друг к другу слабое притяжение, и движение против силы этого притяжения и есть тот момент, где совершается работа. Энергия, необходимая для совершения этой работы, берется из теплового содержания газа, так что в результате температура несколько падает.
Наличие этой силы межмолекулярного притяжения несколько усложняет расчеты, которыми должны описываться свойства газа, но химики‑теоретики упростили себе жизнь, взяв за материал для своих формул некий воображаемый «идеальный газ», в котором сила притяжения между молекулами равна нулю, как и суммарный объем самих молекул.
Строго говоря, описываемая таким образом ситуация невозможна, но ее изобретение настолько упрощает расчеты, что позволяет теоретикам выводить из них простые законы. Эти законы приблизительно справедливы для реальных ситуаций и, будучи однажды сформулированными, в дальнейшем могут подвергаться всевозможным уточнениям для каждого конкретного случая. Это явно более благодарный подход, чем пытаться с самого начала математически просчитывать все детали реальных ситуаций.
И закон Бойля, и закон Шарля в точности применимы только к идеальному газу, и если свести их воедино, то мы получим простое «уравнение состояния газов», которое описывает состояние таких параметров газа, как температура, давление и объем. Зная любые два из этих параметров, можно сразу же высчитать третий. В отношении реальных газов результат таких расчетов будет соответствовать действительности лишь приблизительно (хотя порой очень близко к точному). Однако уравнение состояния газов вполне можно модифицировать таким образом, чтобы в нем учитывались и сила межмолекулярного притяжения, и объем молекул. Голландский физик Йоханнес Дидерик ван‑дер‑Ваальс с большим успехом привел одну из таких модификаций в 1873 году.
Я надеюсь, что это объяснит тот факт, что в течение 1850‑х годов множество исследователей (в том числе и Клаузиус), прекрасно зная, что на самом деле это не так, продолжали дорабатывать работу Бернулли исключительно для газов с нулевым объемом частиц, не оказывающих друг на друга никакого воздействия. В результате родилась кинетическая теория газов, то есть теория, рассматривающая частицы в движении.
Дата добавления: 2016-01-26; просмотров: 573;
