ИЗМЕРЯЕМОЕ ДВИЖЕНИЕ 2 страница
Температура является для тепла тем же, чем потенциальная энергия – для массы. Тепло переходит от горячих предметов к холодным так же, как вода стекает вниз. Лично я с удовольствием заменил бы слово «температура» на «тепловой потенциал» – называем же мы движущую силу электрического тока «электрическим потенциалом», зная, что электричество всегда течет из точки с высоким потенциалом в точку с низким.
Потенциальную энергию тела мы можем узнать, измерив высоту его положения над уровнем моря. А можно ли как‑то измерить температуру? Первым принцип ее измерения придумал Галилей. Практически все вещества расширяются при нагревании и сжимаются при охлаждении. И в 1592 году Галилей изобрел «воздушный термометр», в котором, в зависимости от температуры, измерялся объем воздуха, что приводило к изменению уровня воды в трубке. К сожалению, на уровень воды в трубке влиял также и такой параметр, как атмосферное давление, так что показатели такого термометра были ненадежными.
За этим термометром последовали другие, закрытые, на которые атмосферное давление уже не влияло. В таких термометрах жидкость заливали в колбу, и она частично заполняла тоненькую запаянную капиллярную трубку таким образом, что даже небольшие изменения общего объема жидкости заметным образом сказывались на уровне этой жидкости в трубке. Изменения уровня и отражали изменения температуры.
В 1715 году немецкий физик Габриэль Даниэль Фаренгейт впервые использовал в качестве жидкости, уровень которой изменялся в тщательно градуированной трубке термометра, ртуть. Таким образом и был изобретен инструмент, которые мы до сих пор пользуемся в неизменном виде. В Соединенных Штатах, Великобритании, Канаде, Южной Африке, Австралии и Новой Зеландии до сих пор используется и шкала Фаренгейта, разработанная им самим. На этой шкале температуре таяния льда соответствует показатель 32 градуса (обозначается 32°), а температуре кипения воды – 212°. Шкала обозначается буквой F после цифр.
В других странах, а также в научной среде используется десятичная шкала, которую разработал шведский астроном Андерс Цельсий, где температура таяния льда взята за 0°, а температура кипения воды – за 100°. Шкала Цельсия обозначается буквой С после цифр.
Изобретение термометра позволило получить некоторые данные не только о температуре, но и о количестве тепла, содержащегося в веществе.
Предположим, что литр спирта нагрели до 60°, а затем быстро перемешали с литром воды температурой 20°. Тепло, естественно, перейдет от горячего спирта к холодной воде. По ощущениям понятно, что температура получившейся смеси – «что‑то среднее» между горячим спиртом и холодной водой. Естественно предположить, что она будет представлять собой среднее значение, и если бы не было термометра, то исследовать этот вопрос глубже не удалось бы.
Однако, когда оказалось, что температуру можно измерить, «ощущение чего‑то среднего» перестало удовлетворять нас как показатель температуры итоговой смеси. Напрашивалось предположение, что, перемешав равные объемы жидкости с температурой 20° и 60°, мы получим в итоге смесь с температурой 40°, однако оказалось, что это не так. Температура получившейся в итоге смеси воды со спиртом оказалась всего 36°.
Почему? Очевидно, что количество тепла, содержащегося в нагретом до определенной температуры спирте, меньше, чем количество тепла, содержащегося при тех же условиях в воде. Другими словами, количество тепла, необходимого для нагрева спирта на 10°, меньше, чем количество тепла, необходимого для нагрева на эту же температуру воды. И наоборот, количество тепла, отдаваемого спиртом при охлаждении на 10°, меньше, чем количество тепла, отдаваемого при этом же процессе водой. Можно использовать аналогию, представив, будто вода и спирт – это широкий и узкий сосуды с водой. Для того чтобы в широком сосуде уровень воды поднялся на 5 сантиметров, нужно больше воды, чем для того, чтобы добиться того же самого в узком. Если уровень воды в обоих сосудах будет одинаковым, то в широком жидкости будет больше. Так и здесь – если нагреть воду и спирт до одной и той же температуры, вода будет содержать при этом больше тепла.
Тогда загадка низкой температуры смеси спирта и воды объясняется. Тепла, высвобождаемого при охлаждении алкоголя на 24° (с 60° до 36°), достаточно ровно для того, чтобы нагреть равный объем воды лишь на 16° (с 20° до 36°), и в итоге мы получаем температуру общей смеси 36°.
Шотландский физик Джозеф Блэк стал первым исследователем данного явления. К 1760 году он провел множество экспериментов по измерению количества тепла, необходимого для того, чтобы нагреть определенное количество различных веществ на определенное количество градусов. Это свойство ученый назвал «удельной теплоемкостью» вещества.
За единицу была взята теплоемкость воды. Для нагревания спирта требуется 2/3 от количества тепла, необходимого для нагревания воды.,. Значит, теплоемкость спирта – приблизительно 0,65. Теплоемкость еще одной жидкости, ацетона, – 0,5 и так далее.
Обнаружилось, что теплоемкость воды очень велика; она оказалась одной из самых высоких вообще. А у большинства металлов теплоемкость оказалась крайне низкой: теплоемкость алюминия – 0,22; меди – 0,093; свинца – 0,031. Мы и из бытового опыта знаем, как быстро раскаляется на газу пустая алюминиевая кастрюля и как долго нагревается даже небольшое количество воды.
Точности ради надо добавить, что на измерение теплоемкости влияет также и температура измеряемого вещества – горячее вещество имеет большую теплоемкость, чем холодное.
Все эти эксперименты не могли не привести к необходимости разработки единиц измерения количества тепла (не путать с температурой!).
За такую единицу было взято количество тепла, необходимое для того, чтобы нагреть 1 грамм воды с 14,5° до 15,5°. Единица эта получила название «калория», от латинского слова, означающего «тепло». Естественно, используется также и более крупная единица – килокалория, это то количество тепла, которое необходимо, чтобы нагреть 1 килограмм воды опять же с 14,5° до 15,5°. Килокалория в тысячу раз больше, чем калория.
Зачастую в обиходе последнюю тоже называют «калорией», и это приводит к путанице. Особенно часто неправильным использованием слова «калория» злоупотребляют диетологи, подразумевая под ним конечно же «килокалорию».
Но вернемся к Джозефу Блэку. Ему принадлежит честь совершения еще одного важного открытия в области изучения тепла. Он обнаружил, что лед при нагревании плавится, но при этом образующаяся в процессе смесь воды и льда не начинает нагреваться до тех пор, пока не растает весь лед. Количество теплоты, затраченной на процесс таяния льда, оказалось таким, что если бы оно пошло на нагревание такого же количества ледяной воды, то вода нагрелась бы почти до точки кипения. На то, чтобы растопить один грамм льда, тратится 80 калорий. Блэк описал эту теплоту как «латентную», то есть «скрытую», «невидимую», поскольку теплозатраты не отражаются на подъеме температуры. Как и слово «потенциальный» в словосочетании «потенциальная энергия», дополнительное определение было введено для обозначения чего‑то, что присутствует неочевидным образом. В современной физике эту теплоту называют «теплотой плавления» (в данном случае «плавление» равнозначно «таянию»).
Существует еще одна форма латентной теплоты – это теплота, затраченная на кипячение жидкости. При добавлении теплоты к кипящей жидкости ее температура не растет, жидкость просто кипит, пока не выкипит до конца. На кипячение тратится еще больше тепла, чем на таяние. Так, на выпаривание одного грамма нагретой до 100° воды тратится около 540 калорий, а в результате получается один грамм пара той же температуры. Это «теплота кипения».
Кроме того, Блэк обнаружил, что при замерзании воды (или конденсации пара обратно в воду) латентная теплота выделяется обратно. Вещество поглощает тепло при таянии и выделяет при замерзании, поглощает при испарении и выделяет при конденсации. Этот процесс напоминает переход энергии из кинетического в потенциальное состояние и обратно, что позволило выдвинуть предположение о том, что тепло – это сохраняемое явление или, как минимум, является частью некоего составного сохраняемого явления.
Значит, чтобы изменение температуры можно было представить с помощью измененной объема жидкости, объем жидкости должен изменяться равномерно. Иначе промежутки между градусами на шкале термометра были бы неравномерными. Равномерность изменений объема – ни в коем случае не само собой разумеющееся явление. Например, вода по мере нагревания расширяется неравномерно. На самом деле на промежутке от 0 до 4 градусов вода даже сжимается с повышением температуры. А вот ртуть, как оказалось, расширяется вполне равномерно, и это – одна из причин, по которой именно ртуть используют в градусниках.
Сначала изучению подвергались, естественно, те жидкости, которые используются в градусниках. Неудачная попытка Галилея создать газовый термометр казалась забытой, и последующие двести лет изучению влияния изменения температуры на газы уделялось крайне мало внимания.
Так, в 1660 году английский физик Роберт Бойль первым показал, что давление и объем заданного количества газа находятся в обратно пропорциональном отношении (закон Бойля). Если удвоить давление на газ, его объем уполовинится; если утроить давление – объем сократится втрое, и так далее. Это один из краеугольных камней современной химии, но Бойль забыл указать, что это соотношение верно только при неизменной температуре. Очевидно, температура и ее влияние на объем газов не входили в сферу его интересов.
Примерно в 1680 году французский физик Эдм Мариотт независимо от Бойля заново открыл его закон, и вот он уже отметил, что на объем газа оказывает влияние также и температура. В Европе закон Бойля называют законом Мариотта, в русскоязычной же терминологии этот закон носит двойное название – закон Бойля–Мариотта.
Следующий шаг совершил в 1699 году французский физик Гийом Амонтон, отметив, что изменение температуры на заданную величину приводило к одинаковому в процентном соотношении расширению различных масс воздуха.
Однако лишь в 1787 году этот вопрос подвергся точному измерению. Французский физик Жак Александр Сезар Шарль окончательно продемонстрировал, что газы расширяются и сокращаются равномерно по мере измерения их температуры (закон Шарля) – два века спустя после того, как Галилей интуитивно догадался о том же самом и создал свой термометр.
Шарль выяснил, что газ (а лишь в XVIII веке впервые было установлено существование иных газов, кроме воздуха) расширяется примерно на 1/273от своего объема при 0° с повышением температуры на каждый градус. Соответственно при понижении температуры на 1º газ сокращался в объеме на 1/273от своего объема при 0°.
То есть если мы возьмем 273 литра газа при температуре 0° и начнем нагревать, то его объем вырастет до 274 литров при Г, до 275 – при 2°, до 276 – при 3°, и так далее. И наоборот, при ‑1º объем газа сократится до 272, при ‑2° – до 271, при ‑3° – до 270, и так далее.
Если предположить, что закон Шарля верен до самого конца, то при ‑273° объем газа станет равным нулю, а при более низких температурах величина объема газа примет отрицательное значение, чего быть не может в принципе.
Физиков такие расчеты не особенно изумляли, поскольку основывались на предположении, что закон Шарля верен и для сверхнизких температур, хотя имелись некоторые признаки, позволяющие предположить, что это не так. Во времена Шарля и еще столетие спустя получение действительно низких температур было делом невозможным, и проверить действие закона в таких условиях соответственно было нельзя. Однако уже к 1900 году стало ясно, что задолго до ‑273° все газы конденсируются в жидкости, а на жидкости закон Шарля не распространяется. Так что – никакого парадокса.
Тем не менее температура в ‑273° действительно оказалась неким критическим значением, и ученые считают ее абсолютным нулем, точкой, ниже которой температура опуститься не может в принципе. Сейчас самым точным значением абсолютного нуля называют ‑273,16°, но мы позволим себе округлить это значение. Абсолютный ноль – это температура, при которой тело вообще не содержит тепла. Если принять ее за ноль и отсчитывать от нее привычные нам градусы по Цельсию, то получится, что вода замерзает при 273°, закипает при 373° и так далее. Это – абсолютная шкала температуры (рис. 3).
В 1848 году английский физик Уильям Томсон (позже он получит статус пэра, и нам он сейчас более известен как лорд Кельвин) установил эту систему на прочную теоретическую основу. Поэтому абсолютную шкалу чаще называют «шкалой Кельвина», и, скажем, температуру замерзания воды по ней можно обозначить и как 273 °А, и как 273 °К, причем последнее обозначение встречается чаще.
На шкале Фаренгейта абсолютный ноль – это ‑460 °F (точнее, ‑459,69 °F), и можно взять эту точку за ноль, а дальше отсчитывать от нее градусы по Фаренгейту. Первым, кто стал пользоваться такой шкалой, был шотландский инженер Уильям Джон Макуорн Ранкин, и шкала эта теперь называется «шкалой Ранкина». Точка замерзания воды на этой шкале будет равна 492 °Rank, а точка кипения воды – 672 °Rank.
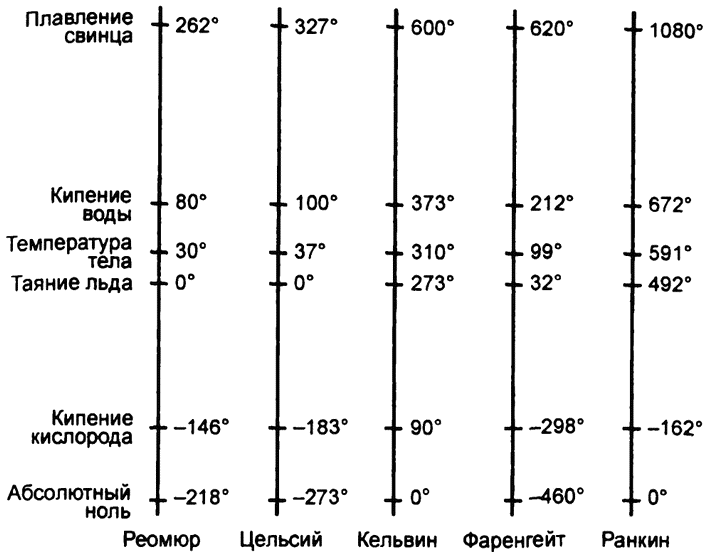
Рис. 3. Различные виды температурных шкал
(Название шкалы не сокращается до «R», как можно было бы ожидать, потому что существует еще шкала температуры по Реомюру, которую разработал французский физик Рене Антуан Фершо де Реомюр в XVIII веке, и буквой «R» обозначается именно она. На шкале Реомюра точка замерзания воды – 0 °К, а точка кипения воды – 80 °R. Шкала Реомюра никогда не пользовалась особой популярностью и сейчас представляет сугубо исторический интерес.)
Когда температура и содержание тепла стали легкоизмеримыми явлениями, ученые радостно приняли их под свое крыло и стали по‑новому смотреть на энергию. С наступлением XIX века энергию перестали рассматривать как нечто неотрывное от движения. Усиленное внимание к механической энергии привело к замечательным достижениям в XVII и XVIII столетиях, но теперь требовалось нечто большее.
Паровая машина ясно продемонстрировала, что тепло может совершать работу так же, как и падающее тело, и что теплоту соответственно можно считать одной из форм энергии. Магнетизм тоже был признан одной из форм энергии (собственно, в некоторой степени это было ясно уже в Средние века), а проводимые в XVIII веке эксперименты с электричеством показали, что оно тоже является формой энергии.
Само слово «энергия» ввел в науку в 1807 году английский физик Томас Юнг. Наиболее важные из его исследований касались света – еще одной из форм энергии. За несколько десятилетий термин «энергия» расширился до его сегодняшнего понимания и стал означать все, что может производить работу.
Многие ученые стали понимать, что закон сохранения энергии казался нечетко соблюдаемым просто потому, что при оценке не учитывались некоторые из ее форм, в первую очередь – тепло. Так, например, стало ясно, что потери механической энергии при трении сопровождаются выработкой тепла, а значит, вполне возможно, что потери механической энергии уравновешиваются производством энергии тепловой?
В этом отношении выдающимся экспериментатором был английский физик Джеймс Прескотт Джоуль, занимавшийся изучением того, сколько тепла может произвести тот или иной объем работы. Если закон сохранения энергии действительно верен, то при точном учете всех ее форм заданный объем работы должен приводить к образованию одного и того же количества тепла, независимо от того, какая форма энергии использовалась при совершении работы.
Джоуль начал свои измерения в 1840 году и продолжал их на протяжении десятилетий. Он производил тепло различными способами – путем пропускания электрического тока через проволоку, путем наливания воды в тонкие стеклянные трубки, взбивая лопастями сначала воду, потом масло, потом ртуть, путем трения чугуна, путем пропускания электричества напрямую через раствор, путем вращения проволочной спирали между полюсами магнита…
И каждый раз он подсчитывал количество совершенной работы и количество произведенной при этом теплоты и обнаруживал, что одно и то же количество работы, независимо от источника энергии, всегда приводило к образованию одного и того же количества теплоты. Таким образом Джоуль разработал «механический эквивалент теплоты». Оказалось, что 1 калории тепла соответствует примерно 41 800 000 эрг. работы. В честь Джоуля его именем назвали единицу в 10 000 000 эрг., так что мы можем сказать, что 1 калории соответствует 4,18 джоуля.
Джоулю в 1840‑х годах казалось ясным, что в реальном мире энергия действительно сохраняется, если учитывать все без исключения ее формы. По крайней мере, ему не встретилось ни одного случая, где энергия бы не сохранялась. И в течение того же самого десятилетия то же самое поняли и двое немецких ученых – Юлиус Роберт фон Майер и Герман Людвиг Фердинанд фон Гельмгольц.
Сегодня именно Гельмгольцу принято отдавать пальму первенства в отношении точной и однозначной формулировки принципа сохранения энергии. Этот принцип ученый изложил в книге, изданной им в 1847 году. Согласно содержанию этого научного труда энергию невозможно ни создать, ни уничтожить, она может только переходить из одной формы в другую. Иными словами, общее количество энергии во Вселенной неизменно и никогда не было и не будет иным; нельзя сделать его ни на йоту больше и ни на йоту меньше.
Из некоторых замечаний, находимых в трудах Майера, можно сделать вывод, что он принял этот принцип еще в 1842 году. И он пошел дальше, чем Гельмголыд, причем в том аспекте, который крайне важен для нас в рамках нашей книги. Майер решил, что источником всей энергии, которая есть на Земле, являются солнечный свет и тепло. Более того, он решил, что источником энергии, которую тратят все живые существа, включая человека, тоже является исключительно солнечное излучение. Из этого следовало, что закон сохранения энергии распространяется не только на неживые, но и на живые объекты.
Этот вывод Майера является крайне важным. Человечество всегда считало, что между живой и неживой природой – пропасть. Именно с описания этой пропасти я и начал книгу. До XIX века законы, выводимые учеными для описания деятельности Вселенной, распространялись либо на живые существа, либо на неживую природу, но никогда – и на то и на другое вместе. Планеты двигаются в некоем строго определенном и неизменном порядке, а живые существа – по своему усмотрению. Камень всегда падает вниз, дым – всегда поднимается вверх, но человек может и лечь и подпрыгнуть, как сам того пожелает. С другой стороны, человек или мышь могут поддаться страху или гневу, а кирпич – нет.
И вот впервые родилось предположение о том, что закон природы – закон сохранения энергии – применим в равной степени к живой и к неживой природе. Это был важнейший шаг к пониманию жизни как таковой; возможно, вообще первый шаг к тому, чтобы сделать изучение живой ткани чем‑то большим, нежели просто описание.
Но кажется, мы уходим в сторону от цели данной книги, как я описал ее в первой главе. Я писал о том, что понятия работы и энергии помогут нам найти более четкую, чем интуитивная, границу между живой и неживой природой. А сейчас мы, кажется, движемся в обратном направлении – стирая эту границу вообще.
Но не сдавайтесь! Изучение энергии в XIX веке подразумевало не только открытие закона ее сохранения, и мы это скоро увидим.
Глава 5.
ТЕПЛОВЫЕ ПОТОКИ
Принятие представления о сохранении энергии стало в некоторой степени фундаментальной переменой в системе взглядов человека на Вселенную, переменой, которая даже сейчас не полностью проникла в образ человеческой мысли. Люди всегда верили, что вера может двигать горами; что с помощью волшебной палочки или лампы Аладдина можно построить дворец во мгновение ока; что сапоги‑скороходы могут за считаные минуты переносить своего владельца через леса и горы…
А теперь все эти картинки исчезают, стоит лишь задать простой вопрос: где взять на это энергию?
Если уж нам приходится разбить радужные мечты и настоять на том, что все сводится к балансу поступления и потери энергии, то давайте уж убедимся, что мы действительно имеем на это право. Иными словами, насколько мы можем быть уверены в действенности закона сохранения энергии? Можем ли мы доказать, что этот закон действительно существует?
Если честно – нет. По крайней мере, на данный момент. Убедительных причин, которые однозначно не позволяли бы создавать или уничтожать энергию, никто еще не сформулировал. Мы можем утверждать лишь, что ни в одном из тщательнейших наблюдений, ни в одном из самых разнообразных экспериментов, от Джоуля до наших дней, не было зафиксировано ни одного случая, когда энергия возникала бы ниоткуда или исчезала в никуда.
Пока не будет отмечен хоть один такой случай и пока на практике допущение, что закон сохранения энергии действует, приносит неоценимую пользу в неисчислимом количестве сфер деятельности, ученые от него не откажутся. Они не могут доказать существование этого закона, но уверены в нем, как мало в чем другом.
Лишь однажды глубокая убежденность в существовании закона сохранения энергии была поколеблена. Это произошло в 1896 году, когда было открыто явление радиоактивности. Именно тогда обнаружилось, что некоторые элементы, например уран, непрерывно производят энергию, казалось бы, ниоткуда.
Однако уже в 1905 году физик Альберт Эйнштейн опубликовал новую, в огромной степени фундаментальную, теорию строения Вселенной (ныне обычно именуемую «специальной теорией относительности»), где все прояснилось за счет того, что в расчет была включена и масса.
Дело в том, что масса сама по себе также представляет собой сохранное явление. Этот факт ученые с большим удивлением обнаружили только в конце XVIII века. Неискушенному наблюдателю кажется, что, например, горящая свечка постепенно тает и ее масса исчезает. А когда железо ржавеет – оно, наоборот, набирает вес, и это кажется примером «появления» массы. Такие выводы вполне возможно сделать, если упустить из виду переход твердого или жидкого вещества в газ или, в противоположном случае, поглощение газов из атмосферы.
В 1770‑х годах французский химик Антуан Лоран Лавуазье возвел в систему применение количественных измерений к химическим экспериментам, и полученные им результаты быстро убедили прочих химиков в необходимости взвешивать и измерять все, что только можно взвесить и измерить. Проводя реакции горения и ржавления в замкнутых емкостях, Лавуазье доказал, что если учитывать массу газов, которые производятся в результате горения или поглощаются в результате ржавления, то каких‑либо заметных изменений массы реагентов не происходит!
Таким образом был провозглашен «закон сохранения массы», гласящий, что масса может переходить из одной формы вещества в другую, но не может быть ни создана, ни уничтожена. Иными словами, общее количество массы во Вселенной всегда одинаково.
Законы сохранения массы и энергии формулируются схожим образом, и всю вторую половину XIX века эти два закона считали аналогичными, но независимыми друг от друга обобщениями.
И только Эйнштейн в 1905 году сумел показать, на основе немногих базовых принципов, что массу можно рассматривать как одну из форм энергии. По его теории выходило, что крайне малое количество массы соответствует весьма большому количеству энергии. Этот принцип выражен в знаменитой формуле Эйнштейна е = mс2, где е – это энергия, m – масса, а с – скорость света. Из этой формулы видно, что 1 грамм массы соответствует примерно 21 500 000 000 000 джоулей энергии.
Таким образом, энергия, высвобождаемая при проявлениях радиоактивности, перестала быть загадкой. Стало ясно, что она появляется за счет потерь массы, столь малых, что приборы того времени не могли их зафиксировать. С тех пор появились гораздо более точные приборы, и с их помощью теория Эйнштейна обрела документальное подтверждение.
Высвобождение энергии при взрыве атомных бомб и выработка ее в ядерных реакторах тоже происходит за счет потерь массы. Еще важнее, что таким же образом объясняется и способность Солнца на протяжении множества веков выплескивать в пространство энергию в огромных количествах. Этот вопрос очень интересовал Гельмгольца, и в итоге ученый пришел к предположению, что Солнце постепенно сжимается, таким образом, потенциальная энергия его уменьшается и переходит в тепло и свет. Такая картина не лишена логики, но если бы она соответствовала реальности, то в истории Солнечной системы пришлось бы предположить некоторые факты, которых быть не могло в принципе; астрономы эту теорию принимать отказались.
Когда же выяснилось, что солнечный водород можно превратить в гелий с некоторой потерей массы, а следовательно – с высвобождением большого количества энергии, то феномен солнечного излучения (равно как и феномен излучения звезд вообще) стало возможным объяснить исходя из закона сохранения энергии.
Сейчас уже понятно, что, говоря «энергия», мы включаем в это понятие и массу; чтобы это стало очевидным, зачастую говорят о «законе сохранения массы‑энергии».
Таким образом открытие радиоактивности, сперва пошатнувшее закон сохранения энергии, в конечном итоге еще прочнее утвердило его в более стойком и незыблемом виде.
На самом деле практики интуитивно использовали этот принцип еще задолго до того, как физики сумели убедительно доказать его на экспериментальном материале. Еще в 1775 году Парижская академия наук отказалась рассматривать какие бы то ни было проекты устройств, о которых заявлялось, что они будут производить энергии больше, чем потреблять. Такое устройство, если бы его существование было возможным, могло бы производить работу и вместе с тем продолжать работать за счет энергии, производимой им же самим. Получился бы пресловутый «вечный двигатель». И сейчас Патентное бюро США не будет рассматривать вопрос о патентовании устройств, включающих в себя «вечный двигатель», если только податель заявки не предъявит действующую модель своего изобретения. Надо ли говорить, что такого ни разу до сих пор не произошло?
Закон сохранения энергии подвел черту, провозгласив, что ни одно устройство не может вырабатывать больше энергии, чем тратит, однако не исключил надежды на то, что можно хотя бы получать столько же энергии. Если уж нельзя ничего выиграть у природы, то, может быть, получится хотя бы остаться при своих?
Именно эта надежда стала основной движущей силой всех теоретических исследований начала XIX века, связанных с работой паровой машины. В массовом сознании принято недооценивать значение прогресса в области теории, необходимого для того, чтобы изобретатель мог представить работающий механизм. Сам Уатт опирался в своих разработках паровой машины на работы Блэка, посвященные латентному теплу, о которых говорилось в предыдущей главе. А кто из слышавших об изобретении Уатта знает, что оно стало возможным только благодаря теории Блэка?
Эффективность самых лучших машин Уатта, какими бы полезными и незаменимыми они ни были, не превышает 5 процентов. Это значит, что работы они могут производить только на 5 процентов от получаемой ими тепловой энергии. Поэтому казалось очевидным, что, и не нарушая закона сохранения энергии, можно добиться значительного повышения производительности. Даже учитывая неизбежность каких‑то потерь на трение, теплопроводность и тому подобное, логично было предположить, что эффективность вполне возможно поднять до близкого к 100 процентам показателя.
Так считали до тех пор, пока французский физик Николя Леонар Сади Карно не принялся всерьез изучать движения тепловых потоков, основав таким образом науку термодинамику (что по‑древнегречески и означает «движение тепла»).
В течение всего XIX века значение этой науки все более возрастало, поэтому к тому моменту, как был четко сформулирован закон сохранения энергии, по причине своей фундаментальной важности для всего, что касается перехода энергии в работу и обратно, он получил название «первый закон термодинамики».
Карно основал науку, но времени на то, чтобы внести в нее большой вклад, у него оставалось уже очень мало. Ученый умер в возрасте тридцати шести лет во время эпидемии холеры в Париже. Однако кое‑что он все же успел. В возрасте двадцати восьми лет в 1824 году он опубликовал небольшую книжку под названием «Размышления о движущей силе огня», где привел описания своих опытов и собственные рассуждения о том, до какой степени тепло может быть преобразовано в работу. В этой книге Карно ясно показал, что даже при идеальных условиях (то есть при отсутствии трения и потерь энергии в направлении окружающей среды) лишь строго определенная доля тепловой энергии может преобразовываться в работу. Эта доля определялась разностью температур пара и конденсируемой воды по абсолютной шкале температур, выведенной с помощью закона Шарля. Если первую определить как T1 а вторую – как Т2, то наибольшая доля тепла, которую можно перевести в работу, определяется по формуле:
(T2 – T1)/ T2
Доля преобразуемого тепла, то есть, иными словами, эффективность системы, одинакова, независимо от того, какие именно вещества подвергаются нагреву и охлаждению, будь то вода, ртуть или что угодно; важна только его температура. Поэтому формула Карно справедлива для любой «тепловой машины», а не только для паровой.
Дата добавления: 2016-01-26; просмотров: 715;
