Свойства тетрагалогенидов
| M | Титан | Цирконий | Гафний | ||||
| свойство | Окраска* | Тпл, °C | Ткип, °C | Тпл, °C | Ткип, °C | Тпл, °C | Ткип, °C |
| MF4 | Белый | 427 (давл) | 286 возг | 910 (0,11 МПа) | 906 возг | 1025 (24МПа) | 970 возг |
| MCl4 | Бесцветный | –24 | 437 (1,99 МПа) | 333 возг | 432 (3,38 МПа) | 315 возг | |
| MBr4 | Оранжевый | 450 (1.5 МПа) | 355 возг | 420 (2,5 МПа) | 322 возг | ||
| MI4 | Коричневый | 500 (0,9 МПа) | 418 возг | 449 (0,81 МПа) | 397 возг |
_____
* Все галогениды циркония и гафния бесцветны
Тетрафториды получают действием фтороводорода на соответствующие тетрахлориды
MCl4 + 4HF = MF4 + 4HCl.
Удобный метод синтеза безводных тетрахлоридов и тетрабромидов – галогенирование* смеси оксида с углеродом, необходимым для связывания кислорода
MO2 + 2Cl2 + 2C = MCl4 + 2CO.
Тетрайодиды MI4 получают взаимодействием оксидов c йодидом алюминия
3TiO2 + 4AlI3 = 3TiI4 + 2Al2O3.
Безводные тетрагалогениды, особенно хлориды и бромиды, легко гидролизуются. Например, открытая склянка с хлоридом титана(IV) на воздухе «дымит», так как соединение гидролизуется с выделением хлороводорода, дающего во влажном воздухе устойчивый аэрозоль
TiCl4 + (2+х)H2O = 4HCl + TiO2×хH2О.
Таким образом, с безводными галогенидами необходимо работать в «сухой» камере или в герметичной аппаратуре под давлением инертного газа. Фториды циркония и гафния менее подвержены гидролизу.
Строго говоря, гидролиз тетрагалогенидов при комнатной температуре, как правило, не протекает до конца, а заканчивается на стадии образования оксосолей MOХ2. Это объясняется резким понижением рН раствора вследствие образования галогеноводородной кислоты НХ, которая стабилизирует оксо- или гидроксокатионы. Происходящие при этом процессы родственны описанным в предыдущем параграфе на примере солей кислородсодержащих кислот.
Так, при растворении ZrCl4 в воде, образуется цирконилхлорид ZrOCl2×8H2О, содержащий тетрамерный ион [Zr4(OH)8(H2O)16]8+, устойчивый даже в среде концентрированной HCl. Из раствора, образовавшегося при гидролизе тетрахлорида титана, выделены кристаллы оксосоли [Ti8O12(H2O)24]Cl8, в катионе которой атомы титана связаны между собой двенадцатью оксо-мостиками (рис. 3.10 а) (Reichmann M. G., Hollander F. J., Bell A. A., Acta Cryst. 1987, C43, 1681).
Тетрафториды циркония и гафния слабо подвержены гидролизу и могут быть получены взаимодействием их оксидов с плавиковой кислотой. Из водных растворов они выделяются в виде гидратов MF4×3H2O, которые состоят из цепей, образованных мостиковыми атомами фтора (Hall D., Rickard C. E. F., Waters T. N., Journ. Inorg. Nucl. Chem., 1971, v. 33, p. 2395). При нагревании тригидратов они гидролизуются до оксофторидов MOF2.
Тетрагалогениды Ti, Zr, Hf и особенно хлориды и бромиды за счет свободных p-разрыхляющих орбиталей ведут себя как кислоты Льюиса, растворяясь в водных растворах и расплавах галогенидов щелочных металлов с образованием комплексных соединений, например, 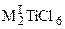 ,
, 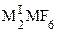 ,
, 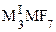 ,
, 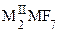 ,
, 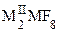 (M = Zr, Hf), где MI = NH4, K, Rb, Cs, MII = Mg, Ca, Ni, Cu и др. Получаемая растворением хлорида таитана(IV) в концентрированной соляной кислоте гексахлоротитановая кислота H2TiCl6, подобно другим комплексным кислотам, относится к сильным кислотам. Она известна только в растворах, по мере разбавления которых гидролизуется.
(M = Zr, Hf), где MI = NH4, K, Rb, Cs, MII = Mg, Ca, Ni, Cu и др. Получаемая растворением хлорида таитана(IV) в концентрированной соляной кислоте гексахлоротитановая кислота H2TiCl6, подобно другим комплексным кислотам, относится к сильным кислотам. Она известна только в растворах, по мере разбавления которых гидролизуется.
В отличие от гексафторотитанатов, гексахлоротитанаты хорошо растворяются в воде и разбавленной HCl. Растворение сопровождается гидролизом, при котором ионы хлора во внутренней сфере комплекса замещаются ионами ОН-. Кристаллизующиеся из растворов соединения 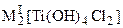 при нагревании до 175-200 оС превращаются в безводные тетрахлорооксотитанаты типа Rb2TiOCl4, Cs2TiOCl4, плавящиеся без разложения. Безводные гексахлоротитанаты, например, K2TiCl6, получены в неводной среде.
при нагревании до 175-200 оС превращаются в безводные тетрахлорооксотитанаты типа Rb2TiOCl4, Cs2TiOCl4, плавящиеся без разложения. Безводные гексахлоротитанаты, например, K2TiCl6, получены в неводной среде.
Фтороцирконаты и фторогафнаты устойчивы при нагревании и слабо подвержены гидролизу. Они хорошо растворяются в воде, причем гексафторогафнаты более (в 1.5 раза) растворимы, чем гексафтороцирконаты. Это используется для разделения Zr и Hf с помощью методов дробной кристаллизации K2HfF6 и K2ZrF6, ионного обмена и экстракции трибутилфосфатом.
Дополнение 3.6. Методы разделения циркония и гафния.Цирконий и гафний имеют практически равные атомные радиусы, что приводит к необычайной близости свойств как простых веществ, так и соединений этих элементов. Гафний способен изоморфно замещать цирконий практически во всех минералах – его содержание в цирконе в среднем достигает 1%, что соотвествует отношению кларков этих элементов (циркония в земной коре содержится примерно в 100 раз больше, чем гафния). В то же время, ядерные свойства этих двух элементов сильно различаются. Ядра циркония, в отличие от ядер гафния, имеют малое сечение захвата нейтронов, поэтому для изготовления оболочек («футляров») тепловыделяющих элементов (ТВЭЛ’ов) в ядерных энергетических установках требуется металл, свободный от примеси гафния. Разделение циркония и гафния представляет собой сложную химическую задачу. Ее решение основано на различии в свойствах их некоторых соединений, которое тем значительнее, чем сложнее состав вещества. Исторически первым методом, позволившим разделить цирконий и гафний, являлась дробная кристаллизация – многократная перекристаллизация солей обоих элементов. Если растворимости простых солей циркония и гафния, например, сульфатов, необычайно близки, то растворимости некоторых комплексных соединений заметно различаются. Примером могут служить гексафторометаллаты K2[ЭF6]: в 1л насыщенного раствора при 20°C содержится 36,5 г K2ZrF6 и 72,0 г K2HfF6. Во избежание гидролиза перекристаллизацию проводят в 78%-ной плавиковой кислоте. Различной растворимостью обладают также и другие комплексные соли, например, K2[Э(SO4)3], цитраты, оксалаты.
Важнейшим методом разделения в настоящее время служит экстракция – извлечение соединений из одной жидкой фазы в другую. Комплексы циркония обладают большей устойчивостью, чем комплексы гафния, поэтому его ионы легче экстрагируются из сильнокислых растворов различными лигандами, например, метилизобутилкетоном (МИБК) или трибутилфосфатом (ТБФ):
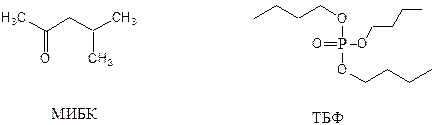
Цирконий при этом переходит в органический слой в виде комплекса Zr(NO3)4×2ТБФ:
[Zr(OH)2]2+aq + 2H+aq + 4NO3–aq + 2ТБФ = Zr(NO3)4×2ТБФ + 2H2O,
а гафний остается в водном растворе. В промышленности процесс проводят в 5М HNO3: при меньшей концентрации кислоты в растворе присутствуют полиядерные гидроксо- или оксокомплексы, которые практически не экстрагируются. При увеличении концентрации кислоты выше 8 моль/л начинаетется экстракция молекул HNO3:
H+aq + NO3–aq + ТБФ = HNO3×ТБФ,
которая конкурирует с экстракцией ионов металла. Экстракционный способ разделения самый эффективный и позволяет получать соединения циркония с содержанием гафния менее 0,002%.
Метод ионного обмена, который в настоящее время практически не используется, также основан на различной устойчивости комплексных соединений циркония и гафния. В кислых (6 М НСl) растворах на катионобменной смоле лучше сорбируется гафний, а при последующей ее обработке лимонной кислотой первым вымывается (элюируется) цирконий, поскольку он образует более устойчивые комплексы.
При хлорном способе переработки циркона разделение тетрахлоридов циркония и гафния было бы удобно проводить методом ректификации (фракционной дистилляции). Для этого предложено использовать узкий температурный интервал, в котором при повышенном давлении оба вещества превращаются в жидкости с различной летучестью. Данный метод апробирован на лабораторных установках, но пока не нашел промышленного применения.
КОНЕЦ
Устойчивость и температуры плавления однотипных комплексных соединений увеличиваются с ростом радиуса внешнесферного иона щелочного металла и уменьшением размера галогена (табл. 3.6). Все гексахлорогафнаты несколько прочнее соответствующих соединений циркония: они имеют более высокие энтальпии образования, температуры плавления, кипения (табл. 3.6), менее подвержены гидролизу. В отличие от гексафторо- и гексахлорометаллатов, гексабромометаллаты и гексайодометаллаты неустойчивы.
Таблица 3.6. Температуры плавления (Тпл, оС), энтальпии образования (DfНо(298) гексахлороцирконатов и гексахлоронафнатов.
| Соединение | Тпл, оС | -Df 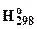 ,
кДж/моль ,
кДж/моль
| Соединение | Тпл, оС | -Df 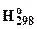 ,
кДж/моль ,
кДж/моль
|
| Li2ZrCl6 | - | Li2HfCl6 | - | ||
| Na2ZrCl6 | Na2HfCl6 | ||||
| K2ZrCl6 | K2HfCl6 | ||||
| Cs2ZrCl6 | - | Cs2HfCl6 | - |
При взаимодействии TiCl4 со спиртами ROH в присутствии аммиака или щелочей образуются алкоксиды, или алкоголяты Ti(OR)4
TiCl4,ж., пар + 4ROHж. + 4NH3, газ = Ti(OR)4,ж. + 4NH4Cl.
Алкоголяты титана, циркония и гафния – жидкие или твердые легко сублимирующиеся вещества, растворимые в органических растворителях, используются для получения оксидных сегнето- и пьезоэлектриков, ВТСП и других материалов в виде объемной керамики и тонких пленок. Многие из них представляют собой тетрамеры, например, [Ti(OEt)4]4, в котором атомы титана связаны друг с другом мостиковыми этокси-группами. При получении оксидной керамики «алкоголятным методом» к спиртовым растворам алкоголятов добавляется вода и проводится гидролиз, в результате которого образуются смешанные гидроксид-оксиды. Это снижает температуру термической обработки и ускоряет образование сложных оксидов с высокой химической и фазовой однородностью.
Безводные тетрагалогениды металлов четвертой группы используют как исходные вещества при получении и очистке металлов (йодидное рафинирование), синтезе белил и керамик на основе TiО2 и ZrO2, алкоголятов, а также в качестве катализаторов Циглера-Натта в процессах полимеризации, гидрирования, окисления.
Дополнение 3.7. TiCl4 как катализатор полимеризации олефинов.Немецкий химик К. Циглер и независимо от него итальянский химик Дж. Натта предложили использовать TiCl4 как катализатор для полиметризации олефинов, например, этилена (СН2=СН2) и пропилена (СН3СН=СН2). Процесс не требует высоких давлений и температур и происходит в органических растворителях при комнатной температуре. Открытия вызвали настоящий прорыв в производстве полимерных упаковочных и конструкционных материалов, а К. Циглеру и Дж. Натта в 1963 г. присуждена Нобелевская премия за открытия в технологии полимеров.
Возможная схема механизма реакции полимеризации этилена на продуктах реакции TiCl4 и триэтилалюминия AlR3, R - С2Н5, представлена на рис. 3.18. Реакция происходит на дефектах поверхности твердого кристаллического TiCl3 – вакансиях атомов титана VTi и ионах Ti3+, показанных на схеме кружочками. Для образования вакансий и ионов Ti3+ исходный TiCl4 предварительно частично восстанавливают. Реакция начинается с замещения атома Cl на алкильную группу (стадия 1) и присоединения этилена к координационно ненасыщенному атому титана (стадия 2). Координация алкена атомом титана поляризует связь С–С и вызывает миграцию алкильной группы с ее неподеленной электронной парой к этилену (стадия 3, цис-присоединение), и при этом возникает еще одна вакансия VTi. Реакция полимеризации продолжается (стадия 4), и таким образом происходит рост цепи. Освобождение полимерной цепочки от металла происходит путем элиминирования водорода от соседней группы –СН2– (b-элиминирование), при этом цепь обрывается. Стереоспецифичность процесса объясняется наличием стерических ограничений на способ ориентации молекул алкена в координационной сфере по отношению к растущей цепи. Стереорегулярность полимера обуслoвливает его высокие температуру плавления и механические свойства. В процессе полимеризации часть катализатора теряется, оставаясь связанной с молекулами полимера, однако потери эти невелики, например, на получение одной тонны полипропилена затрачивается 5 г катализатора.
КОНЕЦ ДОПОЛНЕНИЯ
Низшие галогениды
Общим методом синтеза тригалогенидов служит высокотемпературное восстановление высших галогенидов металлами или водородом:
2TiCl4 + H2 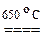 2TiCl3 + 2HCl.
2TiCl3 + 2HCl.
Гидратированный хлорид титана может быть получен при действии цинка на солянокислый раствор хлорида титана(IV), содержащий гесахлоротитановую кислоту
2H2TiCl6 + Zn = 2TiCl3 + ZnCl2 + 4HCl.
Дата добавления: 2016-01-03; просмотров: 1736;
