Водородные соединения азота
С водородом азот образует два соединения: аммиак NH3 и гидразин N2H4(H2N – NH2). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH4Cl + NaOH = NaCl + NH3 + H2O
Основным промышленным способом получения аммиака является синтез его из азота и водорода
N2 + 3H2 ↔ 2NH3 ∆ Н0 = - 82,4
( Катализатор Pt; t = 450 - 5000С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3 поляризована – общие электронные пары сдвинуты к азоту. Кроме того, у атома азота остается неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования водородных связей.
Расположение связей в аммиаке тетраэдрическое, причем неподеленная пара электронов атома азота занимают одну из вершин тетраэдра.
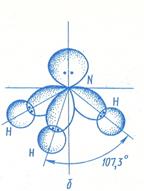
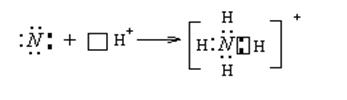
Аммиак – очень реакционно-способное вещество. Для него характерны реакции окисления и присоединения (благодаря неподеленной паре электронов). Наличие неподеленной пары определяет основные свойства аммиака, который может присоединять протон, образуя ион аммония NH4+.
NH3 очень хорошо растворим в воде, но максимальная концентрация ω(NH3)= 25%. В растворе имеют место равновесия:
NH3 + H2O ↔ NH3 • H2O NH3 • H2O ↔ NH4OH
NH4OH ↔ NH4+ + OH– KдNH4OH = 1,8 • 10- 5
Основная масса NH3 в растворе находится в виде гидрата аммиака NH3 · H2O. Поэтому, хотя NH4OH диссоциирует почти нацело, его условно считают слабым основанием. Поскольку азот в NH3 имеет низкую степень окисления –3, аммиак является восстановителем в ряде реакций.
В кислороде аммиак горит без катализатора:
4NH3 + 3O2 = 2N2 + 6 H2O,
а в присутствии катализатора платины
4NH3 + 5O2 = 4NO + 6H2O
При нейтрализации раствора аммиака кислотами образуются растворы солей аммония, содержащие ион NH4+.
NH3 + HCl = NH4Cl
NH3 + H2SO4 = (NH4)2SO4
В этих реакциях ион аммония подобен ионам одновалентных металлов.
При замещении в молекуле аммиака 3-х атомов водорода получаются нитриды, содержащую группу N-3 , 2-х атомов водорода – имиды NН-2 , одного атома водорода - амиды NН2- .
2 NH3 + 6Na = 2Na3N +3H2 нитрид натрия
NH3 +2Na = Na2HN + H2 имид натрия
2 NH3 +2Na = 2NaH2N + 3H2 амид натрия
NH3 всегда - восстановитель, окисляется до N2 или NO.
t
CuO + NH3 → Cu +N2 +H2O
На этом свойстве основано применение NH3 и его солей в процессе пайки металлов – снятие оксидной пленки с поверхности.
CuO + NH4Cl = Cu +N2 +HCl + H2O
CuO + NH4Cl = Cu + CuCl2 +H2O
Дата добавления: 2016-01-30; просмотров: 19575;
