Химия германия, олова, свинца (Ge, Sn, Pb)
GeO, SnO – сильные восстановители. Все оксиды и гидроксиды (II) амфотерны, реагируют как с кислотами, так и основаниями.
Диоксиды Ge, Sn получают синтезом из простых веществ. Диоксид свинца в 2 стадии получают. У свинца 2 простых оксида PbO и PbO2. Рb2О3 – смешанный оксид или РbРbО3 – метаплюмбат свинца (II). Рb3О4 (2 PbO • PbO2 - сурик).
Диоксиды не образуют с водой кислот. Со щелочами дают гидроксокомплексы
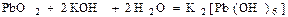 (гексагидроксоплюмбат (IV)).
(гексагидроксоплюмбат (IV)).
PbO2 – сильный окислитель.
Pb + О2 ® Pb3О4 – – красный краситель, свинцовый сурик можно рассматривать как соль Pb22+(PbO4) (ортоплюмбат свинца II).
Pb3O4 + HNO3 ® PbO2 + Pb(NO3)2 + H2O.
Sn + HCIконц 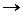 Sn+2CI2 + H2
Sn+2CI2 + H2
Sn + H2SOконц 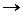 Sn+4(SO4)2 + SO2
Sn+4(SO4)2 + SO2 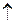 + H2O
+ H2O
Sn + HNO3разб 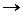 Sn (NO3)2 + NH4NO3 + H2O
Sn (NO3)2 + NH4NO3 + H2O
Sn + HNO3конц 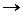 H2Sn+2O3 + NO2 + H2O
H2Sn+2O3 + NO2 + H2O
β -оловянная
t
Sn + NaOH конц 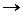 Na2Sn+2O2 + H2O
Na2Sn+2O2 + H2O
станнит (соль оловяннистой кислоты H2SnO2)
В водных растворах станниты дают гидроксостанниты.
Na2Sn+2O2 + 2H2O 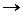 Na2[Sn+2(OH)4]; Na2[Sn+2(OH)3]
Na2[Sn+2(OH)4]; Na2[Sn+2(OH)3]
Sn(OH)2 ++ HCI 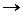 SnCI2 + H2O
SnCI2 + H2O
амфонит
Sn(OH)2 + 2NaOH 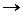 Na2[Sn(OH)4]
Na2[Sn(OH)4]
тетрагидроксостаннит
SnO2 кислотные свойства
Sn(OH)4 амфотерный, с преобладанием кислотных, H2SnO3 – оловянная кислота (α и β), растворяется в кислотах и щелочах.
H2SnO3 + 2NaOH + H2O 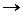 Na2[Sn(OH)6]
Na2[Sn(OH)6]
H2SnO3 + 4HCI 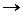 SnCI4 + 3H2O
SnCI4 + 3H2O
SnCI4 + 3H2O 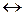 H2SnO3 + 4HCI
H2SnO3 + 4HCI 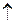 дымообразователь, дымит во влажном воздухе.
дымообразователь, дымит во влажном воздухе. 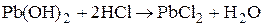
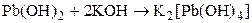
Ge(OH)2 ® Sn(OH)2 ® Pb(OH)2
усиление основных свойств
Ge(OH)4 ® Sn(OH)4 ® Pb(OH)4
усиление основных свойств
2PbCO3×Pb(OH)2 – белая краска – свинцовые белила.
Pb(CH3COO)4 – тетраэтилсвинец – летучая ядовитая жидкость, добавляется к бензину для повышения его качеств как моторного топлива.
Биогенная роль
Дата добавления: 2016-01-30; просмотров: 2439;
