Общая характеристика группы
В IV-A группе находятся р - элементы C, Si, Ge, Sn, Pb. Конфигурация атома в невозбужденном состоянии ns2 nр2, в возбужденном состоянии ns1nр3, все 4 электрона неспаренные.
| 2s | 2p | |||||
| С 2s22p2 | ¯ | | | (+2) | ||
| С* 2s12p3 | | | | | ( -4, +4) |
Радиусы атомов закономерно растут с увеличением порядкового номера, ионизационный потенциал соответственно уменьшается.
В большинстве неорганических соединений углерод и кремний проявляют степень окисления +4. Но от германия к свинцу прочность соединений со степенью окисления +4 уменьшается, более стабильна низкая степень окисления +2. Могут проявлять степени окисления - 4 в гидридах.
Углерод стоит в середине 2-го периода, он одинаково может притягивать и отдавать электроны, промежуточное значение электроотрицательности приводит к тому, что углерод образует ковалентные связи со всеми реакционноспособными элементами периодической системы, стоящими от него слева (в том числе Н), справа (О, N, галогены) и снизу (Si,Ge, Sn, Pb).
Li Be B C N O F
ОЭО 1 1,5 2 2,5 3 3,5 4
Невозможность донорно - акцепторного взаимодействия в возбужденном состоянии обусловливает примерно одинаковую прочность одинарных связей с водородом. Четырехвалентность углерода предоставляет широкие возможности для разветвлений цепей углеродных атомов и образования циклических структур.
C - типичный неметалл
Si - типичный неметалл
Ge- есть металлические свойства
Sn- металлические свойства преобладают над неметаллическими
Pb - металлические свойства преобладают над неметаллическими
|

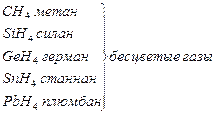
|
|

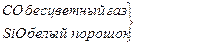
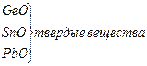
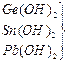
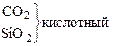

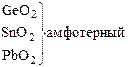
|
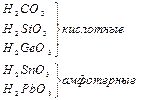
Кремний по распространенности в земной коре занимает второе место (после кислорода). Если углерод – основа жизни, то кремний – основа земной коры. Он встречается в громадном многообразии силикатов и алюмосиликатов, песка. Германий, олово, свинец достаточно редкие элементы. Аморфный уголь (сажа) черного цвета, аморфный кремний – порошок бурого цвета. Кристаллический кремний – полупроводник. Важные сорта аморфного угля – кокс, древесный уголь. Германий как и кремний, полупроводник, имеет алмазоподобную решетку, по внешнему виду типичный металл серебристо-белого цвета. Олово имеет модификации белое (b-модификация устойчива выше 286 К серебристо-белый металл, серая - a-модификация (серое олово) имеет алмазоподобную решетку. Свинец – темно-серый металл.
Химия углерода
Углерод встречается в природе в свободном виде и в соединениях. Его аллотропные видоизменения – алмаз, графит, карбин, фуллерен.
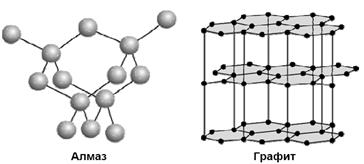
Алмаз – самое твердое вещество в природе. Твердость по шкале Маоса -10, тем не менее он хрупок. Ограненный алмаз имеет более 20 граней и называется бриллиантом, используется в ювелирной промышленности. Масса бриллианта измеряется в каратах (1 карат = 0,2 г). Существенные различия в свойствах алмаза и графита обусловлены особенностями строения их кристаллов.
1. Кристаллическая решетка алмаза атомная. Каждый атом углерода расположен в центре тетраэдра, четыре вершины которого заняты другими атомами углерода. Все атомы находятся на одинаковых расстояниях друг от друга. Кристалл алмаза (диэлектрик) – имеет плотную упаковку с высокой компактностью и твердостью. Атомы углерода в sp3-гибридизации.
2. В кристаллах графита атомы углерода расположены в углах правильных шестиугольников, находящихся в параллельных плоскостях. Под внешним воздействием такой кристалл легко расслаивается на чешуйки. Графит в отличие от алмаза очень мягок.
Атомы углерода в графите в sp2-гибридизации.
3. Карбин– твердое кристаллическое вещество.
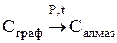
Это линейный полимер углерода, в котором чередуются одинарные и тройные связи.
Атомы углерода в карбине в sp-гибридизации.
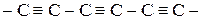 a- карбин (полиин)
a- карбин (полиин)
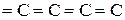 = b- карбин (поликумулен)
= b- карбин (поликумулен)
Карбин – наиболее стабильная форма углерода, a- карбин обладает полупроводниковыми свойствами.
4. Фуллерен– четвертая аллотропная модификация углерода. Его молекулы имеют четное число атомов углерода и имеют состав С60, С70, С80 и т.д. Молекула С60 имеет вид футбольного мяча, построенного из пяти- и шестигранных углеродных циклов с общими ребрами.
Водородные соединения углерода – углеводороды являются объектом изучения в органической химии.
К неорганическим соединениям углерода относятся СО и СО2.
С + О2 ® СО2
С + О2 ® СО
С + Н2 ® СН4
С + S2 ® CS2 (сероуглерод)
С + F2 ® СF4
Из галогенидов СГаl самое большое значение имеет СCl4 – бесцветная, достаточно токсичная жидкость. В обычных условиях СCl4 химически инертен. Применяют как невоспламеняющийся и негорючий растворитель смол, лаков, жиров и для получения фреона CF2Cl2.
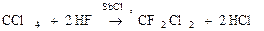
CF4 – газ; CCl4 – жидкий ; CBr4 – твердый.
С + H2SO4 конц ® СО2 + SO2 + H2O
С + HNO3 конц ® СО2 + NO2 + H2O
Химическая связь в молекуле СО.
Распределение электронов в возбужденном атоме углерода и в кислороде таково, что между ними возможно образование двух химических связей – в атоме кислорода имеются 2 неспаренных электрона. Однако при переходе одного электрона от кислорода к углероду в образовавшихся ионах С- и О+ будет по 3 неспаренных электрона, аналогично электронной конфигурации азота. При соединении этих ионов образуется тройная связь, аналогичная молекуле N2, поэтому свойства СО и N2 очень близки.
СО
| С- | ¯ | ¯ | ¯ | ¯ | ||
| О+ | ¯ | | | |
С 2s22p2 С +1е = С-
О 2s22p4 О -1е = О+
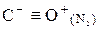
Возможно иное объяснение образования тройной связи в молекуле СО.
| С 2s22p2 | ¯ | ¯ | ¯ | |||
| О 2s22p4 | ¯ | ¯ | | |
Невозбужденный атом углерода имеет 2 неспаренных электрона, которые могут образовать 2 общие электронные пары с 2-мя неспаренными электронами атома кислорода (по обменному механизму). Однако имеющиеся в атоме кислорода 2 спаренные р -электрона могут образовывать тройную химическую связь, поскольку в атоме углерода имеется одна незаполненная ячейка, которая может принять эту пару электронов.
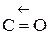 Тройная связь образуется по донорно-акцепторному механизму, направление стрелки от донора кислорода к акцептору – углероду.
Тройная связь образуется по донорно-акцепторному механизму, направление стрелки от донора кислорода к акцептору – углероду.
Подобно N2 - СО обладает высокой энергией диссоциации (1069 кДж), плохо растворим в воде, инертен в химическом отношении. СО – газ без цвета и запаха, безразличный несолеобразующий, не взаимодействует с кислотными щелочами и водой при обычных условиях. Ядовит, т.к. взаимодействует с железом, входящим в состав гемоглобина. При повышении температуры или облучении проявляет свойства восстановителя.
Получение:
в промышленности
в лаборатории:
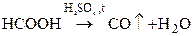 ;
;
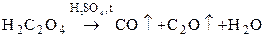 .
.
В реакции СО вступает лишь при высоких температурах.
Молекула СО имеет большое сродство к кислороду, горит образуя СО2:
СО + 1/2О2 = СО2 + 282 кДж/моль.
Из-за большого сродства к кислороду СО используется как восстановитель оксидов многих тяжелых металлов (Fe, Co, Pb и др.).
СO + Cl2 = COCl2 (фосген)
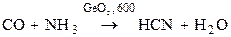
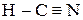
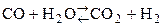
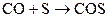
Наибольший интерес представляют карбонилы металлов (используются для получения чистых металлов). Химическая связь по донорно-акцепторному механизму, имеет место p-перекрывание по дативному механихму.
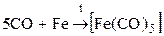 (пентакарбонил железа)
(пентакарбонил железа)
Все карбонилы – диамагнитные вещества, характеризуются невысокой прочностью, при нагревании карбонилы разлагаются
[Ni(CO)4] → 4CO + Ni (карбонил никеля).
Как и СО карбонилы металлов – токсичны.
Химическая связь в молекуле СО2
В молекуле СО2 sp-гибридизация атома углерода. Две sp-гибридные орбитали образуют 2 s-связи с атомами кислорода, а оставшиеся негибридизованными р-орбитали углерода дают с двумя р-орбиталями атомов кислорода p-связи, которые располагаются в плоскостях перпендикулярных друг другу.
О ═ С ═ О
Под давлением 60 атм. и комнатной температуре СО2 сгущается в бесцветную жидкость. При сильном охлаждении жидкая СО2 застывает в белую снегоподобную массу, возгоняющуюся при Р = 1 атм и t = 195К(-78°). Спрессованная твердая масса называется сухим льдом, СО2 не поддерживает горения. В нем горят лишь вещества, у которых сродство к кислороду выше чем у углерода: например,
2Mg + CO2 ® 2MgO + C.
СО2 реагирует с NH3:
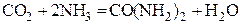
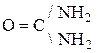
(карбамид мочевина)
2СО2 + 2Na2O2 ® 2Na2CO3+O2
Мочевина разлагается водой:
CO(NH2)2 + 2H2O ® (NH4)2CO3 → 2NH3 + СО2
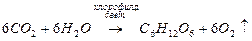 фотосинтез
фотосинтез
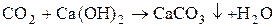
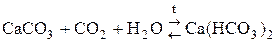 .
.
СО2 получают в технике:
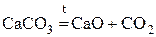
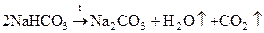
из кокса 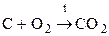
В лаборатории (в аппарате Киппа):
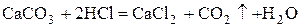 .
. 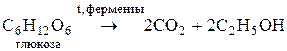
Дата добавления: 2016-01-30; просмотров: 1779;
