Угольная кислота и ее соли
Растворяясь в воде, углекислый газ частично взаимодействует с ней, образуя угольную кислоту H2CO3; при этом устанавливаются равновесия:
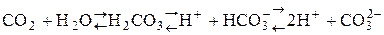
К1 = 4×10-7 К2 = 4,8×10-11 – слабая, неустойчивая, кислородсодержащая, двухосновная кислота. Гидрокарбонаты растворимы в Н2О. Карбонаты нерастворимы в воде, кроме карбонатов щелочных металлов, Li2CO3 и (NH4)2CO3. Кислые соли угольной кислоты получают, пропуская избыток СО2 в водный раствор карбоната:
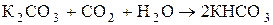 ,
,
либо постепенным (по каплям) добавлением сильной кислоты в избыток водного раствора карбоната:
Na2CO3 + HNO3 ® NaHCO3 + NaNO3
При взаимодействии со щелочами или нагревании (прокаливании) кислые соли переходят в средние:
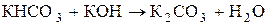
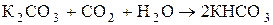
Соли гидролизуются по уравнению:
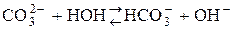 I ступень
I ступень
Из-за полного гидролиза из водных растворов нельзя выделить карбонаты Gr3+, Al3+, Ti4+, Zr4+ и др.
Практическое значение имеют соли - Na2CO3 (сода), CaCO3 (мел, мрамор, известняк), K2CO3 (поташ), NaHCO3 (питьевая сода), Са(НСО3)2 и Mg(HCO3)2 обусловливают карбонатную жесткость воды.
Сероуглерод (CS2)
При нагревании (750-1000°С) углерод реагирует с серой, образуясероуглерод, органический растворитель (бесцветная летучая жидкость, реакционноспособное вещество), огнеопасен и летуч.
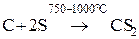
Пары CS2 – ядовиты, применяется для фумигации (окуривания) зернохранилищ против насекомых - вредителей, в ветеринарии служит для лечения аскаридоза лошадей. В технике – растворитель смол, жиров, йода.
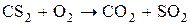
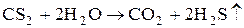
С сульфидами металлов CS2 образует соли тиоугольной кислоты – тиокарбонаты.
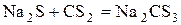 .
.
Эта реакция аналогична процессу
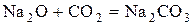 .
.
Тиокарбонаты – желтые кристаллические вещества. При действии на них кислот выделяется свободная тиоугольная кислота.
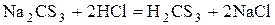
Она более стабильна чем Н2СО3 и при низкой температуре выделяется из раствора в виде желтой маслянистой жидкости, легко разлагающейся на:
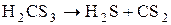
Соединения углерода с азотом (СN)2 или С2N2 – дициан, легко воспламеняющийся бесцветный газ. Чистый сухой дициан получают путем нагревания сулемы с цианидом ртути (II).
HgCl2 + Hg(CN)2 ® Hg2Cl2 + (С N)2
Другие способы получения:
4HCNг + О2 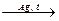 2(CN)2 +2H2O
2(CN)2 +2H2O
2HCNг + Сl2 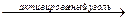 (CN)2 + 2HCl
(CN)2 + 2HCl
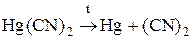
Дициан по свойствам похож на галогены в молекулярной форме X2. Так в щелочной среде он, подобно галогенам, диспропорционирует:
(С N)2 + 2NaOH = NaCN + NaOCN
Циановодород - НСN ( 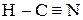 ), ковалентное соединение, газ, растворяющийся в воде с образованием синильной кислоты (бесцветная жидкость и ее соли чрезвычайно ядовиты). Получают:
), ковалентное соединение, газ, растворяющийся в воде с образованием синильной кислоты (бесцветная жидкость и ее соли чрезвычайно ядовиты). Получают:
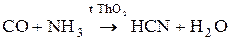
Циановодород получают в промышленности по каталитическим реакциям.
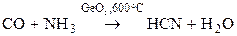
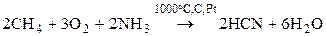 .
.
Соли синильной кислоты – цианиды, подвержены сильному гидролизу. CN- - ион изоэлектронный молекуле СО, входит как лиганд в большое число комплексов d-элементов.
Обращение с цианидами требует строгого соблюдения мер предосторожности. В сельском хозяйстве применяют для борьбы с особо опасными насекомыми – вредителями.
Цианиды получают:
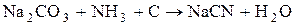 .
.
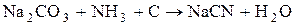 .
.
Соединения углерода с отрицательной степенью окисления:
1) ковалентные (SiC карборунд) 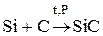 ;
;
2) ионноковалентные;
3) металлические карбиды.
Ионноковалентные разлагаются водой с выделением газа, в зависимости от того какой выделяется газ, их делят на:
метаниды (выделяется СН4)
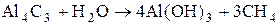
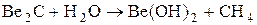
ацетилениды(выделяется С2Н2)
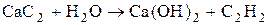
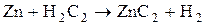
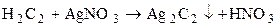
Металлические карбиды – соединения стехиометрического состава образованные элементами 4, 7,8 групп посредством внедрения атомов Ме в кристаллическую решетку углерода.
Химия кремния
Отличие химии кремния от углерода обусловлено большими размерами его атома и возможностью использования 3d-орбиталей. Из-за этого связи Si – O - Si, Si - F более прочны, чем у углерода.
Для кремния известны оксиды состава SiO и SiO2.Монооксид кремния существует только в газовой фазе при высоких температурах в инертной атмосфере; он легко окисляется кислородом с образованием более стабильного оксида SiO2.
2SiO + О2 t® 2SiO2
SiO2 – кремнезем, имеет несколько кристаллических модификаций. Низкотемпературная – кварц, обладает пьезоэлектрическими свойствами. Природные разновидности кварца: горный хрусталь, топаз, аметист. Разновидности кремнезема – халцедон, опал, агат, песок.
Известно большое разнообразие силикатов (точнее оксосиликатов). В строении их общая закономерность: все состоят из тетраэдров SiO44- которые через атом кислорода соединены друг с другом.
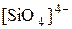
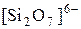
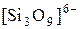
Сочетания тетраэдров могут соединяться в цепочки, ленты, сетки и каркасы.
Важные природные силикаты 3MgO×H2O×4SiO2 тальк, 3MgO×2H2O×2SiO2 асбест.
Как и для SiO2 для силикатов характерно (аморфное) стеклообразное состояние. При управляемой кристаллизации можно получить мелкокристаллическое состояние – ситаллы – материалы повышенной прочности. В природе распространены алюмосиликаты – каркасные ортосиликаты, часть атомов Si заменены на Al, например Na12[(Si,Al)O4]12.
Наиболее прочный галогенид SiF4 разлагается только под действием электрического разряда.
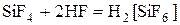 гексафторокремниевая кислота (по силе близка к H2SO4).
гексафторокремниевая кислота (по силе близка к H2SO4).
(SiS2)n – полимерное вещество, разлагается водой:
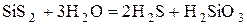
Дата добавления: 2016-01-30; просмотров: 2106;
