Общая характеристика элементов V-А группы
Главная подгруппа V группы периодической системы Д.И. Менделеева включает пять элементов: типичные p-элементы азот N, фосфор P, а также сходные с ними элементы больших периодов мышьяк As, сурьму Sb, и висмут Bi. Они имеют общее название пниктогены. Атомы этих элементов имеют на внешнем уровне по 5 электронов (конфигурация пs2 пp3).
В соединениях элементы проявляют степень окисления от -3 до 5. Наиболее характерны степени +3 и +5. Для висмута более характерна степень окисления +3.
При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi.
Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств.
Закономерно нарастает от N к Bi ионный радиус, но он много меньше атомного. Это связано с тем, что внешние электроны находятся на значительном расстоянии от ядра по сравнению с предвнешними, и когда атом теряет внешние электроны, переходит в ион, радиус иона соответственно ниже радиуса атома. Плотность закономерно нарастает.
Незакономерность изменения свойств (Tпл и Ткип) обусловлена особенностью строения кристаллической решетки. Если азот – это газ, то последний элемент группы находится в твердом агрегатном состоянии.
В кристаллической решетке молекулы белого фосфора связаны межмолекулярными силами (силы Ван дер Ваальса), а так как они очень слабы, то белый фосфор легко распадается на молекулы под влиянием различных воздействий (температуры, растворителя). По этой причине он легко плавится при 44°С в бесцветную жидкость, при 275°С кипит.
Для элементов, не проявляющих металлических свойств стандартные электронные потенциалы отсутствуют.
Электронное строение внешних энергетических уровней атомов азота и фосфора следующие:
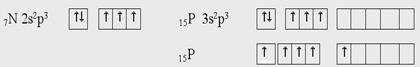
У атома азота три неспаренных электрона. Поэтому валентность азота равна трем. Из-за отсутствия у него d-подуровня на внешнем уровне его электроны разъединиться не могут. Однако в результате донорно-акцепторного взаимодействия азот становится четырехвалентным.
У атомов фосфора и последующих элементов VА группы имеются свободные орбитали на d-подуровне и переходя в возбужденное состояние будут разъединятся 3s-электроны. В невозбужденном состоянии у всех элементов 5А группы валентность равна 3, а в возбужденном состоянии всех, кроме азота, равна пяти.
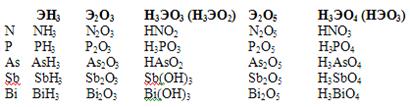
Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3 , в которых степень их окисления -3.
NH3 аммиак
PH3 фосфин
AsH3 арсин
SbH3 стибин
BiH3 висмутин
AsH3, SbH3 газы с неприятным запахом, легко разлагаются. Чрезвычайно ядовиты.
В кислородных соединениях для элементов VА группы наиболее характерны степени окисления +3 и +5. Для висмута более характерна степень окисления +3.
Все элементы VА группы имеют оксиды типа Э2О5 и гидроксиды НЭО3 или Н3ЭО4 , которые обладают кислотными свойствами. Кроме того для них характерны оксиды типа Э2О3 и соответствующие гидроксиды НЭО2 или Н3ЭО3 , у азота и фосфора они имеют кислотные свойства, у мышьяка и сурьмы – амфотерные, а у висмута проявляют основной характер.
Характерно также образование галидов типа ЭГ3 (тригалиды), которые (за исключением NF3) гидролизуются по схеме:
ЭГ3 + 3Н2О = Н3ЭО3 + 3НГ
ЭCl3 + H2O = H3ЭО3 + 3НCl
но в присутствии галоводородной кислоты галиды сурьмы и висмута гидролизуются с образованием галоксидов, например
SbCl3 + H2O = SbOCl + 2HCl
Группу SbO+ называют антимонилом, а соединение SbOCl – хлоридом антимонила. Для фосфора, мышьяка и сурьмы известны пентафториды ЭF5 , а для фосфора и сурьмы пентахлориды ЭCl5.
Мышьяк и сурьма имеют ряд аллотропных форм. Наиболее устойчивые металлические формы серого (As) и серебристо-белого (Sb) цвета. Это хрупкие вещества, легко превращаемые в порошок. Висмут – металл серебристо-белого цвета с едва заметным розовым оттенком.
Соединения As, Sb, Bi ядовиты. Особо опасны соединения As3+ ( AsH3- арсин).
Химия азота
Азот (лат. nitrogenium) в свободном состоянии газ без цвета и запаха. Азот – основной компонент атмосферы Земли (78,09% по объему или 75,6% по массе, всего около 4·1015 т). Мы живем в азотной атмосфере, умеренно обогащенной кислородом и в малых количествах другими химическими элементами.
В космосе он занимает 4-е место вслед за водородом, гелием и кислородом. В живых организмах его до 0,3% в виде соединений. Растения, получая азот из почвы в виде минеральных солей, используют его для синтеза белков, витаминов и других жизненно важных веществ.
Азот относится к органогенам, наряду с углеродом, водородом и кислородом – элементы, которые чаще всего содержатся в органических веществах. Все важнейшие части клеток (протоплазма и ядро) построены из белковых веществ. Без белка нет жизни, а без азота нет белка.
Свободный азот несколько легче воздуха. Он плохо растворим в воде. Прочность молекулы азота велика. Даже при 3300°С только одна из тысяч молекул N2 распадается на атомы. Поэтому свободный азот в обычных условиях инертен к подавляющему большинству веществ. Для того чтобы азот вступил в химическую реакцию, требуется предварительная активация его молекул путем нагревания, облучения, действие катализатора или другими способами.
Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид:
6Li + N2 = 2Li3N
С Na, Ca, Mg реакция идет только при нагревании. С кислородом азот взаимодействует только в электрической дуге (или при грозовом разряде в атмосфере):
N2 + O2 = 2NO
С водородом реакция идет при нагревании (t ≈ 450-5000С), под давлением и в присутствии катализатора
N2 + 3H2 = 2NH3
Пропуская азот через раскаленный кокс можно получить (дициан) – соединение азота с углеродом N ≡ C — C ≡ N. С другими неметаллами кроме бора свободный азот не реагирует.
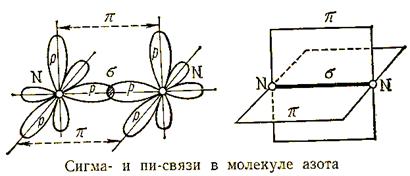
Причина инертности молекулярного азота – крайне прочная ковалентная неполярная связь. Два атома в молекуле удерживаются одной σ - связью и двумя π- связями. Т.е. связи в молекуле азота неравноценны. На разрушение молекулы азота на атомы затрачивается довольно большое количество энергии:
N2 = 2N ∆H0 = 946 кДж/моль
Строение молекулы N2
Получение N2
В промышленности – сжижением воздуха с выделением фракций азота.
В лаборатории разложением нитрита аммония или азида натрия
NH4NO2 = N2 + 2 H2O
2 NaN3 = 3 N2 + 2 Na
или 2NH3 + 3Br = N2 + 6 HBr
Дата добавления: 2016-01-30; просмотров: 31824;
