Гидразин и гидроксиламин
Строение молекулы и характерные реакции: присоединения, окислительно-восстановительные. Соли гидразиния и гидроксиламмония.
Молекула гидразинаN2H4 достаточно устойчива, несмотря на эндотермичность ∆Н0 = 50,2 кДж/моль. Гидразин – жидкость.
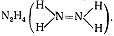
При растворении в воде образует гидраты N2H4 · H2O и N2H4 · 2H2O
Соли гидразония – N2H4 · HCl (N2H5Cl) ; N2H4 · H2SO4 (N2H6SO4)
При взаимодействии с О2 выделяется большое количество тепла
N2H4 + O2 = N2 + 2H2O ∆H0 = – 621,5 кДж/моль
N2H4 и его производные – сильные восстановители
N2H4 + 2I2 = N2 + 4HI
при действии сильных восстановителей может быть окислителем, при нагревании диспропорционирует, проявляет окислительно – восстановительную двойственность.
N2H4 + Zn + 4HCl = ZnCl2 + 2NH4Cl
3N2H4 = N2 + 4NH3
Для N2H4 характерны реакции присоединения за счет донорно-акцепторного взаимодействия – входит во многие комплексные соединения в качестве лигандов, реагирует с H2O, с кислотами, образуя соли аммония и гидразиния.
N2H4 + H2O = N2H5+ + OH–
N2H4 + HCl = [N2H5]Cl
N2H4 + 2HCl = [N2H6]Cl2
N2H4 + H2SO4 = [N2H6]SO4
ZnCl2 + 2 N2H4 = [Zn(N2H4)2]Cl2
Гидразин более сильный восстановитель, чем NH3 и окисляется чаще всего до N2.
5N2H4 + 4KMnO4 + 6H2SO4 = 5N2 + 4MnSO4 + 2K2SO4 + 16H2O
Гидроксиламин NH2OH, производное NH3 в котором один водорода при взаимодействии с водой дает гидрат гидроксиламина NH2OH · H2O.
Гидроксиламин NH2OH – слабое основание за счёт азота, проявляет свойства донора электронной пары, участвует в реакциях присоединения.
NH2OH +HCl = ( NH3OH)Cl ( NH2OH •HCl)
Соли гидроксиламина (NH3OH)Cl, (NH3OH)HSO4 - восстановители.
Для NH2OH характерны свойства восстановителя и окислителя он может восстанавливаться до N2, а также может окисляться до NH3, NH4+.
В щелочной среде наиболее характерны свойства восстановителя
NH2OH + J2 + KOH = KJ + N2 + H2O
NH2OH + KMnO4 + H2SO4 = N2 + MnSO4 + K2SO4 + H2O
В кислой среде чаще всего он восстановитель, но може быть и окислителем
NH2OH +FeSO4 + H2SO4 = (NH4)2SO4 + Fe2(SO4)2 + H2O
 NH3
NH3
N2H4 + KMnO4 + H2SO4 = N2 + K2SO4 + MnSO4 + H2O
HN3,
NH2OH
Получение: восстановление азотной кислоты атомарным водородом при электролизе раствора
HNO3 + 6H+ + 6e = NH2OH + H2O
При взаимодействии с HNO2 можно получить азотистоводородную кислоту HN3.
N2H4 + HNO2 = HN3 + 2H2O
HN3 – непрочная жидкость; ее соли (азиды) также непрочные соединения
Степень окисления азота в азид- ионе –1/3, а азидиона – 1.
На самом деле у азота
H – N-3 = N+5 ≡ N-3
[ :N– = N+ = N–:]–1 [ N ≡ N = N ]–1
· ·
· ·
2HN3 + 2Na = 2NaN3 +H2
2NaN3 = 2Na + 3N2
Азотистоводородная кислота слабая ( 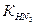 = 10–5). Соли азиды – растворимы в воде кроме азидов Ag (I), Pb (II)) Hg2+, взрывчаты, за исключением солей щелочных металлов (взрывчат только LiN3 (азиды меди и ртути взрываются при комнатной температуре).
= 10–5). Соли азиды – растворимы в воде кроме азидов Ag (I), Pb (II)) Hg2+, взрывчаты, за исключением солей щелочных металлов (взрывчат только LiN3 (азиды меди и ртути взрываются при комнатной температуре).
HN3 – окислитель – смесь HN3 и HCl по окислительным свойствам аналогична царской водке, что обусловлено образованием атомарного хлора
4H2 + HN3 = 3NH3
HN3 + 2HCl = 2Cl + N2 + NH3
Сильными окислителями HN3 окисляется.
10HN3 + 2KMnO4 + 3H2SO4 = 15N2 + 2MnSO4 + K2SO4 + 8H2O
2N3– – 2e = 3N2º | 5
Mn+7 +5e = Mn+2 | 2
Дата добавления: 2016-01-30; просмотров: 10244;
