Получение гидроксиламинсульфата
В промышленных схемах получения капролактама используются два основных продукта: циклогексанон и гидроксиламинсульфат.
Гидроксиламинсульфат был впервые синтеризован в 1865 г. Лоссеном. Более детальные исследования синтеза гидроксиламинсульфата были проведены в конце 19 века Рашигом, Диверсом и Хагом. Промышленное внедрение процесса по Рашигу было осуществлено значительно позже. В настоящее время из-за существенных недостатков:
1. многостадийности;
2. низкой степени использования аммиака ;
3. образования значительного количества побочного продукта – сульфата аммония.
В конце 40-х и в начале 50 г.г. прошлого столетия были выполнены многочисленные исследования по каталитическому восстановлению водородом окиси азота в гидроксиламин. Эти работы проводились фирмами: Дюпон, БАСФ, Инвента и Байер и рядом других фирм.
Сущность метода состоит в том, что газообразная смесь окиси азота и водорода при интенсивном перемешивании пропускается через водный раствор минеральной кислоты, в которой суспендирован мелкодисперсный катализатор. Объемное соотношение окиси азота и водорода составляет: 1: (1,3-1,5), а сама реакция протекает по уравнению:
NО + 1,5Н2 + 0,5 Н2SО4 + NН3 ® NН2ОН + 0,5(NН4)2SО4
Внедрение этого способа в производство началось в 60-е г прошлого столетия. Он примечателен тем, что позволяет в несколько раз уменьшить выработку побочного продукта – сульфата аммония.
В качестве катализатора используются платина, палладий или золото на различных пористых носителяхс развитой поверхностью, устойчивых к минеральным кислотам. Для приготовления катализатора могут быть использованы их сплавы с добавками серебра, ртути, свинца и иридия.
Смесь газообразного аммиака, водяного пара и кислород(рис.50) подают в контактный аппарат 1.
Парокислородная конверсия аммиака осуществляется на платинородиевой сетке при давлении 4 кПа (0,04 кгс/см2) и температуре 800 – 950 ºС с получением оксида азота.
Процесс может быть описан следующими уравнениями:
 4 NH3 + 5 O2 4 NO + 6 H2O + 900 кДж
4 NH3 + 5 O2 4 NO + 6 H2O + 900 кДж
 4 NH3 + 3 O2 2 N2 + 6 H2O + 1270 кДж
4 NH3 + 3 O2 2 N2 + 6 H2O + 1270 кДж
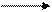 4 NH3 + 4 O2 2 N2 O + 6 H2O + 1106 кДж
4 NH3 + 4 O2 2 N2 O + 6 H2O + 1106 кДж
Оптимальное соотношение аммиак : кислород в исходной смеси, поступающей на конверсию, принимается соответствующим 1 : 1,35, что несколько выше стехиометрического по основной реакции, равного 1 : 1,25.
Изменение этого соотношения в сторону уменьшения объемной доли кислорода ведет к снижению скорости основной реакции и степени конверсии аммиака и как следствие – выхода оксида азота.
Изменение соотношения увеличением объемной доли кислорода приводит к повышенному расходу водорода в процессе дожигания кислорода или увеличению выхода азотной кислоты при конденсации водяного пара.
В нижней части контактного аппарата размещен котел-утилизатор, в котором тепло реакции используется для получения водяного пара.
В газовую смесь, охлажденную до температуры 600-650оС, добавляют небольшое количество водорода. Эту смесь подают в контактный аппарат 2.
Содержащийся в полученных оксидах азота избыточный кислород дожигается водородом на серебряно-марганцевом катализаторе.
Реакции, протекающие в процессе дожигания, могут быть описаны следующими уравнениями:
 O2 + 2 H2 2 H2 O + 484 кДж
O2 + 2 H2 2 H2 O + 484 кДж
 2 NO + H2 N2 O + H2 O + 92 кДж
2 NO + H2 N2 O + H2 O + 92 кДж
 2 NO + 2 H2 N2 + 2 H2 O + 159 кДж
2 NO + 2 H2 N2 + 2 H2 O + 159 кДж
NO2 + H2 → N O + H2 O
Двуокись азота восстанавливается водородом до окиси азота. Затем смесь проходит через котел-утилизатор 3, и холодильник-конденсатор 4.
Водяной пар, используемый в исходной смеси в качестве защитного компонента для снижения температуры реакции и повышения нижнего предела взрываемости смеси по аммиаку, конденсируется с получением слабой азотной кислоты с концентрацией 5-6%при температуре не более 40 ºC . Процесс охлаждения и конденсации сопровождается реакциями, описываемыми следующими уравнениями:
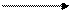 2 NO + O2 2 NO2 + 114 кДж
2 NO + O2 2 NO2 + 114 кДж
 3 NO2 + H2 O 2 HNO3 + NO + 73 кДж
3 NO2 + H2 O 2 HNO3 + NO + 73 кДж
 NO2 + NO N2 O3 + 40 кДж
NO2 + NO N2 O3 + 40 кДж
Подготовленную таким образом окись азота смешивают с водородом и смесь направляют в реактор синтеза 5, заполненный суспензией мелкодисперсного платинового катализатора в серной кислоте (30-50 г/дм3). Раствор гидроксиламинсульфата отбирают через фильтр 6, катализатор смывают с фильтра раствором серной кислоты, возвращая его в виде суспензии в реактор 5. Газы после реактора 5, содержащие избыточный водород и окислы азота, выводятся на факел. Температура в реакторе синтеза гидроксиламинсульфата 35-45 0С.
Качество гидроксиламинсульфата должен соответствовать нормам и требованиям, представленным ниже в таблице
Дата добавления: 2016-02-09; просмотров: 1793;
