БИОЛОГИЧЕСКАЯ ХИМИЯ
1. Основы химии
Атом — это мельчайшая частица любого элемента, способная принимать участие в химических реакциях.
Элементомназывается вещество, которое не может быть расщеплено химическими методами на более простые вещества; к элементам относятся, например, углерод, кислород и азот.
Вещество, состоящее из двух или нескольких химически связанных элементов, называется соединением, например:
Соединение Элементы
Вода Водород и кислород
Глюкоза Углерод, водород и кислород
Хлорид натрия Натрий и хлор
Молекула — это наименьшая частица данного элемента или соединения, способная самостоятельно существовать при обычных условиях. В качестве примеров молекул можно привести следующие: Н2, С2, СО2, Н2О.
1.1.Строение атома
Все элементы состоят из атомов. Слово «атом» происходит от греческого аtоmоs, что значит «неделимый».
В состав атома входят протоны, нейтроны и электроны (табл. 1.). Массы протонов и нейтронов равны и в сумме составляют массу атомного ядра. Масса электронов во много раз меньше, чем масса протонов и нейтронов, поэтому под массой атома подразумевают только массу его ядра.
Нейтрон состоит из одного протона и одного электрона, поэтому он электрически нейтрален, т. е. его заряд равен нулю.
Таблица 1.Положение в атоме, масса и заряд протонов, нейтронов и электронов

Атом электрически нейтрален, потому что число протонов в его ядре равно числу электронов, движущихся вокруг ядра.
Число протонов в ядре атома называется атомным номером данного элемента. Он также равен числу электронов этого атома. Сумма числа протонов и числа нейтронов данного атома называется его массовым числом.
Таблица 2.Первые 20 элементов (в порядке возрастания их атомных номеров)
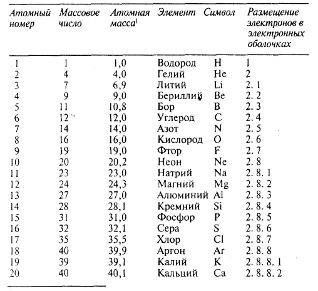
Атомы одного и того же элемента существуют в разных формах, называемых изотопами, которые отличаются друг от друга массовым числом. Атомной массойназывают среднюю массу данного атома; обычно под этим понимается средняя величина для природной смеси его изотопов. Хлор, например, представляет собой смесь изотопов с массовыми числами 35 и 37; соотношение этих изотопов таково, что у встречающегося в природе хлора атомная масса равна 35,5.
В настоящее время известно свыше 100 элементов. Их можно расположить в порядке возрастания атомных номеров, как это сделано в таблице 2.
Атомная масса называлась раньше атомным весом. Величины атомных масс даны до первого десятичного знака. Ниже перечислены (в порядке возрастания их атомных номеров) некоторые наиболее известные элементы и указаны их символы: хром (Сr), марганец (Мn), железо (Fе), кобальт (Со), никель (Ni), медь (Сu), цинк (Zn), мышьяк (Аs), бром (Вr), молибден (Мо), серебро (Аg), кадмий (Сd)), иод (I), барий (Ва), платина (Рt), ртуть (Нg), свинец (Рb), радий (Rа), уран (U), плутоний (Рu).
Как видно из этой таблицы, электроны размещаются вокруг ядра, заполняя ряд электронных оболочек. В первой электронной оболочке (ближайшей к ядру и потому наименьшей) могут удерживаться два электрона, во второй — до восьми, в третьей — до 18 и в четвертой — до 32.
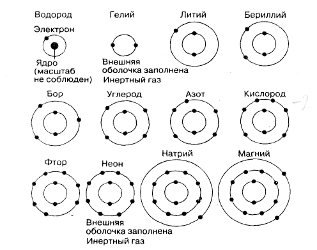
Рис. 1. Размещение электронов в электронных оболочках первых 12 элементов. (Ядро показано только у атома водорода.)
У более крупных атомов число электронных оболочек больше четырех. На рис. П. 1.1. представлено размещение электронов в электронных оболочках первых 12 элементов.
Любой элемент, у которого внешняя электронная оболочка заполнена целиком, практически нереакцион-носпособен. По этой причине гелий и неон (табл. П. 1.2) крайне редко вступают в соединение с другими атомами. Вследствие этого их называют инертными или благородными газами.
Все прочие элементы стремятся заполнить свои электронные оболочки, вступая в реакцию с другими элементами. Когда два атома реагируют друг с другом, между ними может возникнуть либо ионная, либо ковалентная связь.
1.1.1. Ионная связь
При возникновении ионных связей электроны передаются от одного атома к другому. Рассмотрим реакцию между натрием и хлором (рис. П. 1.2, А). Атом натрия, теряя электрон, получает положительный заряд +1 (его ядро, содержащее 11 положительно заряженных протонов, окружено теперь 10 отрицательно заряженными электронами). Атом хлора, приобретая электрон, получает отрицательный заряд — 1. У обоих атомов внешние оболочки оказываются заполненными и, следовательно, стабильными.
Такие заряженные частицы уже не являются настоящими атомами. Их называют ионами.Ион натрия обозначают Na+, а ион хлора (хлорид-ион) — С1- Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.Соединение, образовавшееся в результате реакции между натрием и хлором, называют хлоридом натрия (его формула — NaС1), но молекул NаС1 не существует. Вместо молекул кристаллическая решетка хлорида натрия состоит из ионов натрия и хлорид-ионов в равных соотношениях (ионная формула— Nа+С1-). Подобные соединения, образовавшиеся в результате переноса электронов, называются ионными соединениями.Образуются они главным образом тогда, когда металлы реагируют с неметаллами. Металл образует катион, а неметалл — анион. Все соли представляют собой ионные соединения. ,
Другим типичным примером ионного соединения может служить хлорид кальция — СаСl (рис. П. 1.2, Б). В этом случае атом кальция теряет два электрона, а каждый атом хлора приобретает по одному. Ион кальция обозначают поэтому Са++ или Са2+.
Число передаваемых электронов (которые приобретаются или теряются) характеризует валентностьатома, т. е. его способность к образованию химических связей. Из сказанного выше видно, что натрий и хлор одновалентны, а кальций — двухвалентен. Таким образом, число, стоящее в символе иона перед знаком «плюс» или «минус», указывает его валентность; например, валентность иона калия и гидроксид-иона (К+ и ОН-) равна 1, валентность иона магния и сульфат-иона (Мg2+ и SО42-) равна 2, а валентность иона алюминия (Аl3+) равна 3.
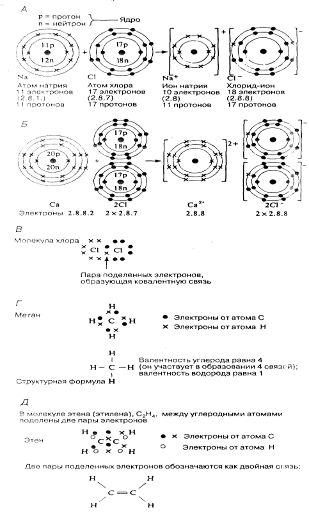
Рис 2.А.Образование хлорида натрия. Б.Образование хлорида кальция. В.Образование молекулы хлора. Г. Формула метана. Д. Формула этена. Для наглядности электроны, принадлежащие разным атомам, обозначены разными значками (крестиком, черными или белыми кружками). В действительности все электроны одинаковы. На рис. В, Г и Д показаны только внешние электронные оболочки.
Ионные формулы
Ионные соединения существуют не в молекулярной, а в ионной форме. Ионная формула показывает соотношение, в котором элементы входят в данное соединение; например, ионная формула оксида алюминия, АlОз, означает, что ионы А13+ и О2- входят в это соединение в соотношении 2:3. Если ион состоит из нескольких атомов, как, например, сульфат-ион (SО42-), и если таких ионов в соединении несколько, то в ионной формуле используются скобки, например Аl2(SО4)3; в ионной формуле Na2SO4 скобки не нужны, поскольку в этом соединении присутствует только один сульфат-ион.
1.1.2 Ковалентные связи
При возникновении связей этого типа атомы, участвующие в их образовании, не отдают и не принимают элект ронов; вместо этого электроны оказываются поделенными (обобществленными) между двумя атомами. Представим себе два атома хлора. У каждого из них во внешней электронной оболочке имеется семь электронов (электронная конфигурация 2.8.7). При ковалентном связывании каждый из двух атомов хлора приносит в обобществленную пару электронов по одному электрону: образуется молекула хлора — Сl2. Таким путем оба атома приобретают электронную конфигурацию, приближающуюся к конфигурации благородного газа, и вместо ионов образуются молекулы (рис. П.1.2, В). Поделенную пару электронов принято обозначать как одинарную связь: С—С. Хлор одновалентен (т. е. обобществляет один из своих электронов). Другой пример — метан, СН4. Атомный номер углерода бив его внешней электронной оболочке имеются 4 электрона (2.4); водород (атомный номер — 1) имеет во внешней электронной оболочке только один электрон (рис. П. 1.2, Г).
В молекуле этена (этилена) С2Н4, между углеродными атомами поделены две пары электронов и эти две пары представлены двойной связью (рис. П. 1.2, Д). В некоторых соединениях, в частности в этине (ацетилене), С2Н2, имеется тройная связь, указывающая на три пары обобществленных электронов.
Ковалентные соединения встречаются в биологических системах гораздо чаще, чем ионные.
Валентности некоторых широко распространенных элементов и заряды часто встречающихся ионов указаны в табл. 3.
Таблица 3. Валентности некоторых элементов и заряды некоторых ионов
А. Валентности некоторых элементов

Б. Заряды некоторых ионов, состоящих из одного элемента
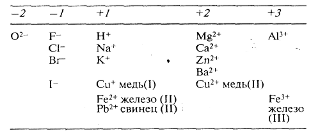
В. Заряды некоторых ионов, состоящих из нескольких элементов
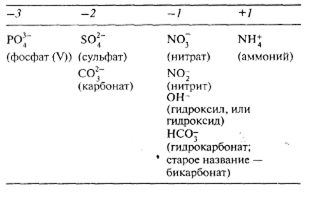
Формулы ковалентных соединений
Формулы простых ковалентных соединений указывают число атомов каждого типа, содержащихся в данной молекуле; так, формула СO2 (диоксида углерода) показывает, что в этой молекуле один атом углерода соединен с двумя атомами кислорода.
1.1.3. Химические уравнения
В химическом уравнении не только формулы всех веществ, участвующих в реакции, должны быть записаны правильно, но уравнение должно быть еще и сбалансировано, т. е. на правой и на левой его стороне число атомов каждого элемента должно быть одинаковым. Поясним, как это делается.
1. Запишите уравнение словами, например:
Метан + Кислород → Диоксид углерода + Вода
2. Замените слова формулами этих соединений:
СН4 + О2 → СО2 + Н2О.
3. Проверьте, сбалансировано ли уравнение. Уравнение в п. 2 не сбалансировано, поскольку на правой стороне указано три атома кислорода, а на левой — только два; атомы водорода также не сбалансированы: четыре стоят слева и два — справа.
4. Сбалансируйте уравнение, проставив для этого перед соответствующими формулами требуемые цифры (напомним, что сами формулы менять нельзя):
СН4 + 2О2 → СO2 + 2Н2О
2О2 означает две молекулы кислорода (4 атома кислорода); 2Н2О означает две молекулы воды (4 атома водорода, 2 атома кислорода)
Ионные уравнения
Реакции с участием ионных соединений могут записываться просто в виде ионных уравнений. Рассмотрим следующую реакцию:
2NaОН + Н2SО4 → Nа2SО4 + 2Н20
Гидроксид Серная Сульфат Вода
натрия кислота натрия
(Все три соединения в водном растворе.) Уравнение можно записать таким образом, чтобы показать все присутствующие в системе ионы:
2Na+ + 2ОH- + 2Н+ + SО42- → 2Nа+ + SО42- + 2Н2O.
Исключив все ионы, показанные и слева, и справа (не участвующие в реакции), получим:
2ОН- + 2Н+ → 2Н2О.
Только эта реакция в данном случае и имела место.
1.1.4 Кислоты, основания, соли, рН и буферы
Атом водорода состоит из одного электрона и одного протона. Если электрон утрачивается, то остается один протон, тик что протон можно рассматривать как ион водорода; обычно его обозначают Н+. Кислотой называется вещество, способное служить донором протонов; при диссоциации (диссоциация — разделение на ионы, из которых состоит данное вещество) кислота образует в качестве катиона Н+. В этой книге мы будем пользоваться определением, согласно которому кислота — это вещество, которое, диссоциируя в воде, дает в качестве катиона ионы Н + Сильной кислотой (примером может служить соляная кислота НС1) называется кислота, диссоциирующая почти полностью. Сильная кислота является, таким образом, более эффективным донором протонов. нежели слабая кислота, например уксусная или угольная, у которых лишь небольшая часть молекул диссоциирует с образованием ионов Н+:
НС1 ↔ Н+ + Сl- СН3СООН ↔ СHСОO- + H+
Соляная кислота Уксусная кислота
Ниже перечислены характерные свойства кислот.
1. Многие кислоты реагируют с такими реакционноспособными металлами, как цинк или магний, что сопровождается выделением водорода.
2. Кислоты нейтрализуются основаниями, в результате чего образуются соли этих кислот и вода.
3.Почти все кислоты реагируют с карбонатами, что сопровождается выделением диоксида углерода.
4. В разбавленных растворах кислоты имеют кислый вкус, например этановая (уксусная) кислота.
5. Растворы кислот дают характерное окрашивание с индикаторами;например, синяя лакмусовая бумага окрашивается под действием кислоты в красный цвет.
Основанием называется вещество, которое реагирует с кислотой, образуя соль и воду (по-другому основание можно определить как вещество, способное служить акцептором протонов).Большая часть оснований в воде не растворяется. Растворимые основания дают растворы, которые называются щелочами. К ним относятся, например, гидроксид натрия, гидроксид кальция и гидроксид аммония.
Ниже перечислены другие характерные свойства оснований.
1. Основания обычно плохо взаимодействуют с металлами.
2. Основания реагируют с водными растворами солей большинства металлов; при этом в осадок выпадает нерастворимый гидроксид
3. При реакции оснований с солями аммония выделяется аммиак.
4. Растворы оснований дают характерное окрашивание с индикаторами; например, красная лакмусовая бумага окрашивается под действием оснований в синий цвет.
Соль — это соединение, образующееся в результате полного или частичного замещения атомов водорода кислоты металлом. Примером может служить хлорид натрня, в котором атом водорода хлористоводородной (соляной) кислоты замещен атомом натрия. При растворении соли в воде составляющие ее ионы диссоциируют, т.е. превращаются в свободные ионы, отделенные друг от друга молекулами воды.
Шкала рН
Кислотность или щелочность раствора определяется концентрацией ионов водорода в этом растворе. Концентрацию ионов водорода выражают через рН раствора (р указывает на определенную математическую операцию; Н — химический символ водорода); рН — это десятичный логарифм величины, обратной концентрации ионов водорода. В одном кубическом дециметре (1 л) чистой воды содержится 1•10 -7 моль ионов водорода.
Следовательно, для воды величина рН равна lоg(1/107) = 7.
Эта величина (рН 7,0) характеризует нейтральный раствор (при комнатной температуре). Значения ниже 7,0 указывают на кислый раствор, а выше 7,0 — на шелочной.
Шкала рН охватывает пределы приблизительно от -1 до 15 (по большей части 0-14). Это логарифмическая шкала, так что изменение на одну единицу рН соответствует десятикратному изменению концентрации ионов водорода.
Для клеток и тканей требуется рН около 7,0 и отклонения от этой величины более чем на одну или две единицы сказываются на них губительно. Следовательно, для поддержания рН жидкостей тела на более или менее постоянном уровне существуют определенные механизмы. Частично это достигается при помощи буферов.
Буферы
Буферный раствор— это раствор, содержащий смесь какой-либо слабой кислоты и ее растворимой соли. Действие его заключается в том, чтобы противостоять изменениям рН. Такого рода изменения могут возникать вследствие разбавления, а также при добавлении кислоты или соли.
Когда кислотность (концентрация ионов водорода) возрастает, свободные анионы, источником которых служит соль, легче соединяются со свободными ионами водорода и удаляют их из раствора. Когда кислотность снижается, усиливается тенденция к высвобождению ионов водорода. Таким образом, буферный раствор поддерживает постоянную, сбалансированную концентрацию ионов водорода. Поясним это на примере:
Низкий рН
НРО42- + Н+ ↔ Н2РО4-
Гидрофосфат Высокий рН Дигидрофосфат
Некоторые органические соединения, в частности белки, способны действовать как буферы; это их качество особенно важно для крови.
1.2.Окисление и восстановление
Все биологические процессы связаны с потреблением энергии, поэтому биологам приходится изучать различные реакции, способные служить источником этой энерии. Реакции, при которых энергия высвобождается, называются экзотермическимиили экзергоническими,а реакции, в которых энергия расходуется, называются эндотермическимиили эндергоническими.Процессы синтеза (анаболические процессы) принадлежат к эндергоническим (примером может служить фотосинтез), а процессы распада (катаболические процессы) — к экзергоническим (примером может служить дыхание). Совокупность катаболических и анаболических реакций, протекающих в клетке в любой данный момент, составляет ее метаболизм.
Большую часть необходимой энергии клетка получает за счет окисления питательных веществ в процессе дыхания. Окислениеопределяют как утрату электронов. Противоположный процесс — присоединение электронов — называется восстановлением.
Эти два процесса всегда происходят одновременно: электроны передаются от донора электронов,который таким образом окисляется, к акцептору электронов,который при этом восстанавливается. Реакции этого типа называются окислительно-восстановительнымиреакциями; в химических процессах, протекающих в биологических системах, они весьма распространены. Существует несколько различных механизмов окисления и восстановления; с ними мы и ознакомимся в последующих разделах.
1.2.1 Окисление
Окисление данного вещества может происходить непосредственно путем присоединения кислорода к этому веществу, и тогда эту реакцию так и называют — окислением:
A + O2 → AO2 (вещество отдало электроны и окислилось)
Однако самой распространенной формой биологического окисления является отнятие водорода (дегидрирование):
АН2 + В → А + ВН2
В данном случае А окислилось, а В восстановилось.
В клетке содержится целый ряд веществ, называемых переносчиками водорода,которые действуют как в приведенном выше примере. Всякое дегидрирование катализируется специфической дегидрогеназой. Переносчики водорода располагаются в определенной последовательности — таким образом, что уровень их потенциальной энергии снижается от одного конца ряда (того, на котором в процесс включается водород) к другому его концу. Сказанное означает, что всякий раз, когда водородные атомы передаются от одного переносчика к другому, обладающему меньшей потенциальной энергией, этот переход сопровождается высвобождением небольшого количества энергии. В определенных случаях эта энергия может запасаться в виде АТФ.
В некоторых реакциях каждый атом водорода (его можно рассматривать как ион водорода, или протон, Н+, плюс один отрицательно заряженный электрон, ēпередается не в виде единого целого. Такой процесс включает только перенос электронов. Например:
2FеС12 + С12 ↔ 2FеСl3
Хлорид Хлорид
железа (II) железа (III)
Ионы железа(П) окисляются до железа(Ш) в результате утраты электронов, по одному на каждый ион:
Fе 2+ ↔ Fе 3+ + ē
Восстанови. Окисл.
Электроны переносятся на молекулу хлора, которая в результате этого восстанавливается, превращаясь в два хлорид-иона. Так что полное ионное уравнение имеет вид:
2Fе2+ + Сl2 ↔ 2Fе3+ + 2Сl-
Восстан. Окисл. Окисл. Восстан.
Цитохромы, в состав которых входит железо, функционируют в митохондриях, перенося электроны (поступающие от водородных атомов, разделившихся на ионы водорода и электроны) вдоль электронтранспортной цепи. Здесь электроны передаются от менее электроотрицательных атомов к более электроотрицательным. Продукты таких реакций обладают меньшей потенциальной энергией, чем исходные вещества, и количество энергии. соответствующее этой разности, выделяется и используется в той или иной форме. В конце электронтранспортной цепи стоит цитохром, содержащий помимо железа еще и медь, которая непосредственно передает электроны на атмосферный кислород, окисляясь при этом:
2Сu+ - 2 ē ↔ 2Сu2+
2Н+ + 2ē + 1/2О2 ↔ Н2О
2Н+ + 2Сu+ + ½ O2 ↔ Cu2+ + Н20
1.2.2 Восстановление
Восстановление имеет место тогда, когда от какого-нибудь вещества отщепляется молекулярный кислород, когда к веществу присоединяются атомы водорода или когда вещество присоединяет электроны.
1.4 Растворы и коллоидное состояние
Растворы состоят по меньшей мере из двух частей, или фаз: непрерывной (дисперсионной) фазы, или растворителя, и распределенной в ней дисперсной фазы, или растворенного вещества.
В 1861 г. Грэхем (Сrаhаm) выделил два типа растворенных веществ, которые он назвал кристаллоидамии коллоидами. Грэхем разделял их в зависимости от способности молекул растворенного вещества проходить через пергаментную (частично проницаемую) мембрану. На самом деле в биологических системах четкого различия между ними нет, поскольку роль биологического растворителя всегда играет вода, а свойства любого водного раствора зависят от размеров молекул растворенного вещества и от проявления силы тяжести.
Различают три типа растворов:
1) Истинные растворы. В истинных растворах частицы растворенного вещества невелики и сравнимы по величине с молекулами растворителя, т. е. система гомогенна и ее частицы не разделяются под действием силы тяжести. В качестве примера можно указать солевые растворы и раствор сахарозы. Химики рассматривают такие растворы как
системы, состоящие из одной фазы.
2) Коллоидные растворы. Частицы растворенного вещества велики по сравнению с молекулами
растворителя, т. е. система гетерогенна, но ее частицы все еще не разделяются под действием силы тяжести; примером может служить глина в воде.
3) Суспензии или эмульсии. Частицы растворенного вещества настолько велики, что оставаться в диспергированном состоянии, не оседая под действием силы тяжести, они могут лишь при непрерывном перемешивании. Если в растворителе находятся частицы твердого вещества, то такой раствор называется суспензией, а если капельки жидкости, то — эмульсией. Примером суспензии может служить ил.
Все три перечисленные системы могут считаться дисперсными, поскольку частицы распределены здесь в дисперсионной среде. В дисперсных системах встречаются все три агрегатных состояния вещества: твердое, жидкое и газообразное, например газ в воде (содовая вода), твердое вещество в воде (раствор поваренной соли) и твердое вещество в твердом веществе (цинк в меди, т. е. латунь). Во всех этих случаях можно говорить о растворах, но обычно растворами называют системы, в которых роль растворителя играет жидкость.
Многие биологические системы существуют в виде коллоидных растворов, которые могут быть гидрофобными или гидрофильными; гидрофобный золь (например, глина или древесный уголь в воде) отталкивает воду, а гидрофильный золь (крахмальный клейстер, студень, желатин и агар) притягивает ее. Большая часть коллоидных растворов, содержащихся в организмах, в частности белковые растворы, представляют собой гидрофобные золи. Вязкость гидрофобного золя, например студня, можно увеличить, повышая его концентрацию или понижая температуру. В конце концов при увеличении вязкости золь может застыть. Такой застывший золь называют гелем. Гель представляет собой более или менее плотную коллоидную систему, хотя, вообще говоря, строгого различия между золем и гелем нет. На переходы золь—гель влияют и такие факторы, как ионный состав, рН и давление. Все это при определенных обстоятельствах может играть важную роль в живых клетках.
В табл. 3. приведены различные характеристики коллоидного состояния.
Таблица 4. Характеристики коллоидного состояния
| Явление | Физические свойства |
| Диализ (разделение частиц при помощи полупроницаемых мембран) | Коллоиды не проходят через полупроницаемые мембраны |
| Броуновское движение | Очень мелкие частицы, видимые в микроскоп колеблются, не меняя своего положения. Объясняется это тем, что их непрерывно бомбардируют молекулы растворителя (наблюдать это можно, рассматривая частички туши в воде) |
| Фильтрация | Это движение частиц от размеров молекул. Определить истинные размеры частиц можно, изменяя размеры пор фильтра |
| Осмотический потенциал | У растворов гидрофобных коллоидов очень низкий осмотический потенциал. У растворов гидрофильных коллоидов осмотический потенциал невелик, но составляет все же измеримую величину |
| Осаждение | Гидрофобные коллоиды способны выпадать в осадок (коагулировать). Положительно заряженный коллоид осаждает отрицательно заряженный. Такое же действие оказывают электролиты |
| Поверхностные свойства | У коллоидных частиц площадь поверхности, соприкасающейся с окружающим растворителем, громна. |
Поверхностная энергия здесь велика, и за счет этой энергии молекулы агрегируют на поверхности раздела двух сред. Это называется адсорбцией.Древесный уголь применяется, например, для адсорбции газов в противогазах или для поглощения красителей из растворов. Данное явление используют также для стабилизации коллоидных золей; эту роль, например, выполняют яйца в майонезе или мыло в инсектицидах, изготовляемых на масляной основе
Переходы золь-гель Золь имеет жидкую консистенцию, а гель — плотную; крахмал, например, в горячей воде образует коллоидный золь, а остыв, превращается в коллоидный гель. Изменения рН, температуры, давления или присутствие ионов металла также могут вызывать переходы золь— гель
Набухание Поглощение жидкости коллоидом называется набуханием(примером может служить набухание желатина в воде)
Дата добавления: 2016-01-09; просмотров: 1113;
