Химические свойства простых веществ. При обычной температуре титан, цирконий и гафний в компактном виде (то есть в форме слитков, толстой проволоки и т
При обычной температуре титан, цирконий и гафний в компактном виде (то есть в форме слитков, толстой проволоки и т. д.) на воздухе коррозионно устойчивы. Например, титан, в противоположность сплавам на основе железа, не ржавеет даже в морской воде. Это объясняется образованием на поверхности тонкой, но сплошной и плотной защитной оксидной пленки. При нагревании пленка разрушается, и активность металлов заметно возрастает. Так, в атмосфере кислорода металлы загораются лишь при температуре белого каления (1000 °C), превращаясь в порошки оксидов ЭО2, реакции с азотом и водородом протекают примерно при тех же температурах, но гораздо медленнее, при этом образуются нитриды ЭN и гидриды ЭНх (1<x<4) (см. учебник т. 2, раздел 1). Площадь поверхности металла существенно влияет на скорость реакций окисления: тонкие стружки титана, циркония и гафния ярко вспыхивают при внесении в пламя, а очень мелкие порошки пирофорны – на воздухе самовоспламеняются. Циркониевая пыль с размером частиц 10 мкм на воздухе может взрываться. Это необходимо учитывать при механической обработке этих металлов.
Реакция с галогенами (Г2) начинается при слабом нагревании и, как правило, сопровождается выделением значительного количества теплоты, при этом всегда образуются тетрагалогениды ЭГ4. Лишь взаимодействие с иодом требует более высоких температур (500 °C).
С другими металлами элементы 4-ой группы образуют химические соединения – интерметаллиды, (например, в системе Zr – Al существует восемь интерметаллидов Zr3Al, Zr2Al, Zr3Al2, Zr4Al, ZrAl, Zr2Al3, ZrAl2 и ZrAl3), твердые растворы* с неограниченной (Ti – V , Zr – Nb) и ограниченной (Zr – V , Hf – Mo, Ti – Al) растворимостью.
Все три металла имеют отрицательные электродные потенциалы (табл. 3.3) и должны выделять водород из воды, поскольку 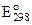 (Н+/Н2) при рН = 7 равен –0.414 В. Однако образование защитного оксидного слоя кинетически тормозит реакцию
(Н+/Н2) при рН = 7 равен –0.414 В. Однако образование защитного оксидного слоя кинетически тормозит реакцию
М + 2Н2О = МО2 + 2Н2,
которая с заметной скоростью протекает лишь при высоких (>800 °C) температурах.
В отличие от циркония и гафния, титан при нагревании энергично реагирует с соляной и разбавленной серной кислотами с выделением Н2 и образованием солей титана(III) ( 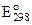 (Ti3+/Ti0) = –1.21 В)
(Ti3+/Ti0) = –1.21 В)
2Ti + 6HCl = 2TiCl3 + 3H2.
Взаимодействие с соляной кислотой протекает гораздо энергичнее, чем с серной такой же концентрации, что объясняется образованием хлоридных комплексов.
Крайне медленно титан растворяется в разбавленной и концентрированной азотной кислоте, а даже в царской водке – протеканию реакции препятствует образование на поверхности металла слоя β-титановой кислоты (см. ниже). При взаимодействии с олеумом образуется сульфат титана(IV) и выделяется сернистый газ:
Ti + 4H2S2O7 = Ti(SO4)2 + 2SO2 + 4H2SO4.
За счет образования комплексных соединений, понижающих электродный потенциал** соответствующих систем, титан растворяется в концентрированной плавиковой кислоте
Ti + 6HF = H2[TiF6] + 2Н2.
При нагревании титан растворяется в концентрированных растворах и расплавах щелочей:
Ti + 2NaOH + H2O = Na2TiO3 + 2H2.
Цирконий и, особенно гафний, гораздо более устойчивы к окислению кислотами по сравнению с титаном. Они устойчивы во всех разбавленных кислотах, за исключением плавиковой. Даже в дымящей азотной кислоте при 35 °C в сутки растворяется лишь 3,97 ммоль металла, а скорость коррозии составляет 0,0112 мм в год. Оба металла энергично реагируют лишь со смесью азотной и плавиковой кислот
3Э + 4HNO3 + 21HX = 3H3[ЭX7] + 4NO + 8H2O,
более медленно протекает взаимодействие с плавиковой и концентрированной серной кислотами
Э + 7HX = H3[ЭX7] + 2H2,
Э + 5H2SO4 = H2[Э(SO4)3] + 2SO2 + 4H2O,
где Э = Zr и Hf.
Концентрированная HNO3 повышает коррозионную стойкость металлов, способствуя образованию защитной пленки.
Цирконий и гафний, в противоположность титану, с щелочами не реагируют. Особенно устойчив гафний: коррозия металла не наблюдается даже в кипящем расплаве гидроксида натрия в присутствии пероксида натрия.
Оксиды
В настоящее время известно несколько оксидов титана, начиная от низших, например, Ti6O, Ti3O, представляющих собой твердые растворы кислорода в титане, до высшего TiO2. В целом для металлов четвертой группы наиболее характерны диоксиды ЭО2 (табл. 3.4). Диоксид титана TiO2 существует в виде трех полиморфных модификаций – рутила, анатаза и брукита, которые встречаются в природе в виде минералов.
Таблица 3.4. Некоторые свойства диоксидов
| Оксид | Тип структуры | –Df 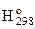 ,кДж/моль ,кДж/моль
| Тпл., °C | Плотность, г/см3 |
| TiO2, рутил | Тетрагональная | 4.2-4.6 | ||
| TiO2, анатаз | Тетерагональная | - | 3.8-4.0 | |
| TiO2, брукит | Ромбическая | - | - | 4.10 |
| ZrO2 | Кубическая, тип CaF2, устойчива выше 2200°C | 6.27 | ||
| HfO2 | Кубическая, тип СаF2, устойчива выше 2700оС | 9.68 |
Брукит и анатаз относятся к низкотемпературным модификациям оксида титана и при нагревании выше 850 °C превращаются в термодинамически более устойчивый рутил. Стр ктура всех трех модификаций построена из кислородных октаэдров [TiO6], в центре которых находятся атомы титана. У рутила октаэдры имеют по два, анатаза – по четыре, у брукита – по три общих ребра (рис. 3.6). Сочленение по ребрам приводит к искажению кислородных октаэдров и увеличению плотности модификаций TiO2.
В кратере вулкана Риес (Германия) обнаружена модификация TiO2 изоструктурная с бадделеитом ZrО2 см. ниже), построенная из полиэдров TiO7. Она на 11% плотнее рутила [Joresy A.E., Science, (2001), v, 293, p, 146]. При высоких давлениях (>60 кбар) и температуре (1000 К) синтезирована новая модификация TiО2 со структурой типа PbCl2, которая оказалась самой твердой из известных оксидов [Dubrovinsky L.S., Nature (London), (2001), v. 410, p. 653].
Диоксиды ZrO2 и HfO2 имеют также по три кристаллические модификации – моноклинные (наиболее устойчивы), тетрагональные и кубические (типа CaF2) с координационными числами металла семь и восемь. Переход моноклинных модификаций (рис. 3.7а) в тетрагональные сопровождается уменьшением объема, повышением координационного числа металла и плотности вещества. Например, плотность моноклинного ZrO2 (бадделеит) составляет 5.68 г/см3, а кубического – 6.27 г/см3. При понижении температуры это приводит к возникновению напряжений и растрескиванию массивных образцов, что препятствует применению чистого ZrO2 в качестве огнеупорного материала. Однако замещение части ионов Zr4+ в кристаллической решетке двух- и трехзарядными катионами с большими радиусами приводит к увеличению параметров кристаллической решетки и стабилизации кубической модификации от комнатной температуры до температуры плавления. Электронейтральность при этом сохраняется за счет образования анионных вакансий 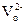 , например,
, например,
Сa + ZrO2 = 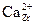 +
+ 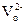 .
.
Безводные диоксиды ЭО2 обычно получают прокаливанием кислород-содержащих солей и гидроксидов. Диоксиды ЭО2 – тугоплавкие бесцветные вещества, в ряду TiO2 – ZrO2 – HfO2 растут ионная составляющая химической связи, энергии кристаллической решетки, температуры плавления и энтальпии образования (табл. 3.4). Благодаря большой энергии кристаллической решетки, они обладают высокой инертностью, например, диоксид циркония не реагирует даже с расплавленным алюминием при 700 °C. Диоксиды не растворяются не только в воде, но и в водных растворах кислот (кроме HF) и щелочей. Лишь при длительном нагревании они медленно взаимодействуют с концентрированными растворами кислот, например:
300 °C
ZrO2 + H2SO4 конц + (NH4)2SO4 ¾¾¾® (NH4)2Zr(SO4)3 + H2O.
Чаще всего их переводят в растворимое состояние сплавлением с пиросульфатами, кислыми фторидами, щелочами:
ZrO2 + 2K2S2O7 = K2Zr(SO4)3 + K2SO4,
ZrO2 + 4KHF2 = K3ZrF7 + 2H2O + KF,
ZrO2 + 2NaOH = Na2ZrO3 + H2O
или хлорированием в присутствии углерода
ZrO2 + 4C + 2Cl2 = ZrCl4 + 4CO.
Оксиды титана и циркония служат важными керамическими материалами. Интересно, что при нагревании на воздухе или облучении рутил становится серо-голубым, частично теряя кислород и приобретая стехиометрию TiO1.985.
Дата добавления: 2016-01-03; просмотров: 2061;
