I. Растворы классифицируются по агрегатному состоянию растворителя и растворенного вещества.
Растворы могут быть жидкими, твердыми и газовыми.
Растворителем может быть твердое вещество, жидкость и газ.
Практически все газы друг в друге растворяются. В жидкостях растворяются жидкости, газы и твердые вещества. В твердых телах растворяются только твердые тела. В твердых растворах происходит образование гомогенной системы из твердых компонентов.
Газовые растворы – это растворы газов, жидкостей и твердых тел в газах. В пределе при нулевом давлении любой реальный газ представляет систему независимых друг от друга частиц, т.е. обладает признаками идеальной системы. Смесь этих газов, называемая идеальным газом, подчиняется закону Дальтона: 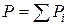 (где Р – общее давление; Рi – парциальное давление i-го компонента). С повышением давления появляется взаимодействие между частицами, тогда смесь реальных газов, паров жидкости и твердых тел рассматривают как газовый раствор.
(где Р – общее давление; Рi – парциальное давление i-го компонента). С повышением давления появляется взаимодействие между частицами, тогда смесь реальных газов, паров жидкости и твердых тел рассматривают как газовый раствор.
Наибольшее распространение получили жидкие, в частности, водные растворы. В случае растворов «жидкость – газ» и «жидкость – твердое тело» растворителем принято считать жидкость. У растворов «жидкость – жидкость» растворителем считают компонент, который находится в избытке по сравнению с другими компонентами, именуемых растворенными веществами.
В зависимости от свойств растворенного вещества различают жидкие растворыне электролитов, электролитов и высокомолекулярных соединений (ВМС). Последние являются предметом рассмотрения в коллоидной химии.
Количество вещества, растворенного в данном объеме растворителя, называется концентрацией.
СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИЙ:
1)Молярная концентрация М(или молярность) – число молей вещества, растворенного в 1 м3 (или литре) раствора:
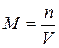
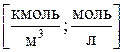
2)Моляльная концентрация т (или моляльность) – число молей растворенного вещества в 1 кг или 1000 г растворителя:
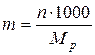
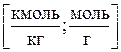
где Mp – масса растворителя.
3)Процентная концентрация ωопределяется количеством граммов вещества в 100 г (весовые) или 100 мл (объемные) раствора:
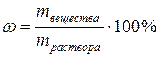 или
или 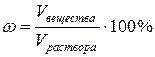
4)Мольная доля N– отношение числа молей ni одного компонента к суммарному числу молей n всех компонентов раствора:
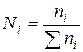
Сумма мольных долей всех компонентов раствора равна единице:
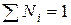
Пример. Проведем расчет М, m и N по известной массовой концентрации серной кислоты ω=98%, плотность раствора равна 1,84 г/л; молярные массы компонентов раствора равны 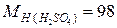 г/моль;
г/моль; 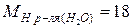 г/моль.
г/моль.
Молярность раствора равна:
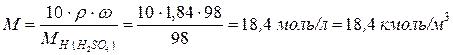
Моляльность раствора составляет:
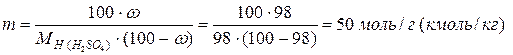
Мольная доля серной кислоты равна:
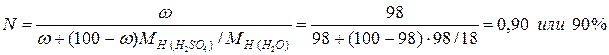
Дата добавления: 2016-02-02; просмотров: 3911;
