Агрегатные состояния вещества. Идеальные газы
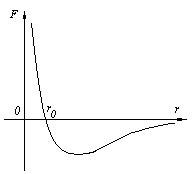
Силы межмолекулярного взаимодействия являются короткодействующими: они проявляются на расстояниях r≤10–9м и быстро уменьшаются при увеличении расстояния между молекулами. На рисунке 6 представлена качественная зависимость результирующей силы взаимодействия F=Fпр+Fот от расстояния r между молекулами (силы отталкивания считаются положительными, а силы притяжения отрицательными). Результирующая сила равна нулю на расстоянии r = r0, соответствующем равновесному расстоянию между молекулами, на котором бы они находились в отсутствие теплового движения.
|
r = r0, Fот = Fпр ,
r < r0, Fот > Fпр ,
r > r0, Fот < Fпр ,
r ® ¥, F ® 0.
Рисунок 6 – Зависимость силы взаимодействия между молекулами
от расстояния между ними
Равновесному расстоянию r0 соответствует Пmin – наименьшая потенциальная энергия взаимодействия молекул. Критерием различных агрегатных состояний вещества является соотношение величин Пmin и kT (k – постоянная Больцмана, T – абсолютная температура). Величина kT представляет собой меру теплового хаотического движения молекул при данной температуре.
Если Пmin << kT, то вещество находится в газообразном состоянии.
Если Пmin >> kT, то вещество находится в твердом состоянии.
Если Пmin ≈ kT, то вещество находится в жидком состоянии.
Скорость движения молекул и их средняя кинетическая энергия Tкинзависят от температуры, поэтому критерий различных агрегатных состояний вещества можно выразить через соотношение между кинетической энергией теплового движения молекул и потенциальной энергией их взаимодействия. В газах взаимодействие между молекулами мало, а интенсивность теплового хаотического движения велика. В твердых телах потенциальная энергия взаимодействия частиц много больше их кинетической энергии. В жидкостях потенциальная энергия взаимодействия молекул сравнима с их кинетической энергией.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой:
1) молекулы газа не взаимодействуют между собой;
2) собственный объем молекул пренебрежимо мал по сравнению с объемом сосуда;
3) столкновения молекул между собой и со стенками сосуда носят упругий характер.
Модель идеального газа хорошо описывает многие реальные газы при нормальных условиях, а также газы при низких давлениях и высоких температурах.
Состояние идеального газа описывается тремя макроскопическими параметрами: T – температура, p – давление, V – объем. Для данной массы газа m соотношение между этими параметрами представляет собой уравнение Менделеева–Клапейрона:
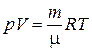 . (2.4.1)
. (2.4.1)
В уравнении (2.4.1) R – универсальная газовая постоянная, μ – молярная масса газа.
Если какой-либо из термодинамических параметров системы изменяется, то происходит изменение состояния системы, называемое термодинамическим процессом. Термодинамический процесс называется равновесным, если система бесконечно медленно проходит непрерывный ряд бесконечно близких термодинамических равновесных состояний. Совокупность процессов, в результате которых газ возвращается в первоначальное состояние, называется циклом.
Изопроцессами называются термодинамические процессы, происходящие в системе с постоянной массой при каком-либо одном постоянном параметре состояния. Различают изобарический (p=const), изохорический (V=const) и изотермический (T=const) процессы. Большое значение в природе и технике имеет адиабатический процесс – процесс, происходящий без теплообмена с окружающей средой. Все быстро протекающие процессы с хорошей точностью являются адиабатическими.
Дата добавления: 2016-01-26; просмотров: 3053;
