Общая характеристика
Химия элементов 4-ой группы – титан Ti, цирконий Zr, гафний Hf
Общая характеристика
Описание химии d-элементов принято начинать с металлов четвертой группы, так как элементы третьей группы, открывающие d-ряды, практически во всех соединениях не содержат d-электронов, их химия будет рассмотрена в главе, посященной лантанидам. В состав 4-ой группы входят титан 22Ti, цирконий 40Zr, гафний 72Hf и резерфордий 104Rf.
Первые три металла состоят из нескольких природных изотопов (табл. 3.1), некоторые из которых радиоактивные с большими периодами (i1/2) полураспада, например, i1/2 = 3×1017 лет для 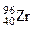 и i1/2 = 2×1015 лет для
и i1/2 = 2×1015 лет для 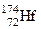 . Элемент резерфордий в природе не встречается и получен искусственно путем ядерных реакций (см. ниже). Все его изотопы радиоактивные, наиболее долгоживущий изотоп 259Rf имеет период полураспада 4,5 сек.
. Элемент резерфордий в природе не встречается и получен искусственно путем ядерных реакций (см. ниже). Все его изотопы радиоактивные, наиболее долгоживущий изотоп 259Rf имеет период полураспада 4,5 сек.
Титан был открыт в 1791 г. английским химиком У. Грегором в минерале ильмените FeTiO3. Независимо от него в 1795 г. немецкий химик М. Клапрот обнаружил этот элемент в минерале рутиле TiO2 и назвал его в честь доолимпийских богов титанов – детей Урана и Геи. Титаны, впоследствии низвергнутые Зевсом в тартар – царство тьмы – отличались гордыней и необузданностью нравов. Элемент цирконий, также открытый Клапротом в 1789 г., получил названия от минерала циркона ZrO2 (в переводе с арабского «золотистый»). Гафний был выделен из циркониевой руды лишь в 1922 г. в лаборатории Н. Бора в Копенгагене голландцем Д. Костером и венгром Г. Хевеши и назван в честь римского поселения Hafnia, находившегося на месте нынешнего Копенгагена. Резерфордий впервые был обнаружен советскими учеными в 1964 г в продуктах спонтанного деления ядер, а позднее получен в США в циклотроне при бомбардировке изотопа 94242Pu ускоренными ионами 1022Ne:22Ne + 242Pu  260104Rf + 4 1n. Советские ученые выступили в инициативой назвать элемент курчатовием в честь академика И. В Курчатова, возглавлявшего Объединенный институт ядерных исследований в Дубне. Комиссией ИЮПАК элементу присвоено название Резерфордий. Резерфордий является первым элементом, следующим за актиноидами. Его электронная конфигурация 5f146d27s2 аналогична конфигурации гафния 4f145d26s2, что подтверждается сходством их химических свойств. Безводный хлорид резерфордия RfCl4 по летучести близок HfCl4 (т. возг. 313 °C) и намного более летуч, чем хлориды актиноидов (т. кип. выше 1500 °C). Это позволило чехословацкому учёному И. Зваре отделить атомы резерфордия от актиноидов.
260104Rf + 4 1n. Советские ученые выступили в инициативой назвать элемент курчатовием в честь академика И. В Курчатова, возглавлявшего Объединенный институт ядерных исследований в Дубне. Комиссией ИЮПАК элементу присвоено название Резерфордий. Резерфордий является первым элементом, следующим за актиноидами. Его электронная конфигурация 5f146d27s2 аналогична конфигурации гафния 4f145d26s2, что подтверждается сходством их химических свойств. Безводный хлорид резерфордия RfCl4 по летучести близок HfCl4 (т. возг. 313 °C) и намного более летуч, чем хлориды актиноидов (т. кип. выше 1500 °C). Это позволило чехословацкому учёному И. Зваре отделить атомы резерфордия от актиноидов.
В основном состоянии атомы элементов 4-ой группы имеют электронную конфигурацию (n-1)d2ns2 (табл. 3.1). Суммарная энергия ионизации при переходе от титана к цирконию уменьшается, что обусловлено увеличением энергии связи
Таблица 3.1. Свойства элементов 4-ой группы
| Элемент | 22Ti | 40Zr | 72Hf | ||
| Атомная масса | 47.867 | 91.224 | 178.49 | ||
| Электронная конфигурация | [Ar]3d24s2 | [Kr]4d25s2 | [Xe]4f145d26s2 | ||
| Энергии ионизации (I), кДж/моль | Первая (I1) | ||||
| Вторая (I2) | |||||
| Третья (I3) | |||||
| Четвертая (I4) | |||||
| I1 + I2 + I3 + I4 | |||||
| Число стабильных изотопов | |||||
| Сечение захвата тепловых нейтронов, барн | 0,18 | ||||
| Металлический радиус (нм) | 0.147 | 0.160 | 0.159 | ||
| Ионный радиус для координационного числа 6 (нм) | Э(IV) | 0.060 | 0.071 | 0.071 | |
| Э(III) | 0.067 | - | - | ||
| Э(II) | 0.086 | - | - | ||
| Электроотрицательность по Полингу | 1.54 | 1.33 | 1.30 | ||
| Электроотрицательность по Оллреду-Рохову | 1.32 | 1.22 | 1.23 | ||
| Степень окисления х) | (-1); 0; (2), 3; 4; | (-1); 0; (1), (2), (3); 4; | (-1); 0; (1), (2), (3); 4; | ||
х) В скобках указаны неустойчивые степени окисления.
ns-электронов с ядром из-за роста эффективного заряда ядер. Дальнейший ее рост при переходе от циркония к гафнию вызван увеличением экранирующего действия 4d- и 4f-атомных орбиталей (см. т. 1 раздел 2.3 учебника). Для сравнения отметим, что в 14-ой группе элементов (Ge, Sn, Pb) энергии ионизации ns2-и np2-электронов существенно выше (см. т. 2, глава 5).
Увеличение числа электронных слоев приводит к заметному росту атомных радиусов при переходе от титана к цирконию. Однако дальнейший рост атомного радиуса, связанный с появлением у атома гафния электронов на шестом энергетическом уровне, практически полностью нивелируется сжатием электронных слоев при заполнении 4f-оболочки (лантанидное сжатие), вследствие чего атомные (а также ионные) радиусы циркония и гафния практически совпадают (табл. 3.1). Это приводит к исключительному сходству свойств соединений этих элементов и трудности их разделения.
Для элементов 4-ой группы наиболее характерна степень окисления +4, при этом высокие потенциалы ионизации четырех электронов компенсируются энергией образующихся связей и энергией кристаллической решетки. Вместе с тем, подавляющее большинство соединений элементов четвертой группы (за исключением фторидов и оксидов) ковалентные, в них отсутствуют ионы М4+. По мере роста атомного радиуса степень ионности соединений аналогичного состава несколько увеличивается, возрастают температуры плавления и кипения, устойчивость к гидролизу. Так, например, фторид титана(IV) необратимо разлагается водой, а аналогичные фториды циркония и гафния могут быть выделены из водных растворов в виде гидратов. Тригидраты фторидов циркония и гафния при нагревании отщепляют воду, превращаясь в безводные фториды.
В ряду Ti-Zr-Hf устойчивость соединений с высшей степенью окисления возрастает. Например, для титана устойчивы оксиды TiO, Ti2O3, TiO2 и фториды TiF2, TiF3, TiF4, а для Zr и Hf – только диоксиды ZrO2, HfO2 и тетрафториды ZrF4, HfF4. Образование химических соединений из простых веществ сопровождается затратой энергии для разрыва связей в исходных веществах и выделением энергии за счет образования новых химических связей. Например, при образовании ЭF2, ЭF3, ЭF4 затраты энергии на атомизацию металла и разрыв связей в молекуле F2 одни и те же. С увеличением порядкового номера элемента энтальпии атомизации (табл. 3.3) и ионизации (табл. 3.1) возрастают и могут быть скомпенсированы за счет образования большего числа связей Э – F. Таким образом, наиболее характерными становятся фториды элемента с высшими степенями окисления. У германия, олова и свинца, которые в короткопериодном варианте Периодической таблицы находятся в одной группе с титаном, цирконием и гафнием, устойчивость степеней окисления изменяется в противоложном направлении: высшая степень окисления наиболее устойчива у германия. Это является проявлением релятивистского эффекта (см. главу 5, том 2).
Склонность к проявлению низших степеней окисления +3, +2 у титана выше, чем у его тяжелых аналогов (рис. 3.1). В виде аква-ионов соединения титана(III) cуществуют в кислых водных растворах, из которых выделены соответствующие сульфаты и галогениды. Соединения циркония(III) и гафния(III) в водных растворах не существуют, так как легко окисляются водой. С понижением степени окисления усиливаются основные и восстановительные свойства соответствующих соединений, например, гидроксид титана Ti(ОН)3 оказывается более сильным основанием, чем гидратированный оксид титана(IV).
Координационные числа и пространственное строение комплексных соединений определяются электронной конфигурацией, размерами, стерическими и электронными взаимодействиями центрального атома металла и соответствующих лигандов. Для титана типичны координационные числа 6 и реже 4, для циркония и гафния более характерны увеличенные координационные числа 7 и 8 (табл. 3.2).
Атомы элементов 4-ой группы, подобно другим переходным металлам, активно используют d-орбитали в образовании химических связей. Большие атомные радиусы и возможность образования гибридных s-p-d-орбиталей приводят к наличию у циркония и гафния высоких координационных чисел. Так, образование комплексов с координационным числом 9 можно представить как результат гибридного перекрывания одной s-, трех p- и пяти d-орбиталей металла с последующим заполнением их лигандами (d5sp3-гибридизация). Во фторидном комплексе [ZrF8]4–, имеющем форму двухшапочной тригональной призмы, в гибридизации не принимает участие dz2-орбиталь, ей соответствует несвязывающая МО (Рис. 3.2. Схема образования комплекса [ZrF8]4– по методу валентных связей (а) и его строение (б)), это соответствует d4sp3-гибридизации. В качестве лигандов могут выступать также и другие неорганические ионы (сульфат-, нитрат-, роданид- и др.), а также органические молекулы – бипиридил (C6H5N)2, этилендиамин H2NCH2CH2NH2 и др.(табл. 3.2). Благодаря образованию комплексных соединений, гидроксид TiO2×xH2О хорошо растворяется в уксусной и винной кислотах, присутствие которых препятствует гидролизу солей титана. Хелатные комплексы (см. раздел 1.2) Zr(IV) с бидентатными кислород-донорными лигандами, например, ацетилацетоном, стабильны и легко переходят в газовую фазу, что позволяет использовать их для нанесения термостойких пленок оксида циркония.
В состояниях с низшей степенью окисления, особенно для Zr и Hf из-за перекрывающихся 4d- или 5d-орбиталей, возможно образование кластерных соединений, например, ZrCl, со слоистой графитоподобной структурой, содержащей связи Zr – Zr.
Известны и металлоорганические соединения, например, циклопентадиенильные комплексы M(C5H5)X2. Эти вещества летучи, растворяются в неполярных растворителях, но легко разрушаются на воздухе и во влажной атмосфере.
Таблица 3.2. Степени окисления, электронные конфигурации, координационные числа (К.Ч.) и геометрия молекул и ионов 4 группы
| Степень окисления | Электронная конфигурация | К.Ч. | Геометрия | Примеры молекул и ионов |
| -1 | d5 | Октаэдр | [M(bipy)3]- *); M=Ti, Zr | |
| d4 | Октаэдр | Ti(CO)6 **) | ||
| +2 | d2 | Октаэдр | TiO; TiCl2 | |
| +3 | d1 | Октаэдр | [Ti(H2O)6]3+; TiCl3; ZrX3 (X = Cl, Br, I) | |
| +4 | do | Тетраэдр | TiCl4; ZrCl4 (газ) | |
| Октаэдр | [TiF6]2-; CaTiO3 (перовскит); [ZrF6]2- | |||
| Пентагональная бипирамида | (NH4)3[ZrF7]; ZrO2 (тип флюорита) | |||
| Квадратная антипризма | [Zr(acac)4]; | |||
| Двухшапочная тригональная призма | [ZrF8]4- | |||
| Додекаэдр | Ti(NO3)4, [Zr(C2O4)4]4– |
*) bipy – 2,2’-бипиридил (C6H5N)2.
**) Получен конденсацией паров Ti и СО в матрице инертного газа при 10-15 К.
3.2 Распространенность в природе, получение и применение простых веществ.
Среди элементов четвертой группы в природе наиболее распространен титан – он занимает девятое место среди всех элементов (0.63 % мас). Цирконий (0.016 % мас) и гафний (3×10-4 % мас) существенно уступают ему по распространенности и относятся к числу редких. Все элементы подгруппы титана в природе встречаются исключительно в виде соединений. Из минералов титана наибольшее значение имеют рутил TiO2, ильменит FeTiO3, перовскит CaTiO3 , у циркония – бадделеит ZrО2 и циркон ZrSiО4. Гафний относится к рассеянным элементом, практически не образует самостоятельных минералов (существует минерал гафнон HfSiO4 в сростках с цирконом ZrSiO4), встречаясь исключительно в виде примеси к соединениям циркония.
Простые вещества получают металлотермическим восстановлением хлоридов, фторидов или фторидных комплексов. В качестве восстановителя обычно используют магний, кальций или натрий:
900 °C
ЭCl4 + 2Mg = Э + 2MgCl2, Э = Ti, Zr, Hf,
850 °C
ЭF4 + 2Ca = Э + CaF2, Э = Zr, Hf,
750 °C
K2ЭF6 + 4Na = Э + 4NaF + 2KF, Э = Zr, Hf.
Восстановление протекает ступенчато, через стадии образования низших галогенидов.
Возникает вопрос – почему восстановлению подвергают хлориды элементов, а не их оксиды, которые, к тому же, встречаются в природе. Это объясняется тем, что высшие оксиды титана, циркония и гафния – тугоплавкие кристаллические вещества, характеризующиеся высокой энергией кристаллической решетки и низкой химической активностью. Так, водород при 900 °C восстанавливает TiO2 лишь до Ti3O5. Продукт реакции металлотермии с участием Na, Mg, Ca представляет собой порошок, содержащий примеси интерметаллидов и низших оксидов.
Поскольку при высоких температурах Ti, Zr и Hf взаимодействуют с кислородом и азотом, процесс проводят в атмосфере аргона или гелия. Металл при этом получается в виде пористой массы – губки, содержащей примеси непрореагировавшего металла (магния, кальция) и образовавшихся солей. Его очищают обработкой слабым (1 %-ным) раствором соляной кислоты или нагреванием в вакууме – при этом летучие металлы (магний, натрий) и галогениды переходят в пар. Очищенную губку переводят в слиток нагреванием в электродуговых печах.
Для получения высокочистых металлов с содержанием примесей менее 0,1% используют метод йодидного рафинирования, предложенный нидерландским химиком Антоном ван Аркелем в 1925 г (рис. 3.3а Схема реактора для иодидного рафинирования титана). Неочищенный металл (Ti, Zr или Hf) нагревают в вакуумированном сосуде с небольшим количеством йода. Пары образующегося при этом галогенида
200 °C
Tiтв + 2I2(газ) ↔ TiI4 (газ)
соприкасаются с раскаленной до 1400 °C титановой (вольфрамовой) нитью и разлагаются. Титан осаждается на нити в виде крупных кристаллов, а выделившийся йод вступает в реакцию с новыми порциями металла. В ходе процесса иод практически не расходуется, а выполняет роль переносчика металла из холодной зоны в горячую. Такие реакции называют химическими транспортными реакциями.
Интересно, что скорость осаждения титана на нити немонотонно зависит от температуры стенок реактора (Рис. 3.3б Зависимость скорости осаждения титана на вольфрамовой нити от температуры реактора). Она достигает максимума при 200 °C, при дальнейшем нагревании резко падает, при 400 °C становясь практически равной нулю, и возвращается к прежним значениям лишь около 520 °C. Это объясняется образованием различных веществ. При низких температурах взаимодействие титана с иодом приводит к тетраиодиду TiI4, обладающему высокой летучестью. При температурах выше 300 °C образуется дииодид TiI2, имеющий гораздо более низкую летучесть, которая становится существенной лишь при температурах выше 500 °C.
Дата добавления: 2016-01-03; просмотров: 2568;
