Гидроксиды, соли кислородсодержащих кислот и комплексные соединения металлов шестой группы.
Соединения хрома часто значительно отличаются по свойствам от аналогичных соединений тяжелых металлов шестой группы – молибдена и вольфрама, имеющих тенденцию в низших степенях окисления к образованию кластеров, а в высшей степени окисления существующих в форме изополи- и гетерополианионов.
С ростом степени окисления основные свойства оксидов и гидроксидов постепенно сменяются кислотными, восстановительная способность соединений убывает, а окислительная – возрастает. Так, соединения хрома(II) (CrO, Cr(OH)2) имеют основный характер и являются сильными восстановителями, высшему оксиду хрома CrO3 соответствуют хромовая H2CrO4 и двухромовая кислоты H2Cr2O7, для них характерны окислительные свойства. Соединения хрома в промежуточных степенях окисления, главным образом, +3 (Cr2O3, Cr(OH)3), амфотерны. Они наиболее устойчивы в водных растворах, по отношению как к окислению, так и к восстановлению.
Соединения хрома, молибдена и вольфрама +2.
Соединения, содержащие ионы M2+, характерны лишь для хрома. Молибден и вольфрам в степени окисления +2 образуют кластеры, например, [M6X8]4-. Соединения W(II) менее характерны, например, биядерный ацетат W(II) не существует, а структурный аналог ацетата Cr(II) ацетат Mo(II) [Mo(CH3COO)2]2 – исходный препарат для синтеза биядерных комплексов молибдена.
При взаимодействии металлического хрома с кислотами-неокислителями или при восстановлении подкисленных растворов солей хрома(III) цинком, амальгамой цинка или под действием электрического тока
Cr2(SO4)3 + Zn = 2CrSO4 + ZnSO4
в отсутствие кислорода воздуха образуются ярко-синие растворы солей хрома(II), содержащие ион гексааквахрома(II) [Cr(H2O)6]2+.
Для хрома в степени окисления +2 (d4) возможно образование как высокоспиновых (t2g3eg1), так и низкоспиновых (t2g4) комплексов. Акваионы, как и другие комплексы с лигандами слабого поля, являются высокоспиновыми. В них один из электронов расположен на разрыхляющей (eg) орбитали, а при его удалении в процессе окисления ( 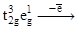
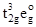 ) возникает устойчивая электронная конфигурация
) возникает устойчивая электронная конфигурация 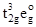 . Именно этим объясняется тот факт, что соединения хрома(II) – сильные восстановители
. Именно этим объясняется тот факт, что соединения хрома(II) – сильные восстановители
Cr3+ + 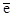 = Cr2+, Eo = -0.41 В.
= Cr2+, Eo = -0.41 В.
Они легко окисляются кислородом воздуха
4[Cr(H2O)6]2+ + O2 + 4H+ = 4[Cr(H2O)6]3+ + 2H2O,
а в отсутствии окислителя медленно восстанавливают воду
2CrSO4 + 2H2O = 2Cr(OH)SO4 + H2.
Семиводный сульфат хрома(II), изоструктурный железному купоросу, постепенно окисляется даже при хранении в вакуумированной ампуле.
Восстановительная способность соединений хрома(II) усиливается в щелочной среде. Коричневый осадок гидроксида хрома Cr(OH)2, получаемый в инертной среде действием аммиака или щелочи на соли хрома(II), способен восстановить СО до метана (Миронова С.А., Никонова Л. А., Изв. АН СССР, Серия хим., 1985, т. 34, н.12, с. 2788).
Низкий эффективный заряд и большой радиус (0.082 нм) обусловливают основный характер гидроксида (Kb = ), малую склонность к гидролизу солей (Кг1(Cr2+) = 5×10–6) и слабо выраженные комплексообразующие свойства иона Cr2+. Эти особенности свидетельствуют о преобладающем ионном характере химической связи в соединениях Cr(II).
Так, при добавлении к растворам солей хрома(II) сульфида натрия выпадает черный осадок сульфида CrS, в присутствии ортофосфата натрия – голубой осадок среднего фосфата Cr3(PO4)2, растворимый в кислотах, а под действием карбоната натрия – серовато-белый осадок карбоната CrCO3. Во влажном воздухе он мгновенно окисляется, становясь сначала красным, а затем – грязно-зеленым, и превращается в гидроксид хрома(III):
4CrCO3 + O2 + 2xH2O = 2Cr2O3×xH2O + 4CO2
При пропускании углекислого газа карбонат переходит в раствор в форме гидрокарбоната Cr(HCO3)2.
Нитрат хрома(II) существует лишь в разбавленных растворах. Известен ортосиликат Cr2SiO4.
Высокоспиновые октаэдрические комплексы характеризуются большим магнитным моментом (4.7 – 4.9 мБ) и двумя полосами поглощения (для [Cr(H2O)6]2+ при 14000 см-1 и 9500 см-1), свидетельствующими о наличии тетрагонального искажения. Оно является следствием эффекта Яна-Теллера (раздел 1.2, том III) и вызвано наличием одного электрона на eg-орбитали, что приводит к геометрическому искажению и понижению симметрии d4-комплексов: два аксиальных лиганда находятся на большем расстоянии от атома Cr(II), чем четыре экваториальные. Такая структура обусловливает склонность высокоспиновых комплексов к гидролизу. Помимо аква-комплексов, к высокоспиновым относятся ацетилацетонат Cr(acac)2, а также аммиакаты, например, фиолетовый [Cr(NH3)5Cl]Cl и зеленовато-серый [Cr(NH3)6]Cl2, образующиеся при действии аммиака на спиртовый раствор хлорида хрома(II).
Низкоспиновые комплексы хром (II) образует с лигандами сильного поля – цианидом, дииминами. Эти комплексы интенсивно окрашены, их магнитный момент составляет 2.74-3.40 мБ, а связь Cr – лиганд характеризуется существенной долей p-связывания. Примером служит цианидный комплекс K4[Cr(CN)6], темно-синие кристаллы которого высаливаются спиртом из раствора ацетата хрома(II) в концентрированном растворе цианида калия.
В отличие от металлов начала 3d-ряда, для хрома известно несколько кластерных соединений. Простейшим из них является ацетат хрома(II) Cr2(CH3COO)4(H2O)2, выделяющийся в виде красного осадка при действии на раствор хлорида хрома(II) концентрированным раствором ацетата натрия
2CrCl2 + 4NaCH3COO + 4H2O = Cr2(CH3COO)4(H2O)2¯ + 4NaCl.
Красный цвет гидратированного ацетата Cr(II) контрастирует с голубой окраской простых солей Cr(II) и отражает его биядерное строение (рис. 5.7 а Строение ацетата хрома(II)). На наличие связи между двумя атомами хрома указывает диамагнетизм этого соединения: в нем нет неспаренных электронов. Поскольку каждый ион Cr2+ содержит четыре неспаренных электрона, то связь, образующаяся при взаимодействии двух таких ионов друг с другом, имеет кратность, равную четырем. Именно поэтому расстояние Cr – Cr в ацетате (0.230 нм) оказывается короче, чем в металлическом хроме (0.256 нм). Атомы хрома соединены друг с другом также четырьмя бидентатными мостиковыми ацетатными группами. Координационную сферу каждого атома хрома дополняет молекула воды. (Сноска: Еще короче расстояние Сr-Cr (0.196 нм) в молекулах Cr2(CH3COO)4, образующихся в газовой фазе при отщеплении молекул воды). По методу валентных связей (Рис. 5.7. б. Образование связи Cr–Cr по методу валентных связей) связь Cr-Cr с кратностью, равной четырем, образуется в результате объединения неспаренных 3d-электронов двух ионов хрома в четыре электронные пары, принадлежащие совместно обоим атомам. Вакантные орбитали ионов Cr2+ выступают в качестве акцепторов для образования пяти ковалентных связей с ацетатными группами и молекулами воды. В образующейся частице все электроны спарены, то есть она является диамагнитной.
При нагревании в вакууме до 120 °C ацетат хрома теряет воду, превращаясь в коричневый порошок, в структуре которого кластеры Cr2(CH3COO)4 связаны между собой доролнительным взаимодействием атомов хрома с атомами кислорода соседних ацетатных групп (Рис. 5.7. в. Строение безводного ацетата хрома(II))
Образование связи Cr-Cr по методу МО представлено на рис. (Рис. 5.7. г Образование связи Cr-Cr по методу молекулярных орбиталей). Для простоты рассмотрим взаимодействие двух фрагментов молекулы состава Cr(CH3COO)2, каждый из которых имеет форму плоского квадрата, что видно из соответствующего расщепления исходных d-орбиталей хрома. Из пяти d-орбиталей каждого фрагмента четыре идут на образование связи Cr-Cr, а одна – на образование s-связи с молекулой воды (это взаимодйествие на рисунке не рассматривается). Из восьми d-орбиталей, предоставленных в общее пользование двумя атомами хрома, образуются восемь МО –две из них принадлежат к σ-типу, четыре – к π, и две – к δ. Электронами заполнены четыре связывающие МО, что обусловливает образование четырехкратной связи Cr-Cr.
Аналогичную структуру имеет и ацетат молибдена(II), образующийся при действии на гексакарбонил молибдена Мо(СО)6 ледяной уксусной кислотой. Помимо ацетатов, получены также и другие карбоксилаты хрома(II) и молибдена (II). Все они являются биядерными кластерами. Интересно, что при частичной дегидратации двойной соли Cs2Cr(SO4)2×6H2O со структурой шенита образуется диамагнитный фиолетовый порошок состава Cs2Cr(SO4)2×2H2O, который, как предполагают, построен из анионов, аналогичных ацетату хрома(II), за исключением того, что роль мостиковых лигандов выполняют сульфатные группы: Cs4[Cr2(SO4)2(H2O)2]×2H2O.
Благодаря кластерному строению, ацетат хрома(II) гораздо более устойчив к окислению, чем простые соли хрома(II), и в сухом виде может некоторое время храниться на воздухе. В качестве исходного вещества используется для синтеза других соединений хрома в степени окисления +2.
Дата добавления: 2016-01-03; просмотров: 2155;
