Галогениды элементов 11-ой группы.
Устойчивость галогенидов металлов 11 группы в целом соответствует устойчивости кислородных соединений: для меди характерны дигалогениды (CuI2 не существует), для серебра – моногалогениды, для золота –- и тригалогениды (табл.7.7). Из галогенидов металлов с более высокими степенями окисления (+5, +7) известны лишь фториды.
Таблица 7.7 Галогениды металлов 11 группы*
| Степень окисления | Медь | Серебро | Золото |
| +1 | CuCl, CuBr, CuI | AgF, AgCl, AgBr, AgI | AuF, AuCl, AuBr, AuI |
| +2 | CuF2, CuCl2, CuBr2 | AgF2 | AuF2 |
| +3 | CuF3 (?) | AgF3 | AuF3, Au2Cl6, Au2Br6 |
| +5 | AuF5 | ||
| +7 | AuF7 |
* Известны также Ag+1Ag0F, Ag+2[Ag+3F4]2, Au+2[Au+3F4]2, Au+1Au+3Cl4, есть упоминание о AuF4, AuI3 и CuI1.9
Таблица. 7.8.
Свойства некоторых галогенидов меди, серебра и золота
| Галогенид | Окраска | Т. пл., °C | Структура | –lgПР |
| CuCl | бесцветный | Сфалерит | 5.92 | |
| CuBr | Бесцветный | Сфалерит | 8.28 | |
| CuI | бесцветный | Сфалерит | 11.96 | |
| AgF | Бесцветный | NaCl | Растворим | |
| AgCl | Бесцветный | NaCl | 9.75 | |
| AgBr | Бледно-желтый | NaCl | 12.28 | |
| AgI | Желтый | 560разл | Сфалерит (γ-) | 16.08 |
| AuI | Желто-коричневый | 120разл | Полимерные цепи | 22.8 |
| CuF2 | бесцветный | Рутил | Растворим | |
| CuCl2 | Темно-коричневый | Слоистая | Растворим | |
| CuBr2 | Черный | Слоистая | Растворим | |
| AgF2 | Темно-коричневый | Цепи из квадратов [AgF4] | Разлагается | |
| Au2Cl6 | Красный | 150разл | Молекулярная | Растворим |
| Au2Br6 | Красно-коричневый | 200разл | Молекулярная | Растворим |
| Au2F10 | Красно-коричневый | молекулярная | Разлагается | |
| AuF7 | желтый | 100разл | неизвестна | Разлагается |
Моногалогениды МХ получены для всех металлов группы со всеми галогенами за исключением фторидов меди(I) и золота(I), зафиксированного лишь масс-спектрометрией в газофазных продуктах разложения трифторида AuF3 (D. Schroder, J. Hrusak, I.C. Tornieporth-Oetting et al., Angew. Chem., Intern. Ed. Engl., 1994, 33, 212).
Моногалогениды меди получают восстановлением солей меди(II). Так, при пропускании сернистого газа через раствор медного купороса, содержащий хлорид, бромид или иодид натрия, выпадает белый осадок галогенида меди(I):
2CuSO4 + 2NaX + SO2 + 2H2O  2CuX¯ + 2NaHSO4 + H2SO4, X = Cl, Br, I.
2CuX¯ + 2NaHSO4 + H2SO4, X = Cl, Br, I.
Другим методом получения монохлорида явлется сопропорционирование:
N2, HCl
CuCl2 + Cu ¾¾¾® 2CuCl.
При кипячении меди в солянокислом растворе хлорида меди(II) образуется бесцветный раствор дихлорокупрата(I), при разбавлении которого водой хлорид CuCl выделяется в виде белого осадка, а при длительном хранении в склянке с притертой пробкой вырастают крупные бесцветные кристаллы.
Иодид меди(I) может быть получен при прямым взаимодействием сульфата меди с иодидом:
2CuSO4 + 4KI = 2CuI¯ + I2¯ + 2K2SO4
Для удаления иода осадок промывают ратсвором тиосульфата натрия
I2 + 2Na2S2O3 = Na2S4O6 + 2NaI
Все моногалогениды меди имеют структуру сфалерита, в которой катионы находится в тетраэдрических пустотах трехслойной плотнейшей шаровой упаковки анионов. Тетраэдрическая геометрия характерна и для многих комплексных соединений меди(I): такое расположение лигандов обеспечивает их минимальное отталкивание при отсутствии стабилизации кристаллическим полем. Все моногалогениды мало растворимы в воде, но могут быть переведены в раствор при помощи комплексообразования при замене воды на азотдонорный растворитель, например, ацетонитрил, где ионы меди входят в состав комплексных катионов [Cu(CH3CN)4]+. Введение в растворы крупных анионов – перхлората или гексафторфосфата позволяет выделить их в кристаллическом виде.
В инертной атмосфере галогениды меди(I) термически устойчивы. Так, хлорид меди CuCl, имеющий белую окраску при 178°C претерпевает фазовый переход, становясь ярко-синим, при 450°C плавится в темно-зеленую жидкость, а при 1210°C закипает, переходя в пар в виде шестичленных циклических молекул
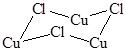 , угол CuClCu » 90°.
, угол CuClCu » 90°.
Подобно другим соединениям меди(I) моногалогениды легко окисляются кислородом воздуха, особенно быстро – во влажном виде. Так, поступающий в продажу хлорид меди(I) часто имеет желто-зеленую окраску, свойственную соединениям меди(II). Для очистки его кипятят с медными стружками в солянокислом растворе, а затем высаливают водой или кристаллизуют в инертной атмосфере.
Хлорид, бромид и иодид серебра выпадают из раствора нитрата среебра при действии на него галогенид-ионов в виде тяжелых творожистых осадков белого (хлорид), бледно-желтого (бромид) и желтого (иодид) цвета, нерастворимых в кислотах. Фторид AgF в противоположность им очень хорошо растворим в воде (180 г в 100 г воды при 25оС), что объясняется ионным характером связи Ag-F и высокой энергией гидратации маленького иона F-. В отличие от других галогенидов он способен образовывать гидраты AgF×nH2O (n = 1, 2, 4). Все галогениды серебра могут быть получены прямым синтезом из простых веществ. Препаративным методом синтеза фторида служит растворение мелкодисперного серебра в смеси плавиковой кислоты и пероксида водорода, а также растворение карбоната серебра(I) в плавиковой кислоте. При упаривании раствора вещество выделяется в виде белой слоистой кристлаллической массы, с трудом истирающейся в порошок.
Фторид, хлорид и бромид серебра кристаллизуются в структуре NaCl, иодид с аналогичной струткурой может быть получен лишь при высоком давлении. В обычных устовиях устойчива g-модификация со структурой сфалерита, аналогичной структуре галогенидов меди(I), при 136оС она переходит в b-AgI со структурой вюрцита. Эта модификация изоструктурна гексагональной модификации льда и поэтому используется для создания центров кристаллизации переохлажденных водяных паров в облаках, инициирующих выпадение дождя. Выше 146оС b-AgI превращается в объемно-центрированную кубическую α-модификацию, анионная часть решетки которой упорядочена, а катионы Ag(I) распределены статистически и обладают высокой подвижностью. Это приводит к возникновению катионной электропроводности, которая при фазовом переходе увеличивается почти в 4000 раз.
При хранении на свету хлорид, бромид и иодид серебра темнеют, так как постепенно разлагаются на простые вещества. Окислительные свойства галогенидов проявляются в реакциях с восстановителями. Так, добавление воды в сухую смесь цинковой пыли с хлоридом серебра вызывает бурную реакцию
Zn + 2AgCl = ZnCl2 + 2Ag
протекающую несмотря на низкую растворимость AgCl.
Сплавление хлорида серебра с содой и селитрой используют для регенерации серебра из остатков.:
800°C
2AgCl + Na2CO3 ¾¾¾® 2Ag + 2NaCl + CO2 + 1/2O2
По дргому способу серебро осаждают действием на хлорид щелочным раствором глюкозы или формалина:
4AgCl + CH2O + 6NaOH = 4Ag¯ + Na2CO3 + 4NaCl + 4H2O
Хлорид, бромиди иодид золота(I) в отличие от аналогичных соединенйи меди и серебра при нагревании или при взаимодействии с водой разлагаются. Все они имеют полимерную структуру с зигзагообразными цепочками, обеспечивающими линейную координацию атома золота
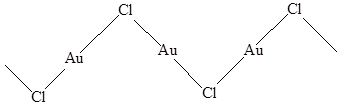
Таким образом, cвязь Au-X носит преимущественно ковалентный характер, что принципиально отличает эти вещества от моногалогенидов других элементов 11 группы.
При синтезе Au(I) и Cu(I) в качестве восстановителя применяют иодид-ион
H[AuCl4] +3KI = AuI¯ + I2 + HCl + 3KCl.
Хлорид золота, получаемый разложением карбонила Au(CO)Cl или нагреванием Au2Cl6 до 95°C в токе азота, при хранении медленно диспропорционирует:
6AuCl = 4Αu + Au2Cl6
, при 200°C разлагается на простые вещества. Он реагирует с водой
3AuCl + H2O = 2Au¯ + H[Au(OH)Cl3],
поэтому это вещество хранят в эксикаторе. Желтые кристаллы иодида AuI, образующиеся при восстановлении золотохлороводородной кислоты иодидами, более устойчивы к действию воды.
Возможность синтеза хлоридов, бромидов и иодидов всех металлов 11 группы в степени окисления +1 позволяет проследить изменение их свойств. С ростом атомных радиусов галогена и металла за счет усиления перекрывания заполненных d-орбиталей металла и вакантных π*-молекулярных орбиталей галогена увеличиваются ковалентная составляющая химической связи M–X и энергия кристаллической решетки. Это приводит к уменьшению растворимости, которая оказывается минимальной у иодида золота, обусловливая его устойчивость по отношению к воде. Увеличение ковалентности объясняет и усиление окраски в ряду AgCl – AgBr – AgI, вызванной смещением полосы переноса заряда из ультрафиолетовой в видимую область спектра.
Связь M–X ослабевает в ряду F–Cl–Br–I, и устойчивость соединений уменьшается: галогениды золота при плавлении разлагаются на простые вещества.
Отметим, что растворимость в воде галогенидов щелочных металлов, в короткопериодном варианте таблицы расположенных в одной группе с медью, серебром и золотом, уменьшается в обратном порядке, так что наименее растворимым будет LiF. Это обусловлено ионным характером связи в этих соединениях, и соответственно уменьшением энергии кулоновского взаимодействия с увеличением ионных радиусов.
Благодаря наличию заполненного d10-подуровня и возможности π-акупеторного взаимодействия с лигандами, моногалогениды переходят в раствор благодаря комплексообразованию с «мягкими» лигандами – хлоридом, бромидом, иодидом, Протекание реакций определяется значениями констант устойчивости образующихся комплексов и растворимостью галогенидов. Так как устойчивость тиосульфатных комплексов гораздо выше устойчивости аммиакатов, а растворимость галогенидов уменьшается с ростом атомного радиуса галогена, то аммиак переводит в раствор лишь хлориды и бромиды серебра и меди
MX + 2NH3×H2Oконц. = [M(NH3)2]+ + X– + 2H2O X = Cl, Br,
причем растворение бромидов происходит лишь при добавлении большого избытка аммиака.
Иодиды меди и серебра в водном растворе аммиака вообще не растворимы. Расчетом можно доказать, что, например, концентрация ионов Ag+ в насыщенном растворе AgI недостаточна для образования аммиаката [Ag(NH3)2]+, константа устойчивости которого Куст = 1.7×107. В водных растворах тиосульфата растворимы все моногалогениды меди и серебра, благодаря чему эта реакция используется в черно-белой фотографии для удаления с фотопленки остатков галогенида:
AgI + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaI, Куст([Ag(S2O3)2]3–) = 2.9×1013
Также моногалогениды переходят в раствор в концентрированных растворах галогенводородных кислот или их солей
CuCl + HCl = H[CuCl2]
AgI + KI = K[AgI2].
а также при обработке цианидами щелочных металлов
AuI + 2NaCN = Na[Au(CN)2] + NaI.
Дата добавления: 2016-01-03; просмотров: 3386;
