Оксиды элементов 11-ой группы.
Оксиды элементов 11 группы (Табл. 7.4.) в одинаковых степенях окисления имеют сходное строение. Кислотные свойства возрастают с повышением степени окисления, однако кислотно-основные реакции часто оказываются усложнены окислительно-восстановительными превращениями и образованием ацидокомплексов. В целом устойчивость связи элемент-кислород максимальна у меди и резко понижается при переходе к серебру и золоту.
Таблица 7.4.. Оксиды элементов группы меди*
| Оксид | Окраска | Т. пл., °C | Структура | Продукты взаимодействия с | |
| HCl | K2О | ||||
| Cu2O | красный | Антифлюорит | CuCl, HCuCl2 | K4Cu4O4, K3CuO2 | |
| Ag2O | темно-коричневый | 300разл. | Антифлюорит | AgCl | K4Ag4O4, K3AgO2 |
| Au2O | серо-фиолетовый | 200разл. | Антифлюорит | AuCl, HAuCl2 | K4Au4O4 |
| CuO | черный | >800разл | Искаженная PtS (квадраты CuO4) | CuCl2 | K2CuO2 |
| AgO | темно-серый | >100разл | Ag2+1Ag+3O4, квадраты Ag-O | AgCl + Cl2 | K4Ag4O4 + O2 |
| Ag3O4 | черный** | 20разл | Ag2+3Ag+2O4, квадраты AgO4 | AgCl + Cl2 | K4Ag4O4 + O2 |
| Cu2O3 | красный | 400разл | неизв | CuCl2 + Cl2 | KCuO2 |
| Ag2O3 | черный*** | разл | Сетка из квадратов МО4 | AgCl + Cl2 | K4Ag4O4 + O2 |
| Au2O3 | бурый | 155разл | AuCl3, HAuCl4 | KAuO2 |
* Известны также субоксиды меди Cu8O, Cu64O (см. выше) и смешанный оксид Cu4O3 (Cu2+1Cu2+2O3),встречающийся в природе в виде минерала парамелаконита, субоксид Ag6O2 (Beesk W., Jones P.G., Rumpel H., et al, Chem. Commun., 1981, 664), образующийся при нагревании AgO в серебряной трубке при 80°C и 4кбар, высший оксид меди CuO2 (Jensen A.F., Larsen F.K., Iversen B.B. et al, Acta Cryst. B., 1997, 53, 113).
** B. Standke, M. Jansen, Angew. Chem., Int. Ed. Engl., 1986, 25, 77
*** B. Standke, M. Jansen, Angew. Chem., Int. Ed. Engl., 1985, 24, 118
Существование низшего оксида серебра Ag6O2 со связями металл-металл внутри октаэдрических кластеров Ag64+ доказывает возможность взаимодействия двух атомов металлов с полностью заполненными d-оболочками. Это становится возможным благодаря тому, что вакантные 5s орбитали серебра имеют энегрию, близкую 4d-орбиталям, что делает возможным переходы между ними. В последние годы химия серебра в низших степенях окисления интенсивно развивается: помимо оксида были синтезированы Ag5SiO4, Ag5GeO4, Ag2F, Ag6Ge10P12, Ag13OsO6 (S. Ahlert, W. Klein, O. Jepsen et al, Angew. Chem., Intern. Ed. Engl., 2003, 42, 4322). Силикат Ag5SiO4, например, получен окислением кислородом смеси серебра и оксида кремния(IV) при 350°C и высоком давлении кислорода. Вещество также содержит октаэдрические кластеры и имеет строение [Ag6]4+(Ag+)4(SiO44–)2 (C. Linke, M. Jansen, Inorg. Chem., 1994, 33, 2614).
Оксиды М2O кристаллизуются в структуре антифлюорита, в которой атом кислорода находится в тетраэдре из четырех атомов металла, каждый из которых образует две связи М–О. Термическая устойчивость оксидов понижается вниз по группе, причем моноксиды серебра и золота разлагаются уже при слабом нагревании. Оксид золота(I) является эндотермическим соединением – энтальпия его образования больше нуля.
Для этих соединений характерны основные свойства – они взаимодействуют с соляной кислотой с образованием хлоридов, а в избытке хлорид-ионов – хлоридных комплексов:
Cu2O + HCl = H[CuCl2] + H2O.
Также они переходят в раствор и под действием других лигандов, дающих прочные комплексы с катионами, имеющих d10-конфигурацию:
Cu2O + 2NH3 + H2O = 2[Cu(NH3)2]OH,
Ag2O + 4KI + H2O = 2K[AgI2] + 2KOH
Степень окисления +1 наиболее устойчива только для серебра, поэтому растворение оксида Ag2O в кислотах-окислителях не приводит к окислительно-восстановительным превращениям. Оксид меди(I) в этих условиях диспропорционирует или окисляется до солей меди(II):
Cu2O + H2SO4разб = CuSO4 + Cu + H2O
Cu2O + 6HNO3конц = 2Cu(NO3)2 + 2NO2 + 3H2O
а оксид золота(I) превращается в ацидокомплексы золота(III).
Амфотерный характер оксидов проявляется при их сплавлении с оксидами щелочных металлов.
Оксид меди Cu2O получают восстановлением солей меди(II)
2CuSO4 + 5NaOH + C6H12O6 = Cu2O¯ + C6H11O7Na + 2Na2SO4 + 3H2O
4CuSO4 + 8NaOH + N2H4 = 2Cu2O¯ + N2 + 4Na2SO4 + 6H2O
или действием щелочи на хлоридные комплексы меди(I)
2H[CuCl2] + 4NaOH = Cu2O¯ + 4NaCl + H2O
Вещество выделяется из раствора в виде мелкодисперсного порошка желтого цвета, который ранее считали гидроксидом меди(I). Со временем, быстрее – при нагревании, частицы оксида меди(I) укрупняются, становясь оранжево-красными.
Синтез оксидов серебра(I) и золота(I) осуществляют аналогично, используя в качестве исходных веществ растворы солей серебра(I) и хлоридных комплексов золота(I). Оксиды серебра(I) и золота(I) являются более сильными восстановителями, чем оксид меди. Так, Ag2O восстанавливается водородом уже при 100°C, а пероксид водорода превращает его в серебро уже при комнатной температуре:
Ag2O + H2O2 = 2Ag¯ + H2O + O2.
Из оксидов МО наиболее устойчив оксид меди(II) CuO – черное кристаллическое вещество, которое под давлением кислорода плавится выше 1300оС.
Его получают окислением порошка меди на воздухе, разложением основного карбоната, нитрата, гидроксида
>200°C
Cu2(OH)2CO3 ¾¾® 2CuO + CO2 + H2O,
окислительным обжигом сульфида
Cu2S + 2O2 = 2CuO + SO2.
Преимущественно основный характер этого оксида проявляется в легкости растворения в кислотах
CuO + 2НCl = CuCl2 + Н2О
а слабые амфортерные свойства могут быть проиллюстрированы лишь реакциями щелочного сплавления со щелочами:
NaOH + CuO = Na2CuO2 + H2O.
В водном растворе аммиака он растворяется с образованием темно-синего аммиаката
CuO + 4NH3 + 3H2O = [Cu(NH3)4(H2O)2](OH)2.
При сильном прокаливании оксид меди(II) отдает кислород, превращаясь в оксид меди(I). Таким образом, оксид меди(II) проявляет свойства окислителя: нагретый до красного каления в смеси с органическим веществом, он окисляет содержащийся в нем углерод до углекислого газа, а водород связывает в воду – это раньше использовали в органическом анализе. Водород, углерод, угарный газ и аммиак при нагревании легко восстанавливают его до меди:
CuO + Н2 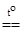 Cu + Н2О
Cu + Н2О
4CuO + 2NH3 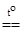 3Cu + N2 + 3H2O.
3Cu + N2 + 3H2O.
Черный осадок AgO образуется при окислении cолей серебра(I) в щелочной среде пероксодисульфатом калия или перманганатом калия, взятом в избытке
2AgNO3 + 4KOH + K2S2O8 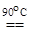 2AgO¯ + 2K2SO4 + 2KNO3 + 2H2O
2AgO¯ + 2K2SO4 + 2KNO3 + 2H2O
Димагнетизм соединения свидетельствует об отсутствии в нем ионов серебра(II). Действительно, изучение кристаллической структуры показало, что в нем присутствуют атомы серебра в двух степенях окисления +1 и +3. Таким образом, формулу вещества правильнее записывать в виде Ag+1Ag+3O2. Ионы серебра +3 находятся в центре плоских квадратов, образованных атомами кислорода, а ионы серебра +1 имеют линейную геометрию с координационным числом два. Они могут быть разделены при обработке соединения раствором периодата калия, связывающего серебро(III) в устойчивый периодатный комплекс:
4AgO + 6KOH + 4KIO4 = 2K5H2[Ag(IO6)2] + Ag2O¯ + H2O.
Интересно, что структуры оксидов CuO и AgO несмотря на различие в степенях окисления атомов металла и в свойствах имеют структуры, топологически связанные друг с другом и со стуктурой оксида палладия(II) (Рис. 7.9.Топологическая связь между кристаллическими структурами оксидов CuO, AgO, PdO).Так, поворотом каждого второго квадрата MO4 на 90° структура оксида меди(II) преобразуется в структуру AgO, так как в результате поворота два атома кислорода, занимающие вершины в квадрате MO4 оказываются настолько удаленными от атома металла, что утрачивают с ним связь – то етсь приобретают линейную координацию с координационным числом два. Путем кристаллографического сдвига из структуры CuO может быть получена структура оксида палладия(II) (N.E. Brese,M. O’Keeffe et al, Journ. Solid State Chem., 1990, 89, 184)
Благодаря присутствию ионо всеребра +3 оксид AgO является сильным окислителем:
4AgO + 4HNO3 = 4AgNO3 + O2 + 2H2O
Оксиды серебра Ag2O3 и Ag3O4 получают анодным окислением солей серебра (I), например, AgClO4. В ранней литературе приводились сообщения о синтезе темно-зеленого оксида AuO, предположительно имеющего строение аналогично оксиду серебра. В современных публикациях сведения об этом соединении отсутствуют.
Гранатово-красный Cu2O3 синтезируют окислением гидроксида меди Cu(OH)2 пероксодисульфатом K2S2O8 в щелочной среде
2Cu(OH)2 + K2S2O8 + 2KOH = Cu2O3¯ + 2K2SO4 + 3H2O.
Cu2O3 – сильный окислитель, например,
Cu2O3 + 6HCl = 2CuCl2 + Cl2 + 3H2O.
Среди оксидов в степени окисления +3 наиболее устойчив коричневый оксид золота Au2O3. Его получают осторожным обезвоживанием гидроксида золота(III) при 100оС, поскольку при более высокой температуре он разлагается:
160°C
Au2O3 ¾¾® 2Au + 3/2O2, ΔrΗ° = –19,3 кДж (Сноска: H. Tasi, E. Hu, K. Perng et al, Surface Science, 2003, 537, L447).
ДОПОЛНЕНИЕ. Диаграммы Пурбе металлов 11 группы.Относительную термодинамическую стабильность оксидов и их гидратов Cu, Ag и Au в разных степенях окисления графически удобно представить в виде диаграмм Пурбе (см. «Неорганическая химия», т. 1, стр. 67). На этих диаграммах (рис. 7.10 а, б, в Диаграммы Пубре элементов 11 группы) схематически указаны области значений рН и потенциалов Е, при которых устойчивы различные частицы. Рассмотрим построение диаграммы Е – рН для соединений меди. В реакции восстановления
Cu2+× (aq) + 2 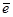 ® Cuoтв. Ео = 0.34 В
® Cuoтв. Ео = 0.34 В
не участвуют ионы Н+, поэтому ее потенциал не зависит от рН и на рис. а она представлена горизонтальной линией (линия 1). Эта линия соответствует границе сосуществования Cuтв. и Cu2+×aq. При рН ³ 5 ионы Cu2+×(aq) осаждаются в виде гидроксида Cu(OH)2,тв.
Cu2+×(aq) + 2Н2О ® Cu(OH)2 тв. + 2Н+×(aq).
Эта реакция не является окислительно-восстановительной. Она не зависит от величины Ео, поэтому представлена вертикальной линией 2, разграничивающей области существования ионов Cu2+×(aq) гидроксида Cu(OH)2,тв.: при низких значениях рН существуют ионы Cu2+× (aq), а при высоких- Cu(OH)2,тв..
При увеличении рН раствора и понижении потенциала Е в присутствии восстановителя возможно протекание окислительно-восстановительных и кислотно-основных реакций
Cu2+×(aq) + 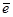 + Н2O = Cu2Oтв. + 2H+
+ Н2O = Cu2Oтв. + 2H+
2 Cu(OH)2,тв. + 2 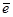 + 2Н+ = Cu2Oтв. + 3H2О
+ 2Н+ = Cu2Oтв. + 3H2О
Cu(OH)2,тв. + 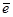 +2Н+ = 2 Cuтв.+ Н2О,
+2Н+ = 2 Cuтв.+ Н2О,
представленных линиями 3, 4 и 5, соответственно. Потенциал этих реакций, в соответствии с уравнением Нернста линейно зависит от рН, поэтому линии 3, 4 и 5 оказываются наклонными. Рис. 9.3а показывает, что в областях Е – рН, окрашенных линиями 1–2–3, 2–4, 4–5–3 и 1–5, устойчивыми оказываются Cu2+, Cu(OH)2, Cu2O и Cu, соответственно. В кислых растворах при рН < 7 в присутствии окислителей (кислород, вода и т.д.) существуют ионы Ag+ и Cu2+. При увеличении рН в зависимости от величины Е ионы Cu2+× aq осаждаются в виде гидроксида Cu(OH)2, а ионы Ag+×– в виде оксида Ag2O.. Простые аквакатионы золота в растворах не существуют. Наиболее устойчивой формой золота(III) является малорастворимый гидроксид Au(OH)3, который в сильно щелочных средах образует тетрагидроксоаурат-ионы [Au(OH)4]-.
КОНЕЦ ДОПОЛНЕНИЯ
Дата добавления: 2016-01-03; просмотров: 2511;
