Сульфиды металлов 11 группы.
Высокое сродство меди, серебра и золота к «мягким оснвоаниям», которым является сульфид-ион, обусловливает высокую устойчивость серасодержащих соединений (табл. 7.9.). Сульфиды меди и серебра могут быть получены взаимодействием простых веществ, поэтому эти вещества встречаются в виде минералов. Наиболее обширна химия сульфидов в степени окисления +1, так как в более высоких степенях окисления устойчивости соединений препятствует внутримолекулярный перенос электронов от сульфид-ионов к катионам металла, приводящий к разложению вещества.
Таблица 7.9.. Сульфиды металлов 11 группы
| Формула | Цвет | Т. пл., °C | -lgПР | Метод синтеза |
| Cu2S | Черный* | 47.6 | 2H[CuCl2] + H2S = Cu2S¯ + 4HCl 700°C 2CuS + H2 ¾¾® Cu2S + H2S | |
| Ag2S | Черный | 49.7 | 2AgNO3 + H2S = Ag2S¯ + 2HNO3 2Ag + S = Ag2S | |
| Au2S | Черно-коричневый | 240разл | 68.4 | 2K[Au(CN)2] + H2S = Au2S¯ + 2KCN + 2HCN |
| CuS | Черный | 220разл | 35.2 | CuSO4 + H2S = CuS¯ + H2SO4 |
| Au2S3 | черный | 200разл | Разл. водой | Et2O Au2Cl6 + 3H2S ¾® Au2S3¯ + 6HCl |
* в виде крупных кристаллов темно-синий
Устойчивость моносульфидов возрастает вниз по группе по мере упрочнения сыязи атома металла с серой, возможно благодаря π-дативному взаимодействию, обсужденному на примере моногалогенидоы. Интенсивная окраска соединений свидетельствует об имеющем место переносе заряда с молекулярных орбиталей, локализованных на атоме серы, на орбитали металла, который усиливается при переходе от меди к золоту, о чем свидетельствует понижение терммической устойчивости. Моносульфиды имеют сходную структуру, производную от антифлюорита, благодаря чему становится возможным образование смешанных соединений состава Ag3AuS2 и CuAg3S2, встречающихся в природе в виде минералов. Медь(I) входит также в состав халькопирита CuFeS2 – распространенного сульфидного минерала. В его структуре производной от сфалерита присутствуют тетраэдры [Cu+1S4] и [Fe+3S4], соединенные общими вершинами (Рис. 7.42 Сульфиды меди: (а) халькопирит CuFeS2 (Cu+1Fe+3S2), (б) ковеллин CuS (Cu+12Cu+2S-2(S-1)2)).
Благодаря крайне низкому значению произведения растворимости моносульфиды металлов 11 группы могут быть осаждены сероводородом не только из растворов солей, но даже из таких устойчивых комплексных соединений, как аммиакаты:
2[Ag(NH3)2]+ + 3H2S = Ag2S¯ + 4NH4+ + 2HS–
По этой же причине моносульфиды переходят в раствор лишь под действием концентрированного раствора цианида калия
Ag2S + 4KCN = 2K[Ag(CN)2] + K2S
или горячей азотной кислоты
3Ag2S + 8HNO3 (30%) = 6AgNO3 + 2NO + 3S¯ + 4H2O
Медленно реагируют они и с сульфидом и полисульфидом аммония, образуя тиосоли (например, NH4Cu7S4, NH4+Cu+(S4)2- , Burschka C., Z. Naturforsch. B., 1980, 35, 1511), которые обычно получают сплавлением с сульфидами щелочных металлов (Na4Cu2S3, Na3Cu4S4, Na3AgS2, KAg5S3, KAuS).
Из сульфидов, содержащих атом металла в степени окисления +2, известен лишь черный CuS, образующийся наряду с Cu2S при взаимодействии меди с серой. Для увеличения выхода CuS образовавшйися черный порошок тщательно растирают в шаровой мельнице с серой в течение нескольких часов. Изучение кристаллической структуры этого вещества обнаружило в нем атомы меди двух типов (Cu+1 в центре треугольников и Cu+2 в центре тетраэдров из атомов серы) и дисульфидные группы наряду с сульфидными (рис. 7.42 б). Таким образом, формулу вещества правильнее записывать в виде Cu+12Cu+2S-2(S-1)2. При нагревании вещество первращается в сульфид меди(I).
Подобно низшему сульфиду CuS не реагирует с разбавленной серной кислотой и раствором гироксида натрия, но растворяется в азотной кислоте, растворах цианида калия и сульфида аммония.
Сульфид золота(III) подобно другим соединениям золота в степени окисления +3 является сильным окислителем. Его синтез проводят в эфире, так как попытки выделения его в водном растворе приводят к восстановлению до металлического золота. В водном растворе цианидов он превращается в дицианоаурат(I):
Au2S3 + 4KCN = 2K[Au(CN)2] + K2S3
Хотя для сульфида золота(III) (структура его неизвестна) можно было бы предсказать кислотные свойства, тиоаураты(III) получить не удается окисления золотом(III) сульфид-ионов.
Вопросы и задания.
1. Как можно объяснить химическую инертность серебра, золота и платиновых металлов?
Химическое рафинирование серебра заключается в растворении черневого серебра в азотной кислоте, кристаллизации нитрата серебра, переводе его в аммиачный комплекс, и восстановлении его сульфитом аммония до металла. На каких стадиях происходит очистка серебра от примесей свинца и цинка? Напишите уравнения реакций.
Как изменяется устойчивость галогенидных комплексов железа(III) и меди(II) в ряду F-Cl-Br-I? Ответ поясните.
Роданид меди(I) образуется при взаимодействии растворов роданид акалия, сульфита калия и сульфата меди(II). Запишите уравнения реакций. Изобразите строение комплексных ионов, образующихся при растворении роданида меди(I) в избытке роданида калия, зная, что роданид-ион выступает в роли монодентатного лиганда.
Предложите способ выделения угарного газа из синтез-газа.
Объясните, почему константы образования ионов [Cu(en)(H2O)4]2+, [Cu(en)2(H2O)2]2+ и [Cu(en)3]2+ изменяются немонотонно: K1 < K2 >> K3?
Используя значения произведений растворимости и констант устойчивости, оцените константы равновесия
AgIтв. + 2L = [AgL2]+ + I-р-р
для L = NH3; CN- и 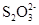 .
.
Какие процессы происходят при изготовлении серебряных зеркал?
Растворится ли серебро в 1М растворе цианида калия в присутствии кислорода, если для полуреакции Ag+ + 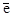 ¾® Agо Ео = 0.80 В, Куст. ([Ag(CN)2]-) = 7×1019, а для полуреакции O2 + 4H+ + 4
¾® Agо Ео = 0.80 В, Куст. ([Ag(CN)2]-) = 7×1019, а для полуреакции O2 + 4H+ + 4 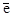 = 2H2O Ео = 1.23 В?
= 2H2O Ео = 1.23 В?
Дата добавления: 2016-01-03; просмотров: 1842;
