Аммиак. Соли аммония. Амиды металлов
Азот образует с водородом несколько соединений, из которых важнейшим является аммиак. Аммиак — одно из соединений, важность которого для неорганической и органической химии чрезвычайно велика. Подавляющая часть азотсодержащих соединений получается при участии аммиака. Благодаря способности отдельных видов бактерий и, вероятно, растений превращать азот воздуха в аммиак, на Земле появилась существующая форма жизни.
Электронная формула молекулы аммиака такова:
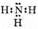
Из четырех электронных пар при азоте три общие (связывающие) и одна неподеленная (несвязывающая).
В образовании молекулы NH3 участвуют три неспаренных р-электрона атома азота, электронные орбитали которых вза-
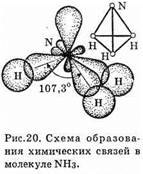
имно перпендикулярны, и 1s-электроны трех атомов водорода. Связи располагаются вдоль трех осей р-орбиталей (см. рис. 20).
Молекула имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, в вершине пирамиды — атом азота. Угол между связями ÐH—N—H=107,3°.
Химическая связь N—Н полярная: положительный заряд сосредоточен на атоме азота. Вследствие этого между молекулами аммиака образуется водородная связь, что можно изобразить так:
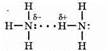
Благодаря водородным связям аммиак имеет сравнительно высокие температуры плавления и кипения, а также высокую теплоту испарения, он легко сжижается.
Получение
1. В промышленности аммиак получают прямым синтезом из азота и водорода:
Для протекания реакции наиболее оптимальными условиями являются наличие катализатора, температуры 500°С и давления 2,9•104 кПа.
Реакция экзотермична, поэтому согласно принципу Ле Шателье равновесие будет смещено вправо тем больше, чем ниже температура. Однако при низких температурах теряет активность катализатор и скорость реакции очень мала. В качестве катализатора используется пористое железо, содержащее в виде добавок оксиды алюминия, калия, кальция, кремния. Реакцию ведут при температуре около 500°С, компенсируя вызываемый сдвиг равновесия влево повышением давления.
Промышленные установки синтеза аммиака работают с использованием принципа циркуляции: после реакции смесь газов охлаждается, содержащийся в ней аммиак конденсируется и отделяется, а непрореагировавшие азот и водород смешиваются со свежей порцией газов, снова подаются в колонну синтеза и т.д.
Удаление аммиака из равновесной смеси сдвигает равновесие реакции вправо.
2. В лабораторных условиях аммиак получают нагреванием солей аммония с щелочами:
2NH4Cl+Са(ОН)2=СаСl2+2NH3+2Н2O
Эта реакция основана на смещении равновесия взаимодействия аммиака с водой при добавлении гидроксид-ионов:
NH+4+ОН-=NH3+Н2О
Дата добавления: 2016-01-03; просмотров: 2427;
