Атомное строение металлов и сплавов 1 страница
В твердом состоянии все металлы и металлические сплавы обладают кристаллическим строением со строго определенным расположением атомов.
Кристаллические тела состоят из множества мелких зерен – кристаллитов, внутри которых атомы расположены закономерно, образуя в пространстве правильную кристаллическую решетку. В идеальной кристаллической решетке атомы находятся на определенных расстояниях друг от друга и располагаются в определенных местах, такое упорядоченное расположение атомов отличает кристаллическое тело от аморфного.
1.1 Типы кристаллических решеток
Пространственная кристаллическая решетка любого металла слагается из множества сопряженных друг с другом элементарных ячеек, внутри которых в известном порядке размещаются отдельные атомы. Существует несколько основных типов кристаллических решеток. На рисунке 1.1представлена пространственная кристаллическая решетка и элементарная ячейка простой кубической решетки металла.
Элементарная ячейка простой кубической решетки состоит из восьми атомов, расположенных в вершинах куба. Расстояние а между центрами соседних атомов, расположенных в узлах ячейки, называют периодом решетки, и измеряют в ангстремах (1Å = 10 -8 см) или килоиксах (1 кх = 1,00202·10-8 см).
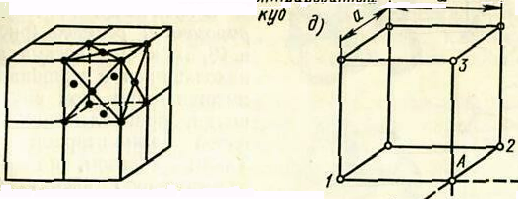
Рисунок 1.1 - Пространственная кристаллическая решетка и элементарная ячейка простой кубической решетки металла
Каждый атом в вершине куба принадлежит одновременно восьми ячейкам, т.е. на каждую ячейку в этой вершине приходится 1/8 атома. На всю ячейку в целом (8 вершин) приходится, таким образом, 1 атом. Кубическая кристаллическая решетка сокращенно обозначается индексом К6.
В кубической объемноцентрированной решетке, рисунок 1.2, а, кроме восьми атомов, находящихся в вершинах куба, имеется один атом внутри решетки, принадлежащий только одной элементарной ячейке. Таким образом, на каждую элементарную ячейку приходится два атома. Эта решетка обозначается К8. Базисом кристаллической решетки называют число атомов, приходящихся на одну элементарную ячейку. Базис характеризует плотность решетки, т.к. кроме объема, занимаемого атомами, остается еще свободное пространство.
Коэффициентом компактности называется отношение объема, занимаемого атомами, ко всему объему решетки. Чем больше коэффициент компактности, тем больше плотность элементарной ячейки.
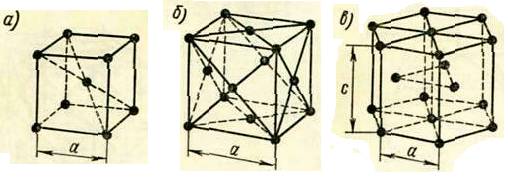
а – объемноцентрированная кубическая
б – гранецентрированная кубическая
в – гексагональная
Рисунок 1.2 – Основные виды элементарных ячеек кристаллических решеток
В кубической гранецентрированной решетке К12, рисунок 1.2, б, число атомов равно четырем: 1/8·8=1атом от числа атомов, расположенных в вершинах куба и плюс 1/2·6=3 атома от числа атомов, расположенных в центре граней куба.
Взаимную связь атомов друг с другом характеризует координационное число. Под координационным числом понимают число атомов-соседей, находящихся на равном и наиболее близком расстоянии от избранного атома. Так, в простой кубической решетке на таких расстояниях находятся 6 соседних атомов. Чем больше координационное число, тем больше плотность упаковки атомов.
Гексагональная кристаллическая решетка – рисунок 1.2, в.
Число атомов в различных сечениях пространственной кристаллической решетки неодинаково, вследствие этого механические, электрические и др. свойства кристаллических тел в разных направлениях будут различными – это явление называют анизотропией. Например, предел прочности монокристалла чистой меди в различных направлениях изменяется от 140 до 360 МПа, а относительное удлинение от 10% до 50%.
ЛЕКЦИЯ 2
Тема лекции – Металловедение
План лекции:
- аллотропические превращения в металлах;
- процессы плавления и кристаллизации металлов.
2.1 Аллотропические превращения в металлах
Некоторые металлы (железо, олово, титан, цирконий, кобальт и др.) способны испытывать превращения в твердом состоянии при изменении температуры, т. е. подвергаться так называемой вторичной кристаллизации. Существование одного и того же металла в нескольких кристаллических формах с различным расположением атомов в элементарной ячейке решетки называется аллотропией, а процесс изменения кристаллической решетки — аллотропическим, или полиморфным превращением. Аллотропические формы металла называют модификациями и обозначают начальными буквами греческого алфавита (α, β, γ, δ и т.д.). Модификацию, устойчивую при низких температурах, обозначают буквой α, при более высоких — β, следующие (по температурной шкале) модификации — γ, δ и т.д.
При вторичной кристаллизации происходит перестройка кристаллической решетки из кристаллов прежней формации и образование новых кристаллов.
Железо может существовать в различных модификациях. Аллотропические превращения железа можно проследить по кривым охлаждения и нагревания, рисунок 2.1.
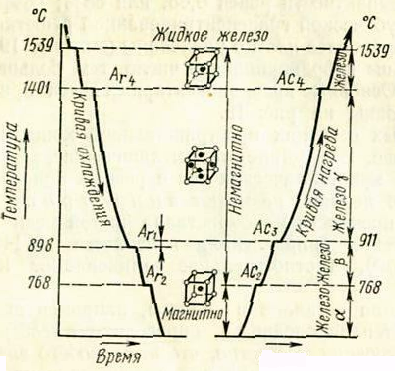
Рисунок 2.1 – Кривые охлаждения и нагревания железа
На кривой охлаждения при температуре 1539°С появляется первая горизонтальная площадка (остановка), отмечающая переход железа из жидкого состояния (ж) втвердое Feδ с выделением значительного количества тепла. Образующиеся кристаллы Feδ имеют кубическую объемноцентрированную кристаллическую решетку со стороной а = 2,93Å.
Вторая остановка наблюдается при 1401°С (точка А4). При этом Feδ переходит в Feγ с более плотной кубической гранецентрированной кристаллической решеткой. Третья остановка происходит при 898°С (точка Аr3, на рисунке 2.1), во время которой Feγ переходит в Feβ и имеет кубическую объемноцентрированную кристаллическую решетку.
Последняя остановка наблюдается при 768°С (точка А2), что соответствует переходу из состояния Feβ в Feα без изменения кристаллической решетки.
Выделение тепла при переходе Feβ в Feα связано с внутриатомными изменениями, в результате которых у Feα появляются резко выраженные магнитные свойства. Таким образом, фактически имеются две модификации железа с разными кристаллическими решетками.
Превращения, происходящие при нагревании железа, сопровождаются поглощением тепла. Остановки чаще всего происходят при тех же или несколько более высоких температурах, чем при охлаждении. Критические температуры, при которых происходят аллотропические превращения железа, обозначаются А с соответствующими индексами (при нагревании применяют индекс с с цифрой, при охлаждении — r с цифрой).
Реальная кристаллическая решетка отличается от идеальной схемы, приведенной на рисунке 2.1, наличием кристаллических несовершенств.
2.2 Процессы плавления и кристаллизации металлов
Любое вещество может находиться в четырех агрегатных состояниях: твердом, жидком, газообразном и плазменном.
Плазма – частично или полностью ионизированный газ, в котором плотности положительных и отрицательных зарядов практически одинаковы. При достаточно сильном нагревании любое вещество испаряется, превращаясь в газ. Если увеличивать температуру и дальше, резко усилится процесс термической ионизации, т.е. молекулы газа начнут распадаться на составляющие их атомы, которые затем превращаются в ионы.
Переходы из одного агрегатного состояния в другое называют фазовыми превращениями; для чистых кристаллических тел они происходят при строго определенных температурах.
Кристаллизацией называют процесс образования кристаллов из жидкой или газообразной фазы. Форма, величина, а также ориентировка кристаллов влияют на все свойства металлов и сплавов.
На рисунке 2.2 показана кривая охлаждения жидкого металла до комнатной температуры при медленном отводе тепла (малая скорость охлаждения).
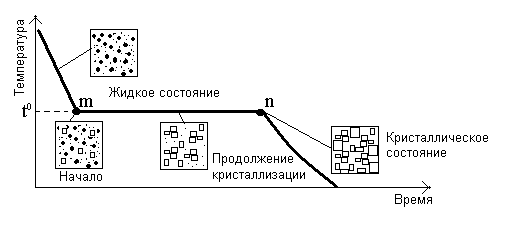
Рисунок 2.2 – Кривые охлаждения жидкого металла
В точке m при температуре t0 в расплаве возникают первые центры кристаллизации металла, число которых увеличивается по мере отвода тепла. При этом ранее возникшие кристаллы растут. До тех пор пока весь жидкий металл не затвердеет (в точке n), температура остается постоянной. Этот процесс сопровождается выделением скрытой теплоты плавления. На кривой охлаждения образуется горизонтальный участок, показывающий, что затвердевание металла из расплава происходит при строго постоянной температуре. После затвердевания металла наблюдается плавное понижение его температуры. Температуру, при которой металл переходит из жидкого состояния в твердое, называют температурой первичной кристаллизации. Температура кристаллизации (а следовательно, и плавления) различных металлов находится в широких пределах – от минус 38,9оС (Hg) до плюс 3410оС (W). Кроме первичной кристаллизации возможна вторичная – изменение кристаллического строения металла в твердом состоянии.
При быстром отводе тепла некоторые металлы способны переохлаждаться, т.е. находиться некоторое время в жидком состоянии при температуре ниже температуры первичной кристаллизации. Это происходит потому, что в результате быстрого отвода тепла в расплаве образуется большое количество центров кристаллизации и происходит интенсивный их рост. Это приводит к выделению значительного количества тепла, способного некоторое время поддерживать металл в жидком состоянии и даже повышать его температуру вплоть до обычной температуры затвердевания.
Разность между теоретической tт и фактической tф температурами кристаллизации называют степенью переохлаждения Δt = tт - tф.
ЛЕКЦИЯ 3
Тема лекции – Металловедение
План лекции:
- понятие о теории дислокации;
- металлические сплавы.
3.1 Понятие о теории дислокации
Все реальные кристаллические твердые тела (в частности, металлы) имеют большее или меньшее количество дефектов кристаллической структуры, оказывающих влияние на макроскопические свойства твердых тел.
Такими дефектами являются:
- точечные дефекты – вакансии (узлы кристаллических решеток, незаполненные атомами), межузельные атомы;
- одномерные (линейные) дефекты – дислокации;
- двумерные (поверхностные) дефекты – границы зерен и двойников, дефекты упаковки и др.
Дислокациями называют линейные несовершенства или одномерные дефекты кристаллических решеток реальных металлов, представляющие собой особые нарушения кристаллического строения, связанные с отклонениями реальных кристаллов от идеального их строения.
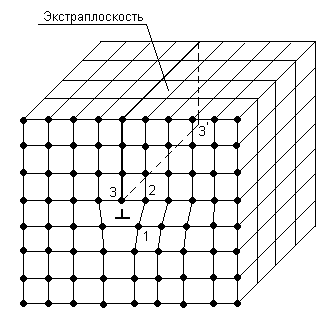
Рисунок 3.1 – Дислокация в кристаллической решетке
(3 – 3' линейная краевая дислокация)
Дислокации бывают краевые, винтовые и смешанные криволинейные. Возникают они в металлах в процессе кристаллизации, пластической деформации и по другим причинам, вызывающим создание полей напряжений в кристаллической решетке, приводящих к соответствующим локальным деформациям и смещениям, рисунок 3.1.
Экстраплоскость – это лишняя полуплоскость атомов. Если такая дислокация находится вверху, то ее считают положительной и обозначают ┬, если внизу – отрицательной, и обозначают ┴.
Такая дислокация простирается на многие тысячи периодов решетки, ее линия не может быть прямой, она стремится замкнуться в контур. Вокруг дислокации возникает зона упругого искажения решетки.
Вследствие искажения решетки в районе дислокации последняя легко может смещаться вправо или влево от нейтрального положения и устанавливать связь краевых своих атомов 3 с атомами 1, а соседняя справа (слева) полуплоскость будет при этом переходить в промежуточное положение, превращаясь тем самым в экстраплоскость и образуя дислокацию вдоль краевых атомов 2 и т.д. Таким образом, дислокация может перемещаться (вернее – передаваться как эстафета) вдоль некоторой плоскости скольжения, расположенной перпендикулярно к эстраплоскости. Дислокации в металлах можно наблюдать с помощью электронного микроскопа.
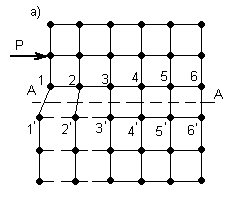
Теоретически, при элементарном пластическом сдвиге, рисунок 3.2, а, если учесть силы межатомного взаимодействия для каждой пары сопряженных атомов (относительно плоскости скольжения А-А) 1 - 1', 2 - 2' и т.д. и учитывая, что в плоскости скольжения реального металлического кристалла имеется около 1014 атомов на каждый см2 сечения, требуется чрезвычайно большое усилие (для технического железа).
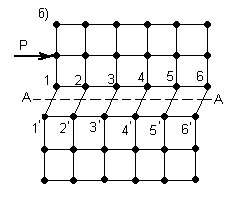
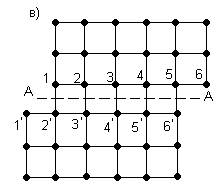
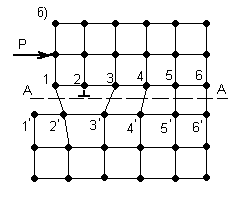
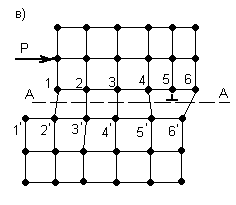
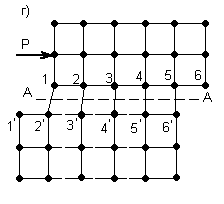
Согласно дислокационной теории пластический сдвиг в металле следует рассматривать как процесс эстафетного перемещения дислокаций. Упрощенная схема этого процесса представлена на рисунке 3.3.
В результате наличия дислокации, рисунок 3.3, а, в кристалле по обе стороны скольжения А-А возникает искаженное состояние кристаллической решетки с нарушением порядка идеальных связей между атомами.
В этом случае достаточно приложить небольшое усилие Р (значительно меньше силы Р для идеальной решетки, рисунок 3.3, б), чтобы вызвать распространение волны последовательных смещений вертикальных рядов атомов над плоскостью скольжения А-А, не превосходящих по величине одного межатомного расстояния. В результате прохождения этой волны дислокация, как своеобразная эстафета, будет последовательно передаваться рядам атомов 3, 4 … и в некоторый момент займет положение, представленное на рисунке 3.3, в. В итоге же передачи движения от частного смещения ряда атомов 1 дислокация выйдет на поверхность и исчезнет, как это показано на рисунке 3.3, г.
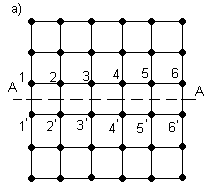
а, б, в – фазы сдвига
Рисунок 3.2 – Пластический сдвиг в идеальной кристаллической решетке
а, б, в, г – фазы сдвига
Рисунок 3.3 – Дислокационная схема пластического сдвига
Вывод – процесс сдвига в кристалле происходит тем легче, чем больше дислокаций имеется в металле. Наоборот, чем меньше в металле таких дислокаций, тем меньше возможностей для сдвига и тем прочнее металл. В металле, в котором не образуются дислокации, сдвиг возможен только за счет одновременного смещения (как целого) одной части кристалла относительно другой.
В этом случае прочность бездислокационного металла должна быть равна теоретической (точка 1 на рисунке 3.4).
Прочность нитевидных металлических кристаллов – так называемых «усов» (точка 2, рисунок 3.4) – оказалась ближе к теоретической, что, согласно, предположениям, обусловлено весьма малым количеством дислокаций.
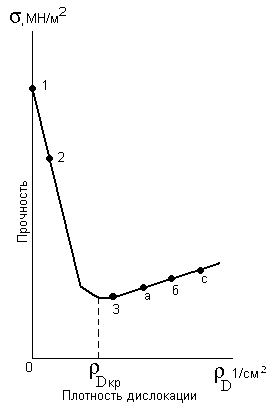
1 – теоретическая прочность
2 – прочность монокристальных нитей
3 – практическая прочность
а – закаленной стали
б – стали после термомеханической обработки
с – мартенситостареющие стали
Рисунок 3.4 – Зависимость прочности от плотности дислокаций
Кроме получения бездислокационных металлических кристаллов существует другой путь упрочнения металлов. Оказывается, что реальная прочность металлов падает с увеличением числа дислокаций только вначале. Достигнув минимального значения при некоторой критической плотности дислокаций ρDкр, рисунок 3.4, реальная прочность вновь начинает возрастать. Это объясняется тем, что возникают не только параллельные друг другу дислокации, но и дислокации в различных плоскостях и направлениях. Такие дислокации будут мешать друг другу перемещаться, т.е. в процесс пластической деформации будут вовлекаться одновременно все большее число атомов, и реальная прочность металла повысится.
Традиционными способами упрочнения металлов, ведущими к увеличению плотности дислокаций, являются механический наклеп, и термообработка. Легирование (например, внесение в решетку основного металла чужеродных атомов), создающее несовершенства и искажения кристаллической решетки, препятствует свободному перемещению дислокаций.
Однако во всех этих случаях упрочнение далеко не достигает теоретического значения. Следовательно, наличие дислокаций в реальном металлическом кристалле является причиной понижения его прочности.
3.2 Металлические сплавы
Металлическими сплавами называют сложные по составу вещества, образовавшиеся в результате взаимодействия двух или нескольких металлов либо металлов с некоторыми неметаллами.
Химические элементы или их устойчивые соединения, образующие сплав, принято называть компонентами. Сплавы могут состоять из двух, трех и более компонентов.
Металлические сплавы в жидком состоянии, как правило, однородны, представляют одну фазу. В некоторых случаях металлы в жидком состоянии взаимно нерастворимы и образуют отдельные слои (например, свинец и железо, свинец и цинк). Однако полная нерастворимость металлов в жидком состоянии – редкое явление; чаще встречается ограниченная растворимость.
Фазой называют однородную часть неоднородной системы, отделенную от других ее частей поверхностями раздела. При переходе сплавов из жидкого состояния в твердое в них может образоваться несколько фаз. После затвердевания, в зависимости от природы компонентов, сплавы могут состоять из одной, двух и более твердых фаз. Могут образовываться твердые растворы, химические соединения и механические смеси, состоящие из двух или нескольких фаз.
Твердыми растворами называют сплавы (из двух или более компонентов), в которых атомы растворимого компонента располагаются в кристаллической решетке компонента растворителя. При образовании твердого раствора растворителем называют тот металл, кристаллическая решетка которого сохраняется как основа. Если оба металла обладают одинаковыми по типу кристаллическими решетками и вследствие этого неограниченной взаимной растворимостью в твердом состоянии, то растворителем является тот из них, концентрация которого в сплаве превышает 50%.
Различают три типа твердых растворов: замещения, внедрения, вычитания (встречаются сравнительно редко).
Твердый раствор замещения образуется путем замены части атомов растворителя в его кристаллической решетке атомами растворяемого компонента, рисунок 3.5.
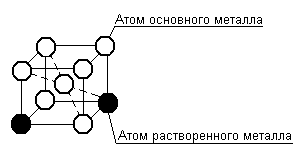
Рисунок 3.5 – Схема образования твердых растворов замещения
Твердые растворы внедрения образуются путем размещения атомов растворенного компонента в свободных промежутках между атомами кристаллической решетки растворителя, рисунок 3.6.
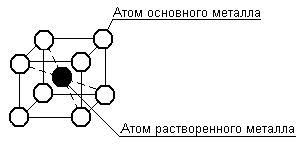
Рисунок 3.6 - Схема образования твердых растворов внедрения
Химические соединения образуются при строго определенном количественном соотношении компонентов сплава и характеризуются кристаллической решеткой, отличной от решеток исходных компонентов. Химические соединения, как правило, обладают характерными физико-механическими свойствами: высокой твердостью, повышенной хрупкостью, высоким электросопротивлением.
Химические соединения в сплавах образуются между металлами (интерметаллические соединения), а также между металлами и неметаллами. Некоторые соединения металлов с неметаллами (карбиды, нитриды, оксиды, фосфиды и др.) получили в технике самостоятельное применение.
Механические смеси образуются при одновременном выпадении из жидкого расплава при его охлаждении кристаллов составляющих его компонентов (эвтектические смеси). В кристаллах, которые входят в состав механической смеси, сохраняется кристаллическая решетка исходных компонентов сплава. Механические смеси могут состоять из чистых компонентов, твердых растворов, химических соединений.
ЛЕКЦИЯ 4
Тема лекции – Металловедение
План лекции:
- основные типы диаграмм состояния двойных сплавов.
4.1 Основные типы диаграмм состояния двойных сплавов
Диаграммы состояния металлических сплавов представляют обобщенные результаты изучения хода затвердевания и структурно-фазовых превращений в выбранных системах. Эти диаграммы позволяют определить температуры начала и конца затвердевания сплавов, их структуру для различных температур и превращения, которые сплавы претерпевают при охлаждении и нагревании.
При построении диаграмм состояния сплавов по оси абсцисс откладывают концентрацию каждого компонента (от 0 до 100%), по оси ординат – температуру. Каждому составу сплава при определенной температуре отвечает определенная точка на диаграмме.
При термическом анализе определяют температуру начала и конца затвердевания сплавов при переходе их из жидкого состояния в твердое, а также температуру всех превращений, происходящих в сплаве в твердом состоянии. Для термического анализа приготовляют ряд сплавов с постепенно изменяющимся содержанием одного из компонентов сплава (например, 10, 20, 30, 40% и т.д.). Серию таких сплавов нагревают и расплавляют, а затем медленно и равномерно охлаждают. Отмечают температуру сплава. На основании полученных данных строят серию кривых охлаждения и нагревания в координатах температура – время, характерные точки которых переносят на диаграмму состояния.
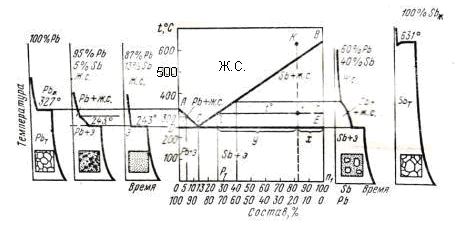
Ж.С. – жидкий сплав
Э - эвтектика
Рисунок 4.1 – Диаграмма состояния Pb – Sb и микроструктуры свинцово-сурьмястых сплавов
Для примера построим диаграмму состояния сплавов системы Pb – Sb, рисунок 4.1. Температуры начала и конца затвердевания сплавов этой системы (при медленном охлаждении) приведены в таблице 4.1.
Таблица 4.1 – Температуры затвердевания сплавов системы Pb – Sb
| Сплавы | Содержание компонентов (вес), % | Температура затвердевания ºС | ||
| Sb | Pb | начало | конец | |
| - | ||||
Кривые охлаждения свинца и сурьмы, рисунок 4.1, имеют только по одной горизонтальной площадке, соответствующей температуре их затвердевания. На каждой из кривых охлаждения сплавов имеется перегиб или площадка при температурах, фиксирующих начало и конец затвердевания. Верхние точки, при которых начинается затвердевание рассматриваемых сплавов, существенно отличаются друг от друга по температуре. Нижняя критическая температура затвердевания для всех сплавов свинца и сурьмы одинакова – она равна 243ºС.
Перенося точки начала и конца затвердевания кривых охлаждения всей серии сплавов на график состав сплава – температура, получим диаграмму состояния системы Pb – Sb.
Выше линии АС и СВ сплавы любого состава находятся в жидком состояния. Эти линии фиксируют начало затвердевания сплавов, их называют линиями ликвидуса (ликвидус – жидкий). Прямая линия DCE соответствует концу затвердевания сплавов и называется линией солидуса (солидус – твердый). Ниже этой линии сплавы любого состава находятся в твердом состоянии. Между линиями ликвидус и солидус сплавы состоят из двух фаз: жидкой и твердой. На линии АС начинается кристаллизация чистого свинца из сплавов, содержащих менее 13% сурьмы. На линии ВС – кристаллизация чистой сурьмы из сплавов, содержащих более 13% сурьмы. В точке С, отвечающей сплаву с 13% Sb и 87% Pb при температуре 243ºС, происходит одновременная кристаллизация обоих компонентов сплава с образованием тонкой механической смеси. Полученную после затвердевания структуру сплава называют эвтектикой (на рисунке 4.1 обозначена буквой С), а сплав, соответствующий точке С, называется эвтектическим сплавом. Он обладает самой низкой температурой плавления по сравнению с остальными сплавами. Сплавы, состав которых находится на диаграмме левее точки С, называются доэвтектическими, а правее – заэвтектическими.
Доэвтектический сплав выше линии АС находится в жидком состоянии. При охлаждении ниже линии АС из сплава начинают выпадать кристаллы чистого свинца, обладающего более высокой температурой затвердевания, чем остающаяся жидкая часть сплава, постепенно обогащающаяся сурьмой. Выделение кристаллов чистого свинца из жидкой фазы будет продолжаться вплоть до температуры 243ºС, т.е. до линии эвтектики DCE. При этой температуре оставшаяся часть жидкой фазы содержит 13% Sb, и она затвердевает с образованием эвтектики.
При охлаждении заэвтектических сплавов ниже линии ВС из жидкого сплава начинают выпадать кристаллы чистой сурьмы, обладающие более высокой температурой затвердевания, чем остающаяся жидкая часть сплава; поэтому последняя обедняется сурьмой, и ее состав начинает приближаться к эвтектическому. При температуре соответствующей линии DCE (243ºС), эта часть сплава будет содержать 13% Sb и по мере дальнейшего понижения температуры затвердеет с образованием эвтектической смеси. Таким образом, заэвтектические сплавы затвердевают аналогично доэвтектическим сплавам с той разницей, что ниже линии ликвидуса из жидкости выделяется не свинец, а сурьма.
Рассмотренная диаграмма относится к первому типу диаграммы состояния и характеризуется тем, что компоненты неограниченно растворимы в жидком состоянии, совершенно нерастворимы в твердом состоянии и образуют механическую смесь своих кристаллов.
ЛЕКЦИЯ 5
Тема лекции – Металловедение
План лекции:
- железоуглеродистые сплавы;
- диаграмма состояния железоуглеродистых сплавов.
5.1 Железоуглеродистые сплавы
Железо – металл серебристо-серого цвета, четвертого периода, восьмой группы таблицы Д.И. Менделеева, обладающий очень высокой пластичностью. Чистое железо содержит не более 0,01% примесей и является очень дорогим металлом. На практике применяют техническое железо, содержащее до 0,01% в сумме примесей (С, Mn, Si, S, P и др.).
Механические свойства железа в зависимости от степени его чистоты и величины зерен изменяются в следующих пределах:
- твердость по Бринеллю НВ 580-800 МН/м2(МПа);
- предел прочности при растяжении 180-280 МН/м2(МПа);
- удлинение 30-50 %;
- сжатие 70-80 %;
- ударная вязкость 16-20 МДж/м2.
В промышленности применяют сплавы железа с углеродом, кремнием, марганцем, хромом, никелем и другими элементами. Если в сплаве железа содержится до 2% углерода, его называют сталью, если более 2% углерода – чугуном.
Углерод – неметаллический элемент второго периода, четвертой группы, имеет три аллотропические модификации: уголь, графит и алмаз. Графит имеет незначительную прочность и слабо выраженные металлические свойства.
Структурные составляющие железоуглеродистых сплавов можно рассмотреть под микроскопом на полированном и травленном шлифе.
Феррит (Ф) – твердый раствор внедрения углерода в α-железо. Он мягкий (НВ 65-130), пластичный (40%), сильно магнитен, хорошо проводит тепло и электричество.
Дата добавления: 2016-02-04; просмотров: 5770;
