Расчеты
1. Определите разность температур ∆Т3 = Т1у – Т1.
2. Согласно выражению (2.97), рассчитайте тепловой эффект 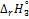 для реакции нейтрализации (2.95), по справочным данным (см. опыт 1) для теплот образования.
для реакции нейтрализации (2.95), по справочным данным (см. опыт 1) для теплот образования.
3. Вычислите теплоемкость системы
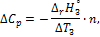
где n – количество образовавшейся воды, моль.
4. Определите разность температур ∆Т4 =Т2у –Т2.
5. Рассчитайте тепловой эффект 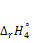 при Т2:
при Т2:
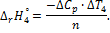
6. Вычислите суммарный тепловой эффект процессов диссоциации молекул и гидратации ионов уксусной кислоты:
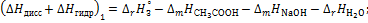
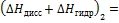
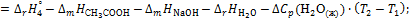
где 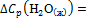 75,31 Дж/(моль·К); промежуточные теплоты разбавления кислоты и основания рассчитайте на основании справочных данных для интегральных теплот растворения (см. опыт 1).
75,31 Дж/(моль·К); промежуточные теплоты разбавления кислоты и основания рассчитайте на основании справочных данных для интегральных теплот растворения (см. опыт 1).
Объясните причину изменения величины теплового эффекта процесса нейтрализации слабой кислоты с увеличением температуры.
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
1. Объясните постоянство теплот нейтрализации различных сильных кислот и оснований.
2. Приведите несколько формулировок второго закона термодинамики (наиболее общую, подходящую для химических процессов), напишите его математическое выражение.
3. Изобразите схематически график (в координатах S – Т) изменения энтропии для перехода воды из твёрдого в жидкое и газообразное состояния.
4. В каком из следующих процессов (изотермическом, изобарическом, изохорическом, адиабатическом) при их обратимом изменении не происходит изменение энтропии системы? Почему?
5. Какие параметры системы необходимо поддерживать постоянными, чтобы по знаку ΔS можно было бы судить о направлении самопроизвольного процесса?
6. Как выражается энтропия системы в целом, если, она состоит из трёх частей, характеризующихся, соответственно, энтропиями Sl, S2 и S3?
7. Расположите этилен, ацетилен и этан в порядке понижения энтропии (при одинаковых условиях).
8. Объясните (на основании второго закона термодинамики), почему самопроизвольное протекание реакции возможно при ΔG < 0 (а не при ΔG > 0 и ΔG = 0).
9. Жидкость превращается в пар при определённых температуре и давлении. Каково соотношение между ΔG и ΔF для этого процесса?
Дата добавления: 2015-09-29; просмотров: 1529;
