Расчет изменения энергии Гиббса и Гельмгольца для различных процессов
1) Изменение энергий Гиббса и Гельмгольца при изменении температуры
Температурная зависимость энергий Гиббса и Гельмгольца от температуры определяется соотношениями:
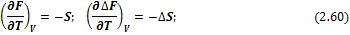
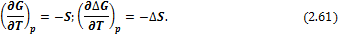
И в интегральной форме:
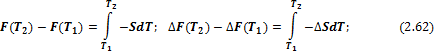
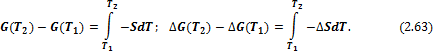
2) Изменение энергий Гиббса и Гельмгольца при изотермическом расширении или сжатии
Изменения энергий Гиббса и Гельмгольца при сжатии или расширении, когда Т = const, выражаются в дифференциальной форме уравнениями:
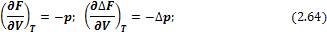
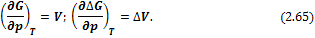
Для идеальных газов в интегральной форме:
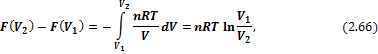
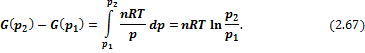
Для конденсированных систем при умеренных давлениях
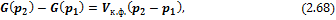
где 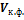 – объем конденсированной фазы.
– объем конденсированной фазы.
3) Изменение энергий Гиббса и Гельмгольца при фазовых превращениях
Изменение энергии Гиббса для фазовых переходов 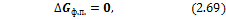
для испарения и возгонки (р = const) 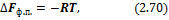
для плавления и полиморфных превращений 
4) Изменение энергий Гиббса и Гельмгольца при химической реакции
Рассмотрим различные способы:
I. Изменение энергии Гиббса можно рассчитать, используя стандартные энергии Гиббса образования реагентов и продуктов:
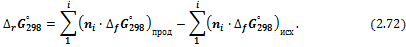
II. По определению, G = H – TS:

где 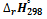 и
и 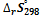 рассчитываем по уравнениям (1.16) и (1.18) соответственно.
рассчитываем по уравнениям (1.16) и (1.18) соответственно.
При произвольной температуре изменение энергии Гиббса рассчитывают аналогично:

при этом температурные зависимости стандартной энтальпии и энтропии реакции определяются выражениями (1.26) и (2.25) соответственно.
III. Для расчета энергии Гиббса реакции удобно использовать так называемую приведенную энергию Гиббса или Ф-потенциал:


Приведенный потенциал имеет размерность [Дж·моль-1·К-1], численные значения этой функции для интересующего вещества при разных температурах можно найти в специализированных термодинамических справочниках. Для расчета стандартной энергии Гиббса реакции с помощью Ф-потенциала используют формулы:
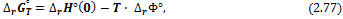
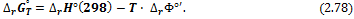
Изменение энергии Гельмгольца химической реакции связано с энергией Гиббса соотношением

где Δn – изменение количества молей газообразных веществ в ходе реакции. Для реакций в конденсированной фазе эти две величины практически одинаковы

Дата добавления: 2015-09-29; просмотров: 10979;
