Расчеты. 1.Определить разность температур ∆T1= T1x – T1.
1.Определить разность температур ∆T1= T1x – T1.
2.Рассчитать стандартный тепловой эффект 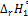 для реакции нейтрализации (2.94), согласно выражению (2.96), используя следующие справочные данные:
для реакции нейтрализации (2.94), согласно выражению (2.96), используя следующие справочные данные:
– для теплот образования веществ и ионов в растворе
| ΔfН°(Н2O(ж)) | –285,84 кДж/моль |
| ΔfН°(СН3СООН(ж)) | –484,9 кДж/моль |
| ΔfН°(Н+) | 0,0 кДж/моль |
| ΔfН°(ОН–) | –229,94 кДж/моль |
| ΔfН°(СН3СОО–) | –488,87 кДж/моль |
– для интегральных теплот растворения кислот и щелочей в воде при 25°С
| Число молей Н2О на 1 моль кислоты или щелочи | 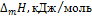
| ||
| HCl | NaOH | CH3COOH | |
| –73,28 | –42,53 | 1,184 | |
| –73,65 | –42,44 | 1,270 | |
| –73,85 | –42,34 | 1,356 | |
| –74,20 | –42,30 | 1,444 |
3.Вычислите теплоемкость системы
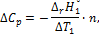
где n – количество образовавшейся воды, моль.
4.Определите разность температур ∆Т2 = T2x – T2.
5. Рассчитайте тепловой эффект реакции нейтрализации 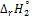 при температуре T2:
при температуре T2:
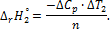
6. Вычислите стандартное изменение энтропии 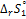 по справочным данным:
по справочным данным:
| S°(Н2O(ж)) | 69,96 Дж/(моль∙К) |
| S°(Н+) | 0,0 Дж/(моль∙К) |
| S°(ОН–) | –10,57 Дж/(моль∙К) |
7. Определите изменение энтропии реакции ∆S при повышении температуры от T1 доТ2
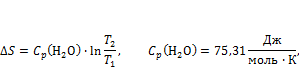
а также значениe 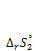 при температуре Т2
при температуре Т2
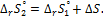
8. Рассчитайте изменениe энергии Гиббса реакции ∆rG° и максимальную работу Amax при Т1 и Т2.
Объясните причину изменений функций ∆rH°, ∆rS°, ∆rG° и Amax с увеличением температуры.
Дата добавления: 2015-09-29; просмотров: 967;
