Химический потенциал
При протекании химической реакции меняется число и вид частиц (молекул). Поэтому термодинамические потенциалы будут функциями не только своих естественных переменных, но и числа молей компонентов системы ni. Тогда энергия Гиббса есть функция G = f(T, р, n1, n2,…), полный дифференциал которой равен
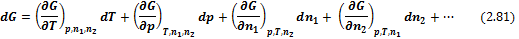
Обозначим

Величина 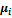 – называется химическим потенциалом и представляет собой частную производную термодинамических потенциалов по количеству i-го компонента при фиксированных естественных переменных, т. е. он показывает, насколько изменяется соответствующий термодинамический потенциал при добавлении бесконечно малого количества i-го компонента к 1 молю раствора. Размерность Дж/моль.
– называется химическим потенциалом и представляет собой частную производную термодинамических потенциалов по количеству i-го компонента при фиксированных естественных переменных, т. е. он показывает, насколько изменяется соответствующий термодинамический потенциал при добавлении бесконечно малого количества i-го компонента к 1 молю раствора. Размерность Дж/моль.
Одно и тоже значение химического потенциала i-го компонента можно получить из зависимостей от числа молей ni термодинамических потенциалов при постоянных естественных переменных:
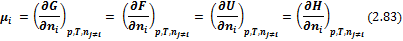
С учетом введенных обозначений выражения для полных дифференциалов термодинамических потенциалов имеют вид:
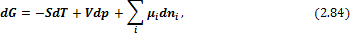
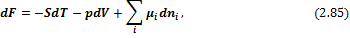
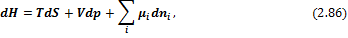
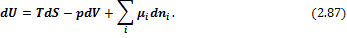
Соответственно получаем
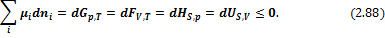
В выражении (2.88) знак равенства соответствует установлению термодинамического равновесия, знак «меньше» – самопроизвольному протеканию химической реакции.
Для того чтобы модно было использовать химический потенциал при решении практических задач, необходимо установить вид его зависимости от измеримых термодинамических переменных – температуры, давления и состава:
– Идеальные газовые смеси:
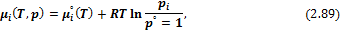
где 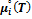 – стандартный химический потенциал i-го газа, т. е. его потенциал в состоянии чистого вещества при заданной температуре и давлении 1 бар;
– стандартный химический потенциал i-го газа, т. е. его потенциал в состоянии чистого вещества при заданной температуре и давлении 1 бар; 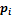 – текущее парциальное давление газа.
– текущее парциальное давление газа.
– Реальные газовые смеси:
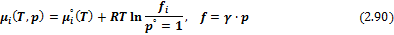
где 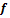 – летучесть или фугитивность – давление, которое должна производить реальная система, чтобы оказывать такое же действие, как идеальная система;
– летучесть или фугитивность – давление, которое должна производить реальная система, чтобы оказывать такое же действие, как идеальная система; 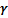 – коэффициент летучести используется для характеристики отклонения от идеального поведения.
– коэффициент летучести используется для характеристики отклонения от идеального поведения.
– Идеальные конденсированные растворы:
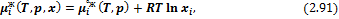
где 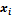 – мольная доля компонента в смеси.
– мольная доля компонента в смеси.
– Реальные конденсированные растворы:
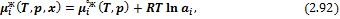
где 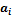 – активность, которая может быть представлена в виде произведения мольной доли
– активность, которая может быть представлена в виде произведения мольной доли 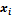 компонента на его коэффициент активности
компонента на его коэффициент активности 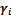 :
:

В нашем случае активность безразмерная величина. Также она может быть выражена через молярную или моляльную концентрации (активность будет иметь размерность концентрации), тогда будут изменяться значения коэффициентов активности.
Коэффициенты активности – безразмерные величины, они характеризуют работу, которую надо совершить при перемещении i-го компонента из идеального раствора в реальный при постоянной температуре, давлении и концентрации.
Дата добавления: 2015-09-29; просмотров: 1955;
