Дослідження процесів отримання порошків металів відновленням їх солей та оксидів
Перед виконанням роботи студент повинен самостійно вивчити загальні відомості про отримання порошків відновленням їх оксидів та солей різними відновниками та коротко їх занотувати в звіті про лабораторну роботу.
Необхідно ознайомитись з методикою виконання лабораторної роботи та підготувати протокол з відповідними заготівками таблиць .
Мета роботи – вивчення впливу характеристик вихідної сировини та технологічних параметрів на процес отримання порошків металів та сплавів відновленням їх оксидів різними відновником.
Матеріали і обладнання: 1 – муфельна електрична піч з робочою температурою до 12000С; 2 – муфельна прохідна електрична піч з графітним нагрівником з робочою температурою до 20000С; 3 – вихідні порошки оксидів (заліза, міді, нікелю, молібдену, вольфраму та інших металів); 4 – ваги з похибкою зважування до 0,01 г.; 5 – нікелеві, керамічні або графітні човники; 6 – оптичний мікроскоп (Ланометр); 7 – прилади для визначення властивостей порошків (див. лаб. роботу №1)
Порядок виконання роботи
Перед виконанням роботи студент одержує завдання від викладача відносно змісту роботи. Викладач вказує, відновлення якого оксиду буде досліджувати студент, а також вплив яких факторів він буде вивчати. Студенту можуть бути запропоновані оксиди міді, заліза, вольфраму та інші. При цьому можливе вивчення впливу на процес відновлення температури відновлення, часу, ізотермічної витримки, розміру частинок вихідного оксиду, товщини шару оксиду у човнику та ін. Температура відновлення
залежить від термодинамічних характеристик речовин, які приймають участь у реакції відновлення та вимог до порошків, що отримують. Так, наприклад, при відновленні оксиду міді CuO воднем це температури у межах 400…8000С, при відновленні оксидів заліза – 500…12000С, оксиду вольфраму 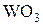 воднем – 700…12000С а вуглецем – 1400…18000С.
воднем – 700…12000С а вуглецем – 1400…18000С.
Для оцінки вірогідності проходження реакції відновлення студенту може бути надане завдання розрахувати величину ізобарно-ізотермічного потенціалу ( 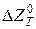 ) та константу рівноваги (
) та константу рівноваги ( 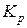 ) для реакцій, які досліджуються.
) для реакцій, які досліджуються.
У подальшому проводять відновлення оксиду. Залежно від поставленої мети лабораторної роботи вона може виконуватись за декількома варіантами.
Дата добавления: 2015-09-11; просмотров: 859;
