Механізм і кінетика відновлювальних процесів. Вплив різних факторів
Процес відновлення оксидів металів, особливо газоподібними відновниками, в цілому підпорядковується принципам адсорбційно-автокаталічної теорії. Згідно з цією теорією процес відновлення – це адсорбція на поверхні відновлюваного оксиду газоподібних молекул відновника і їх активування, хімічна взаємодія адсорбованого відновника з оксидом, топографічні і кристалохімічні перетворення і десорбція газоподібних продуктів реакції. Швидкість процесу відновлення залежить від багатьох чинників, найважливіший з яких – дифузія елементів у твердій фазі.
Для відновлення оксидів газоподібними відновниками у реакційному просторі необхідно забезпечити потрібну кількість газу-відновника, яка визначається для кожних конкретних умов константою рівноваги певної реакції. Зазвичай у реакційному просторі відбувається взаємна дифузія газу-відновника (Н2, СО) і газу, утвореного в результаті реакції (Н2О, СО2). Процес вирівнювання концентрації газів поблизу поверхні прошарку відновлюваного оксиду відбувається за рахунок зовнішньої дифузії в газах. Змінюючи швидкість потоку газу-відновника в робочому просторі печі, можна значно змінювати його концентрацію в реакційному просторі.
Складніший процес – це внутрішня дифузія, тобто дифузія газів крізь прошарок вихідної порошкової шихти і продуктів відновлення. У цьому разі доставляння газу-відновника і вилучення газоподібних продуктів відновлення відбуваються за допомогою дифузії у пористих тілах.
Процес відновлення порошкоподібних оксидів відбувається у тому випадку, якщо досягається контакт газоподібного відновника з вихідною речовиною. Підтримання такого контакту і забезпечення необхідної концентрації газової фази потребують безперервного дифузійного газообміну між внутрішнім об’ємами вихідної шихти і зовнішнім газовим середовищем робочого простору печі відновлення. Цей процес в одних випадках може визначати кінетичні закономірності відновлення, в інших – поступатись цією роллю власне хімічному відновленню, але майже завжди він впливає на хід відновлення. Тому закономірності дифузійного взаємообміну завжди потрібно враховувати для оптимізації режимів процесу відновлення.
Кінетичні закономірності відновлення оксидів металів газами залежать від механізму дифузії. Натепер розглядають два можливі механізми дифузійного масоперенесення: вільну дифузію і кнудсенівський молекулярний потік.
Механізм дифузійного масоперенесення в пористих тілах, до яких можна віднести і порошкоподібну чи гранульовану шихту оксидів, залежить від співвідношення між довжиною вільного пробігу газових молекул ( 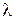 ) і поперечним розміром порових каналів, утворюваних у порошковій шихті (
) і поперечним розміром порових каналів, утворюваних у порошковій шихті ( 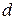 ). Якщо
). Якщо 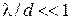 , діє механізм вільної (молекулярної) дифузії.
, діє механізм вільної (молекулярної) дифузії.
Якщо 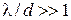 , здійснюється дифузія газів за кнудсенівським механізмом, за дії якого можливі перепади тисків між різними об’єктами через уповільнення дифузії газу-відновника з вільного об’єму до внутрішньої поверхні, утвореної порами, і у зворотному напрямі газоподібних продуктів відновлення (Н2О, СО2). Цей процес може перешкоджати відновленню. Процес відновлення буде уповільнюватись, незважаючи на достатню кількість відновника у вільному реакційному просторі (муфель печі відновлення), і швидкість його буде визначатись швидкістю дифузії газів у порах. Нерівність
, здійснюється дифузія газів за кнудсенівським механізмом, за дії якого можливі перепади тисків між різними об’єктами через уповільнення дифузії газу-відновника з вільного об’єму до внутрішньої поверхні, утвореної порами, і у зворотному напрямі газоподібних продуктів відновлення (Н2О, СО2). Цей процес може перешкоджати відновленню. Процес відновлення буде уповільнюватись, незважаючи на достатню кількість відновника у вільному реакційному просторі (муфель печі відновлення), і швидкість його буде визначатись швидкістю дифузії газів у порах. Нерівність 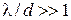 може перешкоджати у тому випадку, коли вихідні порошки оксидів чи солей металів мають малий розмір частинок, що зумовлює малий розмір пор і міжпорових каналів. Розмір пор і каналів також може зменшуватись унаслідок спікання відновлених частинок металів, якщо процес провадять за високих температур.
може перешкоджати у тому випадку, коли вихідні порошки оксидів чи солей металів мають малий розмір частинок, що зумовлює малий розмір пор і міжпорових каналів. Розмір пор і каналів також може зменшуватись унаслідок спікання відновлених частинок металів, якщо процес провадять за високих температур.
Важливим етапом у процесах відновлення, поряд з доставлянням молекул до реакційної поверхні, є адсорбція на цій поверхні. Цей процес супроводжується активуванням адсорбованих молекул під дією силових полів кристалічної ґратки оксиду з подальшою їх деформацією, відриванням від них окремих атомів і, в кінцевому підсумку, віддаванням атомами електронів кристалічній ґратці розмір.
Домішки на поверхні газів, що мають вищу адсорбуючу здатність, чинять блокувальну дію на процеси адсорбції, уповільнюючи тим самим процес відновлення. Важливу роль тут відіграє концентрація в газовому середовищі відновлення парів води і СО2. Пари СО2, маючи підвищену адсорбуючу здатність як багатоатомні гази і розміщуючись на поверхні твердої фази, блокують реакційну поверхню, різко знижуючи швидкість відновлення оксидів.
Із підвищенням температури ефект гальмування через підвищену адсорбуючу здатність Н2О і СО2 зазвичай послаблюється, оскільки знижується їх адсорбція.
Загалом слід відзначити, що для відновлення багатьох оксидів характерний взаємозв’язок кінетичних і адсорбівних чинників, тобто чим вища адсорбція газу-відновника, тим швидше відбувається процес відновлення.
Одним з важливих моментів відновлення оксидів є процес зародження нової фази, який зазвичай супроводжується їх топографічними і кристалохімічними перетвореннями. Закономірності цих процесів характерні для кожного конкретного випадку і залежать від кристалографічної будови фаз та їх питомого об’єму, розміру атомів.
Початкова стадія відновлювальних процесів – це подолання енергетичного бар’єра, що на практиці означає існування індукційного періоду, який може продовжуватись декілька годин, особливо у випадку відновлення за низьких температур. З підвищенням температури швидкість більшості реакцій відновлення різко збільшується.
Для більшості топохімічних реакцій, зокрема й реакції відновлення оксидів газоподібним відновником, характерне самоприскорення – автокаталіз. Одна з причин автокаталізу – збільшення площі реакційної поверхні.
Типову залежність швидкості автокаталітичних процесів від часу зображено на рисунку 3.3. На ньому показано три періоди перебігу реакцій: перший (І) – індукційний, що відповідає зародженню нової фази, другий (ІІ) – автокаталіз і третій (ІІІ) – вщухання процесу. Уповільнення процесу відновлення на кінцевих стадіях зумовлено багатьма чинниками, серед яких (стосовно порошкових систем) – зменшення реакційної поверхні з переміщенням фронту реакції від периферії частинки до її центра, подовження шляху внутрішньої дифузії учасників реакції.
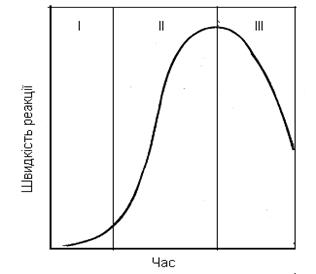
І – індукційний період;
ІІ – автокаталітичний період; ІІІ – період затухання
Рисунок 3.3 – Типова залежність швидкості автокаталітичних
реакцій від часу
Під час відновлення частина утворених на поверхні іонів металу може дифундувати в глибину кристала нижчого оксиду. Одночасно відбувається зустрічна дифузія іонів кисню оксидної фази до реакційної поверхні. Швидкість процесів дифузії здебільшого визначається законами дифузії і залежить від розмірів дифундуючих іонів, наявності дефектів кристалічної будови та ін. При цьому поряд з об’ємною дифузією по вакансіях і міжвузловому простору можлива дифузія вздовж меж зерен, міжфазних меж та інших поверхневих дефектів. Останнє активує відновлювальні процеси в цілому. Залежно від температури процесу переважає той чи той вид дифузії. За високих температур зазвичай активуються усі види дифузії, але переважний вплив на процес відновлення справляє об’ємна дифузія. Дифузія по поверхні, межах зерен і міжфазних межах характерна для низьких температур у зв’язку з меншою енергією активації.
У цілому дифузія у твердій фазі під час відновлення оксидів має складний характер і помітно відрізняється від дифузії в чистих металах і їх сплавах, хоча і для неї характерний прояв ефектів Кіркендала і Френкеля, які можуть впливати на кінетику дифузійних процесів.
Реальні процеси відновлення оксидів металів відбуваються в складних гетерогенних системах, що складаються з декількох фаз. У таких системах процеси перебігають як усередині окремих фаз, так і на межах їх поділу. Реакції відновлення мають декілька стадій. Тому для встановлення оптимальних технологічних режимів отримання порошків металів відновленням їх оксидів і вирішення при цьому кінетичних завдань необхідно виявити найповільнішу ланку, яка і буде визначати в конкретних умовах сумарну швидкість усього процесу відновлення.
Такою лімітуючою ланкою може бути один з розглянутих процесів – вільна дифузія газоподібного учасника реакції чи дифузія його через прошарок шихти по порових каналах, власне хімічна реакція, що супроводжується кристалохімічною і топографічною перебудовою кристалічної структури реагентів, внутрішня дифузія у конденсованій фазі та ін.
Установлюючи механізм і кінетику процесу відновлення, як і в разі інших хімічних реакцій, визначають їх порядок.
Щодо гетерогенних реакцій відновлення, то порядок реакції в ході процесу може змінюватись залежно від того, який механізм наразі лімітуючий. З’ясування переважного механізму реакції залежно від умов її проведення важливе з погляду раціональної побудови технологічного процесу. Особливо велике значення мають температурні залежності швидкості реакції, які можна описати рівнянням Арреніуса:
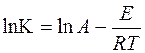 , (3.5)
, (3.5)
де К – константа швидкості реакції, що визначається експериментально;
А – константа;
Е – енергія активації;
R – універсальна газова постійна;
Т – температура.
Із рівняння (3.5) випливає, що за інших однакових умов швидкість реакції (константа швидкості) тим менша, чим вища енергія активації, і навпаки, швидкість реакції збільшується з її зменшенням. За енергією активації можна судити про зміну швидкості реакції з підвищенням температури. Великі її значення свідчать про те, що швидкість реакції буде тим інтенсивніша, чим вища температура. Енергію активації для процесу в кожному конкретному випадку можна визначати за експериментально встановленими значеннями константи швидкості реакції за різних температур. При цьому використовують графічний метод. Будують графік у координатах lgK–1/T (рис. 3.4), який має вигляд прямої лінії з кутовим коефіцієнтом Е/Р. Звідси енергія активації
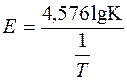 .
.
За енергією активації можна судити про лімітуючий механізм реакції відновлення. Наприклад, енергія активації дифузійних процесів у газовій фазі та фізичної адсорбції лежить у межах 8…20 кДж. Для хемосорбції характерні значення Е = 40…80 кДж. Для дифузії у конденсованих фазах та інших процесах значення енергії активації ще вищі.
Якщо залежність lgK–1/Т відповідно до рівняння Арреніуса прямолінійна, це свідчить про незмінність лімітуючого механізму процесу відновлення в розглядуваному інтервалі. Якщо ж графік lgK–1/Т показує помітне відхилення від прямої, то можна стверджувати, що спостережувальний процес складний, і лімітуючий механізм, що визначає швидкість реакції, змінюється з підвищенням температури.
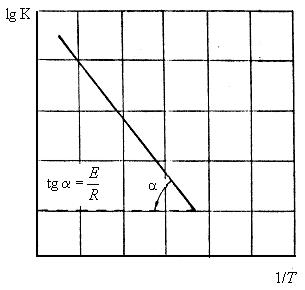
Рисунок 3.4 – Графік для визначення енергії активації
3.3 Закономірності отримання порошків металів відновленням їх
оксидів і солей воднем
Водень як відновник використовують для відновлення оксидів металів, які мають невелику спорідненість з киснем ( 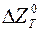 = 280 кДж на 1 моль О2), зокрема мідь, нікель, кобальт, залізо, молібден, вольфрам, реній. У цьому випадку реакції відновлення перебігають за схемою:
= 280 кДж на 1 моль О2), зокрема мідь, нікель, кобальт, залізо, молібден, вольфрам, реній. У цьому випадку реакції відновлення перебігають за схемою:
MeO + H2 - Me + H2O,
або використанням хлоридів:
MeCl2 + H2 = Me + 2HCl.
Константи рівноваги цих реакцій визначають за співвідношенням:
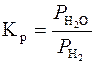 або
або 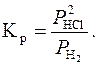
Зазвичай константи рівноваги для реакцій відновлення указаних металів мають відносно високі значення. У зв’язку з цим процес відновлення може відбуватись за відносно низьких температур і невеликих концентрацій водню.
Якщо в системі Ме – О є декілька оксидів, то процес відновлення підпорядковується принципу послідовності А. А. Байкова. Наприклад, для заліза, вольфраму, молібдену ця послідовність має вигляд:
Fe2O3®Fe3O4®FeO®Fe;
WO3®WO2,9®W2,72®WO2®W;
MoO3®MoO2,98®Mo2,75®MoO2®Mo,
тобто процес відновлення вищих оксидів до нижчих відбувається через стадії утворення проміжних оксидів.
Перехід від одного оксиду до іншого супроводжується здебільшого зміною його термодинамічних характеристик. Тому для кожної реакції відновлення проміжного оксиду константа рівноваги буде мати свої значення і потребуватиме різних умов для її перебігу.
Рівноважна реакція відновлення оксидів, а також значення констант рівноваги та характер їх залежності від температури визначають умови відновлювальних процесів і технологічних режимів.
Так, для отримання порошків заліза відновленням їх оксидів воднем, не зважаючи на те, що швидкість процесу зростає з підвищенням температури, її обмежують інтервалом 950…1050 °С з тим, щоб зберегти на всіх етапах відновлення високу газопроникність шихти і продукти відновлення. За високих температур відбувається спікання поверхневого прошарку утвореного металу, і, як наслідок, зменшення пористості. Це утруднює дифузію водню поровими каналами і пари води в зворотному напрямі. У результаті в нижніх прошарках шихти вміст Н2О може опинитися вище, ніж це визначається константою рівноваги для реакції відновлення, і вона уповільнюватиметься або навіть змінить напрям на зворотний, тобто на окиснення з утворенням вищого оксиду. Цей процес може призвести до технологічного браку, так званого «пирога» – продукту, зовнішні прошарки якого – спечений метал, а нижні – невідновлені оксиди. Подібний вплив високої температури на відновлення спостерігається і стосовно інших металів.
Важливим для збереження високої газопроникності шихти є розмір частинок вихідних оксидів. Одна з вимог до отриманого порошку – малий розмір частинок, який залежить від розміру частинок вихідного оксиду. Якщо порошок помітно не погіршує газопроникності, то звичайно, чим менша частинка вихідного оксиду, тим більша швидкість відновлення. Тому важливо для збільшення реакційної поверхні і зменшення внутрішньої дифузії у конденсованій фазі необхідно для відновлення використовувати оксиди з мінімально можливим розміром частинок.
Але зменшення розміру частинок вихідного оксиду значно погіршує газопроникність шихти і продуктів відновлення через малий розмір порових каналів та інтенсифікацію спікання дрібних частинок металу. Тому частинки оксиду обмежують розмірами, що забезпечують достатню газопроникність. Наприклад, у разі використання як вихідної сировини прокатної окалини для отримання порошку заліза її подрібнюють до розміру частинок, меншого за 150 мкм.
Якщо малий розмір частинок вихідних оксидів обумовлюється хіміко-металургійним переділом рудної сировини, газопроникність забезпечують регулюванням висоти прошарку засипки вихідної шихти в піддони. Чим менший розмір частинок, тим меншої товщини має бути прошарок шихти в піддоні. Однак цей прошарок значно знижує продуктивність агрегатів, застосовуваних для отримання порошків.
Вибір температури відновлення також може обумовлюватись вимогами до розміру частинок отримуваного порошку металу. Розмір частинок порошку металу найчастіше визначають розміром частинок вихідного чи нижчого оксиду, з якого безпосередньо утворюються частинки металу. Теоретично у процесі відновлення в оптимальних умовах з однієї частинки вихідного оксиду утворюється одна частинка порошку металу. При цьому розмір частинки металу завжди менший від розміру частинки оксиду. Однак на практиці не має однозначної залежності між розмірами. Особливо це характерно для відновлення металів, оксиди яких мають за високих температур підвищену пружність пари. У цих випадках застосування високих температур сприяє отриманню більших частинок металу, ніж це визначають вихідні розміри частинок оксидів. Для запобігання цьому явищу, незважаючи на прискорення процесу відновлення з підвищенням температури, її обмежують значеннями, що зменшують випаровування оксидів.
За певних умов можна отримувати дрібніші порошки металів, ніж це визначається вихідними оксидами.
Відзначені явища, характерні для відновлення оксидів металів воднем, зумовлені здебільшого перенесенням через газову фазу і топохімічними перетвореннями в твердій фазі.
Дата добавления: 2015-09-11; просмотров: 1243;
