Закономірності відновлення оксидів металів вуглецем
Вуглець застосовують для відновлення як важко- так і легковідновлювальних оксидів, якщо в кінцевому продукті допустимий деякий вміст вуглецю у вільному чи зв’язаному вигляді.
Раціональні умови проведення процесів відновлення металів з їх оксидів вуглецем значною мірою визначаються механізмом цих процесів.
Найбільш імовірний механізм відновлення оксидів, особливо за високих температур, за яким спочатку відбувається газифікація вуглецю за реакціями
С + О2 = СО2 і СО2 + С = 2СО,
а потім відновлення оксиду металу оксидом вуглецю:
МеО + СО = Ме + СО2 .
У цьому випадку константу рівноваги реакції відновлення можна визначати так:
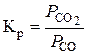 .
.
Рівновагу реакції відновлення варто розглядати у зв’язку з рівновагою реакції газифікації вуглецю. Наприклад, для випадку відновлення заліза і вольфраму рівновага реакцій відновлення нижчих оксидів FeO і WО2 має вигляд, як на рис. 4.9. Як видно з рисунка, відновлення оксиду заліза FeO нижче за температуру 650 °С й оксиду вольфраму нижче від 730 °С оксидом вуглецю неможливе, оскільки нижче від цих температур відбувається зворотна реакція 2СО ® СО2 + С, і рівноважна концентрація СО не досягається.
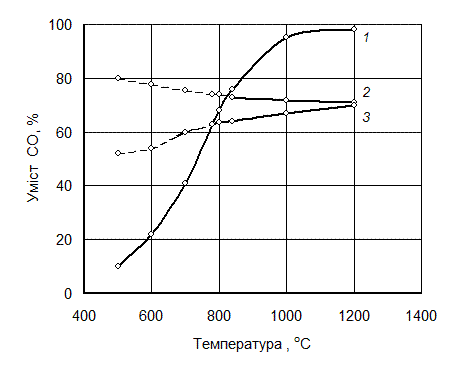
1 – С + СО2 = 2СО; 2 – WO2 + CO = W + CO2;
3 – FeО + CO = Fe + CO2
Рисунок 3.5 – Криві рівноваги реакцій
Точки перетину кривих 3 і 2 з кривою 1 на рисунку 3.5 рівноважні для реакцій відповідно: FeO + CO = Fe + СО2і WО2 + 2СО = W + 2СО2 .
У разі проведення процесу за температури, нижчої від температури рівноваги відновлення, може відбуватись тільки за безпосередньої взаємодії оксиду з вуглецем, а за високої пружності пари оксиду, що відновлюється, – у разі відновлення його на частинках вуглецю. Однак відновлення за низьких температур відбувається повільно. Тому процес відновлення вуглецем зазвичай проводять за температур, вищих за температури рівноваги, за яких забезпечується необхідна концентрація СО, що визначається константою рівноваги реакції. Звичайно, ці температури вищі за 1000 °С, за яких газова фаза майже повністю складається з оксиду вуглецю.
Оскільки в процесі відновлення вуглецем у реакції бере участь газоподібний компонент, то цей процес розвивається відповідно до закономірностей адсорбційно-автокаталітичної теорії, тобто лімітуючими стадіями процесу відновлення можуть бути фізична адсорбція і хемосорбція, хімічна реакція, дифузія газу-відновника і газоподібних продуктів відновлення по порових каналах, дифузія в конденсованій фазі. У цьому разі кінетика відновлення подібна до кінетики відновлення газоподібним відновником (Н2, СО).
Якщо швидкість процесу лімітується реакцією відновлення оксидів металів оксидом вуглецю, важливим є прискорення процесу газифікації вуглецем. Це можна забезпечити застосуванням для відновлення сажистого заліза чи введенням у вихідну шихту домішків солей деяких лужних металів.
Застосування сажистого заліза у складі твердого чи комбінованого відновника для отримання порошків заліза збільшує швидкість відновлення і дозволяє знизити температуру процесу на 100…200 °С, оскільки вуглець у сажистому залізі знаходиться в активному стані внаслідок високого ступеня неупорядкованості кристалічної структури.
Активуючу роль домішок солей деяких лужних металів (наприклад, карбонатів і хлоридів) у процесах відновлення таких металів, як свинець, цинк, нікель, залізо, кобальт, мідь, марганець, ніобій та інші, зумовлено здебільшого двома причинами:1) іони лужного металу, упроваджуючись у міжбазисні простори кристалічної ґратки вуглецю, сприяють прискоренню його газифікації; 2) ті ж іони лужних металів взаємодіють з поверхнею оксидів металів і прискорюють структурні зміни в процесі їх кристалохімічних перетворень.
У разі відновлення вуглецем і вуглецевмісними газами відбувається насичення вуглецем відновленого металу з утворенням твердих розчинів вуглецю в металі чи карбідів. Для запобігання цим явищам відновлення проводять за можливо низьких температур, скорочують час перебування шихти в реакційній зоні. Але найдієвішим чинником щодо цього, що не знижує продуктивність пічного обладнання, є відновлення у суміші газів Н2 і СО. При цьому намагаються забезпечити в реакційному просторі мінімальну кількість газів CO2 і Н2О. Робоче газове середовище із суміші Н2 і СО створюється штучно або введеням водню в муфель печі для відновлення оксидів вуглецем. У результаті в процесі відновлення беруть участь гази Н2, СО, Н2О і СО2. У цьому випадку поряд з реакцією регенерації оксиду вуглецю можуть відбуватись реакції:
С + Н2О = Н2 + СО; СО2 + Н2 = Н2О + СО. (3.6)
Константа рівноваги реакції (3.6) визначається із співвідношення:
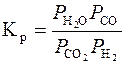 .
.
Оскільки вміст СО і СО2 визначається константою рівноваги для реакції регенерації вуглецю
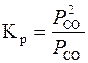 ,
,
вміст газів Н2, СО, СО2, Н2О у робочому просторі за певної температури і тиску чітко визначено. Найбільш прийнятний конвертований газ (75% Н2+25% СО), отриманий парогазовою конверсією природного газу за наявності нікелевого каталізатора за температури 1000…1100 °С. Утворення Н2 і СО відбувається за реакцією СН4+ Н2О = 3Н2+СО.
Дата добавления: 2015-09-11; просмотров: 2156;
