Відновленням з оксидів та інших сполук
3.1 Основи термодинаміки відновлювальних процесів
Отримання порошків металів і сплавів відновленням їх сполук, найчастіше оксидів і галогенідів, – один з найпоширеніших і продуктивних методів.
Готуючи порошки металів цим методом, можна в широких межах регулювати їх склад і фізико-технологічні властивості. Як вихідну сировину для отримання порошків відновленням використовують природні оксиди (збагачені руди) або продукти хімічного переділу природних руд і відходів виробництва (скрапу). В основі процесу відновлення лежить хімічна реакція:
MeO (Cl) + X = Me + XO (XCl) ± Q, (3.1)
де Х – відновник.
Відновник вибирають залежно від фізико-хімічних властивостей вихідних сполук і вимог до порошку. Найчастіше в порошковій металургії як відновники використовують водень, оксид вуглецю, суміші цих газів, вуглець та метали-відновники (магній, кальцій, натрій, алюміній). Для різних відновників реакція (3.1) набуває вигляду
MeO + H2= Me + H2O; (3.2)
MeO+ CO(C)=Me + CO2; (3.3)
MexCly+ Y/2 H2= XMe + YHCl; (3.4)
MeO + Me^= Me+ Me^O;
де Me^ – Mg, Ca, Na, Al.
Для розроблення процесів отримання порошків відновленням їх сполук важливе значення має хімічна термодинаміка, яка дозволяє визначити можливість перебігу реакції в потрібному напрямі і стан кінцевого продукту. Критерієм можливості перебігу реакції в тому чи іншому напрямі є ізобарно-ізотермічний потенціал:
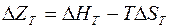 ,
, 

де 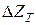 – зміна ізобарного потенціалу за температури Т;
– зміна ізобарного потенціалу за температури Т;
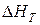 – тепловий ефект реакції;
– тепловий ефект реакції;
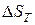 – зміна ентропії системи.
– зміна ентропії системи.
Реакція відновлення перебігає у бік отримання металу в тому випадку, якщо звільняється вільна енергія, тобто зміна ізобарно-ізотермічного потенціалу має від’ємний знак. За додатного значення 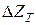 відбувається зворотна реакція. Якщо
відбувається зворотна реакція. Якщо 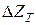 = 0, реакція – рівноважна.
= 0, реакція – рівноважна.
На практиці для розрахунку термодинамічних рівноваг використовують стандартну зміну ізобарного потенціалу 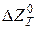 . Як стандартний для газоподібних складових компонентів реакції беруть тиск 0,1 МПа, а для твердих тіл – речовину в чистому вигляді. Знаючи
. Як стандартний для газоподібних складових компонентів реакції беруть тиск 0,1 МПа, а для твердих тіл – речовину в чистому вигляді. Знаючи 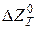 , можна визначити константу рівноваги реакції з виразу
, можна визначити константу рівноваги реакції з виразу
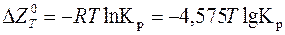 ,
,
звідки 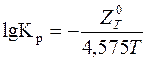 .
.
Для реальних умов, коли вихідні компоненти і продукти реакції не перебувають в стандартних умовах, використовують повний вираз для ізобарно-ізотермічного потенціалу:
 ,
,
де С – співвідношення добутку концентрацій продуктів реакції до добутку концентрацій вихідних речовин в умовах, що розглядаються.
У цьому випадку 
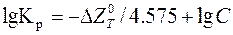 .
.
Якщо в процесах беруть участь газоподібні речовини (реакції 3.2 – 3.4), розвиток і напрям реакції визначають не тільки температурою, але й співвідношенням парціальних тисків газоподібних учасників:
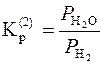 ;
; 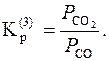
Рівновага реакцій залежить від загального тиску в реакційному просторі, якщо кількість молекул газу-відновника і газу-продукту, що беруть участь у реакції, різні (реакція (3.4)). У цьому випадку константу рівноваги визначають з виразу:  .
.
Знаючи константу рівноваги за певної температури, можна розрахувати рівноважний склад газової фази.
Рівноважну суміш газів для різних реакцій відновлення можна подати у вигляді графічної залежності склад – температура. Цю залежність для випадку відновлення оксидів деяких металів показано на рисунку 3.1.

1 – SiO2; 2 – ZnO; 3 – FeO; 4 – Fe3O4; 5 – NiO; 6 – PbO; 7 – Cu2O
Рисунок 3.1 – Залежність рівноважних концентрацій СО в суміші із СО2 для реакцій відновлення оксидів металів оксидом вуглецю від температури
У нижній частині цієї діаграми зазвичай розміщені залежності для відновлення металів з низькою спорідненістю до кисню (Cu, Pb, Ni), а також тих, що потребують для свого відновлення незначних концентрацій СО у газовій фазі. Константа рівноваги для таких реакцій звичайно більша від одиниці (Kp > 1). У верхній частині діаграми розміщуються метали з великою спорідненістю з киснем (Zn, Si, Mn), для яких Kp < 1. У цьому випадку для їх відновлення потрібний значний вміст СО у газовій фазі. Точки на кривих 1–7 відповідають рівноважним складам газової суміші, тобто ці склади нейтральні відносно Ме і МеО. Якщо склад суміші за певної температури не відповідає рівноважному, то в системі немає рівноваги і реакція відбувається в той чи той бік залежно від складу суміші відносно рівноважного.
Порівнюючи значення константи рівноваги для конкретних умов (Кр^) з її значенням для умов рівноваги (Кр), можна визначити напрям реакції у даний момент. Так, якщо Кр^ < Кр, то перебігає реакція відновлення (рис. 4.1, точка а), якщо Кр^ > Кр, окиснення металу (точка б), а якщо Кр^ = Кр, – рівновага (точка 0).
Зміна константи рівноваги від температури для відновлення оксидів різна як за напрямом, так і за інтенсивністю змінювання. Для одних металів Кр з температурою збільшується (крива, напрямлена вгору), а для інших – зменшується (крива, напрямлена донизу). У першому випадку – це уповільнення реакції з температурою, а в другому – прискорення за інших однакових умов.
Кут нахилу і швидкість зміни реакції від температури залежать від значень теплового ефекту. У загальному випадку якісна зміна константи рівноваги реакції відновлення залежно від температури підпорядковується правилу Ле Шательє.
Вибір відновника особливо важливий, оскільки від нього залежать швидкість, повнота перебігу реакції відновлення і, деякою мірою, властивості отримуваних порошків. Вибір того чи іншого відновника залежить від багатьох умов, серед яких термодинамічна стійкість вихідних оксидів – головна. Термодинамічну стійкість зумовлено спорідненістю елементів, що утворюють оксид, з киснем. Ступінь спорідненості з киснем можна визначати за зміною ізобарно-ізотермічного потенціалу, яким супроводжується утворення оксиду з елементів. Чим більш від’ємне значення 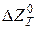 , тим вища спорідненість елемента з киснем. Як видно з рисунку 3.2, найсильніші відновники – кальцій, магній, алюміній, натрій. Водень – найслабший відновник. Важливе місце серед відновників посідає вуглець, відновлювальна здатність якого збільшується з підвищенням температури, тобто залежно від температурних умов він може слугувати відновником теоретично для будь-яких елементів.
, тим вища спорідненість елемента з киснем. Як видно з рисунку 3.2, найсильніші відновники – кальцій, магній, алюміній, натрій. Водень – найслабший відновник. Важливе місце серед відновників посідає вуглець, відновлювальна здатність якого збільшується з підвищенням температури, тобто залежно від температурних умов він може слугувати відновником теоретично для будь-яких елементів.

Рисунок 3.2 – Зміна ізобарно-ізотермічного потенціалу від температури для реакцій утворення оксидів
Для відновлення тугоплавких металів (титану, цирконію, гафнію, танталу), що мають високу спорідненість з киснем, застосовують кальцій, магній, алюміній. Якщо спорідненість з киснем таких оксидів металів, як вольфрам, реній, молібден, нікель, кобальт, залізо, мідь, низька, відновлювати їх доцільно воднем.
Вуглець – найуніверсальніший відновник. Його можна застосовувати для відновлення майже будь-яких оксидів. Однак у разі відновлення вуглецем за високих температур утворюються карбіди металів, що не завжди бажано.
Дата добавления: 2015-09-11; просмотров: 1401;
