Отримання порошків металів металотермічним відновленням
В основі процесів отримання порошків металів металотермічними методами лежить реакція:
МеХ + Ме^ = Ме + МеХ + О. (3.10)
Як вихідні сполуки (МеХ) застосовують оксиди, хлориди, фториди. Інтенсивність і повнота реакції відновлення залежить від спорідненості металу-відновника Ме^ і відновлюваного металу М з киснем, хлором і фтором. Чим вища спорідненість металу-відновника із цими елементами, тим інтенсивніше і більш повно проходить реакція відновлення. Спорідненість елементів у певній сполуці визначається ізобарно-ізотермічним потенціалом 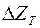 реакції (3.10).
реакції (3.10).
Відновниками для оксидів, хлоридів, фторидів можуть слугувати кальцій, магній, натрій і алюміній. При цьому для відновлення оксидів можна застосовувати Са, Mg і Al, для хлоридів – Ca, Na, Mg, для фторидів – Ca, Na, Mg.
У кожному конкретному випадку, вибираючи відновника, виходять із такого:
1) відновник має бути більше спорідненим з металоїдом (О2; Cl; F), ніж відновлюваний елемент;
2) відновник не має взаємодіяти зі сполукою, що відновлюється, і відновленим металом;
3) продукти відновлення мають легко відокремлюватись один від одного методами механічного чи хімічного збагачення;
4) частинки відновленого металу, що утворились, не повинні спікатись чи утворювати конгломерати.
Найповніше відповідає цим вимогам кальцій, який не утворює з багатьма металами сполук, сплавів і твердих розчинів. Крім того, оксид кальцію, що утворився, легко відокремлюється від отриманого продукту гідрометалургійною переробкою.
Але в порошковій металургії часто використовують для відновлення таких оксидів, як ТіО2, ZrO2 i ThO2 гідрид кальцію, який отримують взаємодією кальцію із сухим і чистим воднем за температури 400…500 °С. Гідрид кальцію має підвищену крихкість і легко подрібнюється в порошок. Застосування як відновника гідриду кальцію вигідне ще й тому, що в процесі відновлення поряд з кальцієм бере участь атомарний водень, що утворюється в результаті розпаду СаН2 за температури вищої за 800 °С і має високу відновлювальну здатність. Це зумовлено тим, що спорідненість атомарного водню з киснем вища, ніж з кальцієм і магнієм.
Магній і натрій, хоч і мають досить високу спорідненість з киснем і галогенами у практиці металотермічного відновлення, особливо оксидів металів, застосовують рідше. Магній утворює з киснем оксид, майже не розчинний у воді та слабких розчинах кислот, що значно утруднює процес його відділення від відновленого металу. Застосування натрію для відновлення оксидів утруднено через його високу активність і підвищену пружність парів за температур відновлення. У зв’язку з цим магній і кальцій застосовують здебільшого для відновлення галоїдних солей металів.
Важливе значення для металотермічного відновлення металів має тепловий ефект реакцій, співвідношення якого до одиниці маси шихти називають термічністю процесу:
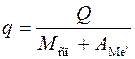 ,
,
де Q – тепловий ефект реакції;
Мсп – молярна маса відновної сполуки;
АМе^ – атомна маса металу-відновника.
Звичайно, термічність спонтанного процесу має бути не меншою за 2090 кДж/кг вихідної шихти. При цьому термічність значною мірою залежить від співвідношення мас відновної сполуки та металу-відновника. Найвищі її значення має стехіометричне співвідношення. Надлишок того чи іншого компонента у вихідній шихті призводить до зниження термічності, оскільки для цього випадку потрібна витрата теплоти на нагрівання, а в разі застосування до металу-відновника і плавлення – надлишкового компонента. Крім того, на термічність процесу впливають умови теплопередачі, ступінь гомогенності шихти, розміри частинок вихідних компонентів та ін.
Якщо теплоти, що виділяється, недостатньо для спонтанного проходження процесу, що часто спостерігається в реальних умовах, у шихту можна вводити сильні окисники і легковідновлювальні оксиди, селітру, бертолетову сіль та інші солі, взаємодія яких з металом-відновником супроводжується сильним екзотермічним ефектом. Тоді термічність процесу можна визначати за рівнянням
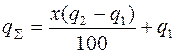 ,
,
де Х – вміст домішки, %;
q2 – термічність реакції взаємодії домішки з металом-відновником;
q1 – термічність реакції відновлення основного оксиду металу.
Якщо введення домішки, що збільшує екзотермічний ефект реакції, з яких-небудь причин небажане (забруднення отриманого металу, трудність розділення продуктів реакції), застосовують зовнішнє підігрівання шихти (реактор з шихтою поміщають у піч).
Іноді термічність треба обмежувати через бурхливий перебіг реакції і застосовувати герметичні реактори. У цьому разі для зниження термічності процесу у вихідну шихту вводять інертні домішки – оксиди металів-відновників, наприклад СаО, чи порошки відновлюваних металів.
З практичної точки зору, наприклад для отримання порошків титану, цирконію та ванадію відновленням їх оксидів кальцієм , відновлення проводять у герметичних реакторах (рис. 4.10), які після завантаження їх вихідною сировиною вакуумують та заповнюють аргоном чи воднем. Інертне середовище або відновлювальне газове середовище потрібне для запобігання взаємодії відновлюваного металу з азотом і киснем повітря.
Основу цих процесів становлять реакції:
TiO2 + 2Ca = Ti + 2CaO + Q;
ZrO2 + 2Ca = Zr + 2CaO + Q;
V2O5 + 5Ca = 2V + 5CaO + Q.
Хоч реакції перебігають з виділенням теплоти, зазвичай їх термічність недостатня для спонтанного процесу. У зв’язку з цим застосовують зовнішнє підігрівання і відновлення проводять за температур 1000…1100, 950…1100 і 1000°С протягом 1…2 год для отримання відповідно титану, цирконію і ванадію. Застосування таких температур сприяє розплавленню кальцію і частковому його випаровуванню, що забезпечує якісний його контакт з відновлюваним оксидом.
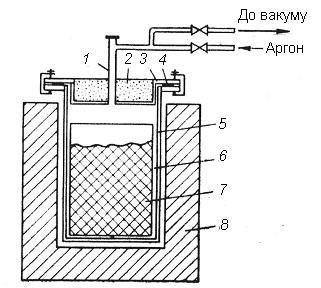
1 – патрубок; 2 – теплоізоляційна засипка; 3 – кришка;
4 – ущільнювач; 5 – корпус; 6 – металевий тигель; 7 – брикетована шихта; 8 – електропіч
Рисунок 3.6 – Схема установки для металотермічного відновлення
оксидів металів кальцієм
Поряд з температурою на швидкість і повноту проходження процесу відновлення впливають кількість відновника і якість його контакту з оксидом. Відновника зазвичай беруть на 25…100 % більше від теоретично необхідного. Для поліпшення контакту шихта ретельно перемішується і брикетується.
Таким чином отримують порошки, розмір частинок яких менший за 2…3 мкм. Такі порошки мають домішки кисню та азоту відповідно 0,2…0,3 і 0,03…0,15%.
Для отримання порошків з більшими частинками та зниження вмісту домішок у них до складу вихідної шихти необхідно вводити речовини, що розчиняють оксид кальцію і забезпечують частинкам металу рухливість, потрібну для їх збільшення. Для відновлення кальцієм як таку домішку використовують хлористий кальцій.
TiCl4(г) + 2Mg(р) = Ti + 2MgCl2(р) + 514,3 кДж ;
ZrCl4(р) + 2Mg(р) = Zr +2MgCl2(р) + 356,5 кДж.
Процес здійснюють у герметичних реакторах, заповнених інертним газом за температури 800…900 °С.
Для натрієтермічного відновлення як вихідні сполуки металів можна використовувати як хлориди, так і фтористі комплексні солі металів. Для отримання порошків танталу і ніобію застосовують фторотанталат і фтороніобат калію, відновлення яких натрієм відбувається за реакціями:
K2TaF1 + 5Na = Ta + 5NaF + 2KF;
K2NbF1 + 5Na = Nb + 5NaF + 2KF
з термічністю 2100…3000 кДж/кг, що достатньо для спонтанного їх перебігу. Процес здійснюють у тиглях з негерметичною кришкою, у які шарами завантажують вихідні солі і натрій у кількості 120% теоретично необхідного. Зверху шихту засипають порошком хлористого натрію. У процесі відновлення утворюється рідкий соляний розплав KF-NaF-NaCl, який запобігає взаємодії металу з киснем і азотом повітря, що виключає потребу герметизації контейнерів і застосування захисних середовищ.
Процес відбувається спонтанно за температури 800…900 °С за початкового локального підігрівання шихти через стінку контейнера до 450…500 °С. Висока швидкість відновлення забезпечується розплавленням натрію, його частковим розчиненням у вихідній солі й утворенням парів.
Однак спонтанний перебіг реакції не забезпечує довгого витримування за температури процесу і відновлений метал формується у вигляді дрібних частинок розміром 1…2 мкм. У результаті цього після гідрометалургійної обробки продукту порошок містить близько 1% кисню.
Для отримання більш крупнозернистого порошку і зниження вмісту в ньому кисню процес провадять з підігрівом у шахтній печі за температури 900…1000 °С протягом 1,5…2 год. Отримані таким чином порошки танталу і ніобію містять до 0,5% кисню і 0,1% азоту.
Дата добавления: 2015-09-11; просмотров: 2501;
