Тип 2: Нахождение молекулярной формулы органического вещества по массе (объему) продуктов его сгорания.
Задача: Определить молекулярную формулу углеводорода по следующим данным: при сгорании газообразного углеводорода массой 0.29 г образовались углекислый газ объемом 0.448 л и пары воды массой 0.45 г. Плотность углеводорода по водороду равна 29.
Первый способ решения задачи основан на следующих рассуждениях: органические вещества состоят из углерода и водорода, поэтому по продуктам сгорания можно определить массу и количество вещества каждого из этих элементов.
1. Решение начинаем с нахождения относительной молекулярной массы:
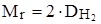 Mr = 2 · 29 = 58 M = 58 г/моль.
Mr = 2 · 29 = 58 M = 58 г/моль.
2. По стехиометрической схеме находим массу углерода в CO2 объемом 0.448 л и массу водорода в H2O массой 0.45 г:
0.448 л x г 0.45 г y г
CO2 ¾ C H2O ® 2H
n = 1 моль n = 1 моль n = 1 моль n = 2 моль
Vm=22.4 л/моль M=12 г/моль M=18 г/моль M=1 г/моль
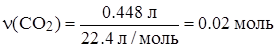
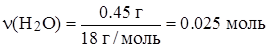
n(CO2) = n(C) = 0.02 моль n(H) = 2n(H2O) = 0.05 моль.
x = 0.24 г. y = 0.05 г.
Обращаем внимание учащихся, что сумма масс равна 0.29 г, то есть массе исходного вещества, следовательно, других элементов нет (если сумма меньше, то еще есть кислород).
3. Далее решение может быть осуществлено двумя вариантами:
| а) | по массе: | б) | по количеству вещества: Найдем |
| Составим пропорции: | число моль исходного вещества: | ||
| 0.29 г CxHy – 0.24 г C 58 г CxHy – x' г C | 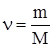
| ||
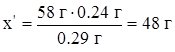
| 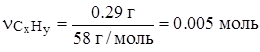
| ||
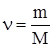
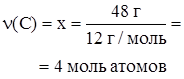
| Количество моль атомов:

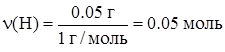
| ||
| Аналогично: | Составим пропорции: | ||
| 0.29 г CxHy – 0.05 г H 58 г CxHy – y' г H | 0.005 моль CxHy – 0.02 моль атомов C 1 моль CxHy – xмоль атомов C | ||
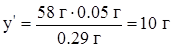
| 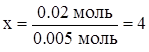
| ||
| n(H) = 10 моль атомов. | Аналогично: | ||
| 0.005 моль CxHy – 0.05 моль атомов H 1 моль CxHy – yмоль атомов H | |||
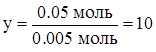 . .
| |||
| Ответ: формула C4H10. | Ответ: формула C4H10. |
Второй способ решения задачи. Расчет по уравнению горения.
0.29 г 0.448 л 0.45 г
1. CxHy + 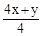 O2 = x CO2 +
O2 = x CO2 + 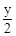 H2O.
H2O.
n = 1 моль n = х моль n = 0.5y
M = 58 г/моль V = х·22.4 л M = 18 г/моль
m = 58 г m = 9y г
2. Далее решение может быть осуществлено двумя вариантами:
| а) | по массе: | б) | по количеству вещества: |
| Составим пропорции: 0.29 г CxHy – 0.448 л CO2 58 г CxHy – x·22.4 л CO2 | Найдем число моль исходного вещества и продуктов сгорания: 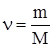
| ||
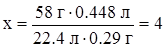
| 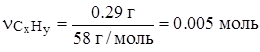
| ||
| Аналогично: | 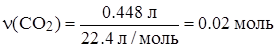
| ||
| 0.29 г CxHy – 0.45 г HO2 58 г CxHy – 9·y г HO2 | 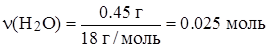
| ||

| Составим пропорции: 0.005 моль CxHy – 0.02 моль CO2 1 моль CxHy – xмоль CO2 | ||
| Ответ: формула C4H10. | 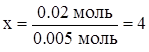
| ||
| Аналогично: 0.005 моль CxHy – 0.025 моль HO2 1 моль CxHy – 0.5·yмоль HO2 | |||
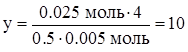 . .
| |||
| Ответ: формула C4H10. |
Сравниваем Mr данной молекулы с Mr, рассчитанной по 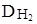 . Если Mr не совпадают, то есть кислород.
. Если Mr не совпадают, то есть кислород.
Если сгоревшее вещество содержало кислород, то в уравнении меняется коэффициент только перед O2, но этот коэффициент на решение не влияет:
CxHyOz + 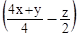 O2 = x CO2 +
O2 = x CO2 + 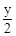 H2O.
H2O.
Дата добавления: 2015-08-21; просмотров: 2953;
