Решение расчетных задач в 11 классе
В 11 классе новыми являются задачи на химическую кинетику.
Задача 1: Вычислите среднюю скорость реакции
A + B = 2C,
1 моль 1 моль
если концентрация вещества A была 0.22 моль/л, а через 10 секунд стала 0.215 моль/л. Как изменилась за это время концентрация вещества B?
| Дано: | |
| C1 = 0.22 моль/л | |
| C2 = 0.215 моль/л | |
| Dt = 10 сек. | |
| u = ? DCB = ? |
Решение:
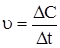

DCB = DCA = 0.005 моль/л.
Задача 2: Во сколько раз увеличится скорость реакции при повышении температуры от 150°С до 200°С, если g = 3?
| Дано: | |
| t1 = 150°C | |
| t2 = 200°C | |
| g = 3 | |
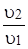 = ? = ?
|
Решение:
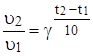
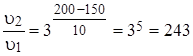 .
.
Ответ: В 243 раза.
Задача 3: В момент равновесия обратимой реакции
2SO2 + O2 « 2SO3
[SO2] = 0.002 моль/л; [O2] = 0.004 моль/л; [SO3] = 0.003 моль/л. Вычислите исходные концентрации кислорода и оксида серы.
Решение:
Согласно уравнению реакции, в нее вступают 2 моль SO2, 1 моль O2 и получается 2 моль SO3:
2SO2 + O2 « 2SO3.
2 моль 1 моль 2 моль
Обозначим количество реально вступающих и получающихся веществ через Dn.
Первоначально объясним учащимся:
 , если принять V = 1 л, то C = n.
, если принять V = 1 л, то C = n.
Затем составим таблицу по уравнению:
2SO2 + O2 « 2SO3.
2 моль 1 моль 2 моль
nисх. 0.005 0.0055 0.0
Dn 0.003 0.0015 0.003
nравн. 0.002 0.004 0.003.
Исходные концентрации SO2 и O2 находим, суммируя Dn и nравн. Так как по уравнению реакции из 2 моль SO2 получается 2 моль SO3, то:
Dn(SO2) = nравн.(SO3) = Dn(SO3).
На образование 2 моль SO3 по уравнению реакции расходуется 1 моль кислорода, следовательно:
Dn(O2) = 1/2 nравн.(SO3).
Задача 4: Во сколько раз возрастет скорость реакции взаимодействия азота с водородом N2 + 3H2 « 2NH3, если увеличить концентрацию водорода в 2 раза?
Решение:
u = K·[N2]·[H2]3
Пусть [H2]1 = x, тогда [H2]2 = 2x
u1 = K·[N2]·x3 u2 = K·[N2]·(2x)3
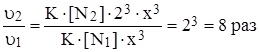 .
.
Дата добавления: 2015-08-21; просмотров: 2618;
