Тип 1: Вычисление массы и количества вещества продукта реакции по известным массам и количествам веществ, взятых для реакции, одно из которых дано в избытке.
При решении задач этого типа важно выработать у учащихся понимание того, что количества веществ, вступающих в реакции и получающихся в результате реакции, строго определенные и пропорциональны коэффициентам в уравнении реакции. Поэтому, если даны два исходных вещества, необходимо найти, какое из них в избытке, какое в недостатке, и дальнейшие расчеты вести по недостатку. Судить об избытке или недостатке удобнее всего по количеству вещества, а не по его массе.
Задача: При синтезе хлороводорода взяты хлор массой 710 г и водород массой 22 г. Вычислить массу полученного хлороводорода.
Решение:
Составляем уравнение реакции:
710 г 22 г y г
Cl2 + H2 = 2HCl
n = 1моль n = 1 моль n = 2 моль
M=71 г/моль M=2 г/моль M=36.5 г/моль
Согласно уравнению n(Cl2) = n(H2), проверим, в каких количествах они введены в реакцию:
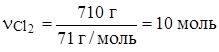
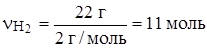 .
.
(недостаток)
Решаем по Cl2:
n(HCl) = 2n(Cl2), то есть n(HCl) = 20 моль.
m(HCl) = M · n, m(HCl) = 36.5 г/моль · 20 моль = 730 г.
Дата добавления: 2015-08-21; просмотров: 1324;
